胸腔积液中肺腺癌细胞发生胶原化的形态观察与研究
2014-01-17姜海娇郭小宁方长清李建华
姜海娇 郭小宁 方长清 祝 迪 李建华
(中国医科大学附属第一医院病理科暨中国医科大学病理教研室 沈阳110001)
目前恶性肿瘤仍是威胁人类生存的天敌,而肺癌已成为全球发生率最高的恶性肿瘤之一 ,在北美,肺癌的死亡率居各大肿瘤之首,甚至超过乳腺癌、结肠癌和前列腺癌死亡率的总和。在我国,肺癌的发病率死亡率也迅速上升[1],肿瘤的侵袭和转移是引起患者死亡的重要原因,而肺腺癌晚期时常发生胸腔转移形成胸腔积液。在长期的临床细胞病理诊断当中经过大量的细胞形态学观察我们发现在肺腺癌的一些细胞学标本中癌细胞的胞浆内有一些围绕胞核成葱皮状改变的纤维样结构,尤以恶性胸水中的腺癌细胞为明显。从肺腺癌细胞形态学上的观察引发了我们的一个假设:肺癌胸水中的中晚期肺腺癌细胞是不是同某些发生了纤维化的器官组织一样发生了纤维化、胶原化而分泌胶原蛋白?
为验证肿瘤细胞也可分泌胶原蛋白这一假设,我们利用Masson特殊染色、免疫细胞化学、Western-blot方法检测胶原纤维及胶原蛋白亚型在肺腺癌细胞中的表达情况并探讨其意义。
材料和方法
1.材料
(1)临床资料 2013年1月至2013年11月中国医科大学附属第一医院病理科液基薄层细胞学检查涂片数千例筛选做过细胞包埋蜡块的病例,所有患者术前未经任何治疗。这些病例结合临床病史、影像学诊断及细胞病理证实为肺腺癌的共224例,其中恶性胸水144例,支气管肺泡灌洗液(BALF)石蜡包埋细胞标本40例,痰石蜡包埋细胞标本40例;另有对照24例为良性胸腔积液增生上皮石蜡包埋标本,男性126例,女性98例,平均年龄57.56岁(89岁-22岁)。
(2)细胞沉渣标本 经诊断为肺腺癌的胸水、痰、肺泡灌洗液脱落细胞离心取沉渣,将沉渣转移至EP管,放-70℃冰箱冻存;来自于胸水增生上皮沉渣的收集同上。
(3)主要试剂 羊抗人COL1A1COL3A1多克隆抗体、鼠抗人COL2A1单克隆抗体(Santa Cruze,美国),兔抗山羊、羊抗鼠二抗(北京中杉金桥),鼠抗人CK7、TTF-1、Vimentin单克隆抗体(Bio Genex,美国),S-P组化试剂盒,masson氏改良三色染料(厦门迈威生物科技有限公司)。
2.方法
(1)透射电镜技术 对恶性胸腔积液的石蜡包埋标本制成的超薄切片进行透射电镜成像观察。
(2)Masson特殊染色 石蜡细胞学切片常规烤片,脱蜡,水化;A试剂(苏木素染色液)染色5min,盐酸酒精分色,水洗返蓝;B试剂(Masson氏改良三色染料)常温过夜,水洗至无染料脱落;C试剂(0.2%冰醋酸溶液)洗30s;梯度酒精脱水,二甲苯透明,中性树胶封片;显微镜下观察。
Masson特殊染色结果判定:细胞胞浆或者胞膜上呈现亮绿色或者蓝色颗粒为阳性染色。
(3)免疫细胞化学技术 石蜡包埋细胞学标本4μm厚切片常规烤片、脱蜡、水化,采用链霉素抗生物素蛋白-过氧化物酶法(Streptavidin-peroxidase,S-P)按说明书行免疫组化染色。COL1A1、COL2A1、COL3A1一抗稀释浓度均为1∶50,二抗浓度1∶500,CK7、TTF-1、Vimentin抗体均为即用型抗体。以PBS代替一抗做阴性对照。
结果判定标准:免疫细胞化学染色结果COL1A1 、COL2A1 、COL3A1、CK7 和 Vimentin抗体镜下细胞胞浆或胞膜有棕黄色颗粒为阳性染色细胞;TTF-1抗体镜下胞核有棕黄色颗粒为阳性染色细胞,切片中观察5个高倍视野(×200),每一视野计数100个细胞,阳性染色细胞数<5%为阴性,≥5%为阳性。
(4)Western blot技术检测COL1A1、COL2A1和COL3A1蛋白在细胞中的表达 总蛋白从收集的细胞沉渣标本中提取,冰上超声处理,4℃静置孵育15min,4℃离心45min(15000r/min),提取上清,用Bradford法测定蛋白浓度。以每孔80μg蛋白加入8%SDS-PAGE凝胶电泳后,4℃80V下湿式电转仪将蛋白转到PVDF膜上,5%脱脂奶粉封闭液封闭2h,在PVDF膜上孵育一抗(COL1A1 1∶500,COL2A1 1∶500,COL3A1 1∶500)4℃过夜,相应二抗(1∶5000)37℃下孵育2h,作用后PVDF膜与ECL反应显色,以β-actin为内参照。
3.统计学方法
应用SPSS17.0统计分析软件进行分析,胶原纤维在肺腺癌不同细胞学标本中的表达率采用卡方检验,Collagen protein亚型之间的相关性采用非参数Spearman等级相关分析,P<0.05为有统计学意义。
结 果
1.液基薄层细胞学检查和透射电镜观察到有纤维葱皮样结构存在的肿瘤细胞均为肺腺癌细胞且有间质细胞的特征
经过TCT,我们在胸腔积液的恶性肿瘤细胞胞浆中观察到一些围绕胞核呈葱皮样改变的纤维样结构(图1A),而在肺泡灌洗液和痰的恶性肿瘤细胞中及良性胸水增生上皮细胞中始终没发现这种结构(图1B,C,D)。透射电镜下观察到在肿瘤细胞胞浆中可见细胞核和多量的纤维样物质,局部放大显示纤维样物质可聚集存在。(图2)。在细胞石蜡包埋切片的HE染色中这种结构更加凸显的出现在肿瘤细胞中(图3A),甚至有的肿瘤细胞核已经消失,完全被这种胶原纤维结构取代(图3B),进一步做了免疫细胞化学染色 TTF-1、CK7和 Vimentin(图4),证实了这些肿瘤细胞均为肺腺癌细胞并且具有间质细胞的特征。
2.胶原蛋白亚型在肺腺癌细胞中的表达及相关性
(1)胶原蛋白免疫细胞化学结果
免疫细胞化学结果显示:COL1A1、COL2A1和COL3A1在肺腺癌细胞中的阳性表达率分别为:22.6%(38/168),5.4%(9/168),22.6%(38/168),阳性表达主要定位于胞浆(图5A,C,E),而在增生的上皮细胞中不表达(图5B,D,F).统计学分析结果显示COL1A1、COL3A1的表达率要显著高于COL2A1的表达率(P=0.024),并且我们发现 COL1A1与COL3A1的表达成正相关性(r=0.886,P=0.000)(表1)。

表1 COlA1、COl2A1、COl3A1阳性表达的相关性Table 1 The relationship between COlA1、COl2A1 and COl3A1expression
2.胶原纤维在肺腺癌的不同细胞学标本中的表达情况
Masson特殊染色显示胶原纤维在胸腔积液肺腺癌细胞中的表达率为59.7%(86/144),在支气管肺泡灌洗液及痰的腺癌细胞中表达率分别为0%(0/40)、0%(0/40),在良性胸腔积液增生上皮中不表达(0/12)(表2),阳性表达为在肿瘤细胞胞浆或胞膜内成一种亮绿色(图6)。

表2 胶原纤维在肺腺癌细胞中的表达情况Table 2 The expression of collagen protein in lung adenocarcinoma cells
(2)Western-blot结果
Western-blot法检测胶原蛋白亚型在肺腺癌细胞中的表达 参照DNA分子量标准,肺腺癌细胞中可见在130KD,190KD,110KD附近有特异性条带,对应位置分别为COL1A1,COL2A1,COL3A1,而在良性胸水增生上皮中表达缺失(图7)。
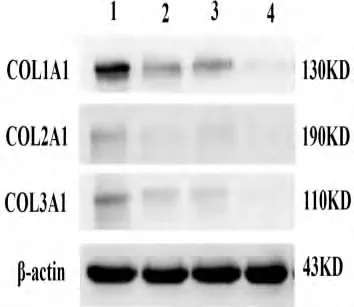
图7 肺腺癌细胞及增生上皮中Collagen protein亚型的表达
讨 论
细胞外基质(Extracellurar Matrix,ECM)是由细胞所分泌的大分子物质,构成复杂的网架结构,支持并连接组织结构、调节组织的发生和细胞的生理活动。细胞外基质的降解是癌细胞侵袭和转移的重要步骤。组成细胞外基质的成分有多糖类及一些蛋白,而胶原蛋白是组成细胞外基质的主要组成成分,目前已发现的形成纤维的胶原蛋白至少有27种[2,3],Ⅰ、Ⅱ、Ⅲ型胶原是占比例最大的胶原类型[4],在组织中分布广泛,其改变与多种遗传性胶原病、纤维化疾病、骨质疏松等疾病有关。关于胶原蛋白尚无在肿瘤细胞内的研究,对于其的研究多数是集中在细胞外的环境,而本实验已经证实了一些肺腺癌细胞内有胶原蛋白表达,其能够分泌胶原蛋白。
人类的恶性肿瘤大多数是癌,而在癌症相关的死亡病例中90%是由于肿瘤的侵袭和转移引起的。转移是一个复杂的多步骤的过程,一般包括恶性细胞的局部侵袭,散播,最后定植在远处地点导致了转移灶的形成。多数研究证明上皮细胞间质转化(Epithelial-mesenchymal transition EMT)在 肿 瘤细胞的侵袭和远处转移中起着重要作用,且与肿瘤细胞发生耐药有关[5,6]。因而已成为肿瘤研究中的一个热点。所以对于肺癌EMT现象的研究可能有助于进一步寻找肺癌多元化的综合治疗模式。
上皮细胞间质转化是一种基本的生理病理现象,参与胚胎、组织重建和肿瘤转移,上皮细胞表型的缺失及间质特性的获得是其主要特征[7]。EMT最早发现于发育生物学,Garry Greenburg与Elisabeth Hay经细胞实验证明上皮细胞会暂时丧失他们的细胞极性,并且表现出具有移行能力的间质细胞特征,正式提出EMT的概念[8]。以后的研究证实[9-10],EMT在胚胎发育、组织发生中起重要作用。更为值得注意的是,EMT在多种恶性肿瘤的侵袭和转移过程起着重要作用,文献报导,在卵巢癌中[11],在乳 腺 癌 中[12],胃癌中[13],鼻 咽癌中[14],膀胱癌中[15],恶性黑色素瘤中[11]等都存在着上皮细胞间质转化。由于EMT,癌细胞的活动性更为自如并且获得了与胚胎时期间充质细胞相似的特征而变得更有侵袭性。在EMT过程中,上皮细胞的标记物如E-钙黏蛋白(E-cad)、a-连环素(a-catenin)、β-连环素(β-catenin)、γ-连环素(γ-catenin)等表达下调,间充质细胞标记物如Vimentin、纤维连接蛋白、N-钙黏蛋白(N-cad)、a-SMA 等表达上调,以及诱导EMT的细胞因子和转录因子如Snail、Slug、Twist、成纤维细胞特异蛋白(FSP1)、Rho、转化细胞生长因子(TGF-B)、成纤维细胞生长因子(FGF)等亦表达上调[6]。
这些观点就为我们的假设提供了依据,EMT促进了肺癌的侵袭和转移,侵袭到胸腔或者远处组织器官的肿瘤细胞继续生长繁殖,发生了EMT的细胞在获得了间质细胞的特性后产生间质的一些成分(如胶原蛋白),且发生了胶原化。
本实验中观察到有纤维样结构的肿瘤细胞经证实均为肺腺癌细胞且间质细胞的标记物Vimentin阳性表达.这说明了这些肿瘤细胞可能发生了EMT且同时胶原纤维在恶性胸腔积液的腺癌细胞中表达率为59.7%,这提示肿瘤细胞在发生了EMT的过程中产生了胶原纤维。而我们的Western-blot定量分析了胶原蛋白在肺腺癌细胞学标本的表达情况,显示了胶原蛋白在转移的腺癌细胞中具有较高的含量,在痰和肺泡灌洗液的腺癌细胞中也可以看到少量表达,这与Masson染色结果不一致,其可能是肿瘤细胞提取纯度不高所致。免疫细胞化学结果显示:COL1A1和COL3A1的表达率为22.6%,而COL2A1的表达率为5.4%,统计结果显示,COL1A1和COL3A1表达率要显著高于COL2A1的表达率,并且COL1A1和COL3A1之间成正相关性。正如前文所讲,器官组织发生纤维化时主要是细胞外基质成分的异常增多,而细胞外基质中主要是纤维性胶原蛋白Ⅰ、Ⅲ的异常增多[16]。
结果中Masson染色和免疫细胞化学染色显示胶原蛋白表达之间有差异性可能是因为后者特异性更好的原因,Masson染色检测的胶原纤维是由多种类型的胶原蛋白构成,而不单单是Ⅰ、Ⅱ、Ⅲ型,本实验免疫细胞化学只检测了Ⅰ、Ⅱ、Ⅲ型胶原蛋白的表达,也可能有更复杂的胶原蛋白亚型存在,因而表达率要比Masson染色的低。
本研究从不同角度检测到了肺腺癌细胞内有胶原蛋白,从细胞学角度提出了肿瘤细胞同样可以同组织器官一样发生胶原化这样的观点,但是从三种标本胶原蛋白表达率的差异性分析,肺腺癌细胞什么时候发生胶原化及其发生机制尚有待进一步探讨。
肺腺癌细胞发生胶原化后,化疗药物就很难进入癌细胞内,这样就可以为非小细胞肺癌的临床治疗提出一个新的理念:努力寻找一种能够抑制肿瘤细胞发生EMT的药物,进一步阻止细胞产生胶原蛋白发生纤维化,从而为肺癌的临床个体化用药、耐药的逆转研究及肺癌的分子靶向治疗等提供科学依据。
图 版 说 明
图1 液基细胞薄层涂片中有纤维样结构的肿瘤细胞及增生上皮细胞A:胸水TCT中有纤维样结构的肿瘤细胞(胞浆中)(巴氏染色 ×600);B:痰TCT中无纤维样结构的肿瘤细胞(巴氏染色 ×600);C:BALF TCT中无纤维样结构的肿瘤细胞(巴氏染色 ×600);D:胸水TCT中无纤维样结构的增生细胞(巴氏染色 ×600)
图2 透射电镜下观察到细胞核(黄色箭头),纤维成聚集状(蓝色箭头)。
图3 肿瘤细胞沉渣切片A:肿瘤细胞胞浆围绕胞核的纤维葱皮样结构(黑色箭头)(HE染色 ×600);B:肿瘤细胞核已经消失完全被纤维样结构取代(黑色箭头)(HE染色 ×600);C:肿瘤细胞内无纤维样结构(HE染色 ×600)
图4 TTF-1、CK7、Vimentin在肿瘤细胞中的表达A:TTF-1在肺腺癌细胞中强表达(免疫细胞化学染色×400);B:CK7在肺腺癌细胞中强表达(免疫细胞化学染色 ×400);C:Vimentin在肺腺癌细胞中表达(免疫细胞化学染色 ×400)
图5 胶原蛋白亚型在肺腺癌细胞的表达A:COL1A1在肺腺癌细胞中强表达,以胞浆为主(免疫细胞化学染色 ×600);B:COL1A1在增生细胞中不表达(免疫细胞化学染色 ×600);C:COL2A1在肺腺癌细胞中强表达,以胞浆为主(免疫细胞化学染色 ×600);D:COL2A1在增生细胞中不表达(免疫细胞化学染色 ×600);E:COL3A1在肺腺癌细胞中强表达,以胞浆为主(免疫细胞化学染色 ×600);F:COL3A1在增生细胞中不表达(免疫细胞化学染色 ×600)
图6 细胞学标本的Masson染色A:肺腺癌细胞的Masson染色阳性表达,胞浆和胞膜呈亮绿色改变 ×600);B:增生细胞的 Masson染色,不表达 ×400)。
EXPLANATION OF FIGURES
Fig.1Fiber-like structures in tumor cells and hyperplastic epithelial cells(TCT)A:Fiber-like structures of tumor cells in pleural fluid(cytoplasm)(Pap staining ×600);B:No fiber-like structures of tumor cells in sputum (Pap staining ×600);C:No fiber-like structure of tumor cells in BALF(Pap staining×600);D:No fiber-like structure of proliferating cells in pleural fluid(Pap staining×600)
Fig.2The nucleus(yellow arrow)and fiber gathering (blue arrow)were observed by TEM
Fig.3Tumor cells sediment slices A:Fiber onion skin-like structure surrounding the nucleus in cytoplasm of tumor cells(black arrow)(HE staining×600);B:The nucleus of tumors had disappeared completely and replaceed by fiber-like structures(black arrow)(HE staining ×600);C:No fiber-like structures in tumor cells(HE staining×600)
Fig.4The expression of TTF-1,CK7,Vimentin in tumor cells A:TTF-1strongly expression in lung adenocarcinoma cells(Immunocytochemistry ×400);B:CK7strongly expression in lung adenocarcinoma cells(Immunocytochemistry×400);C:Vimentin expression in lung adenocarcinoma cells(Immunocytochemistry×400)
Fig.5The expression of Collagen isoform in lung adenocarcinoma cells A:COL1A1strongly expression in lung adenocarcinoma cells,mainly in the cytoplasm(Immunocytochemistry×600);B:COL1A1no expression in proliferating cells (Immunocytochemistry × 600);C:COL2A1 strongly expression in lung adenocarcinoma cells,mainly in the cytoplasm(Immunocytochemistry ×600);D:COL2A1no expression in proliferating cells(Immunocytochemistry×600);E:COL3A1strongly expression in lung adenocarcinoma cells,mainly in the cytoplasm(Immunocytochemistry×600);F:COL3A1no expression in proliferating cells (Immunocytochemistry ×600)
Fig.6The Masson staining of cytology specimens A:Positive expression of lung adenocarcinoma cells ,cytoplasm and membrane was bright green ×600);B:No expression of proliferating cells×400)

[1]叶挺,蒋伟,王群等.肺癌上皮间质-转变现象的研究进展.复旦学报,2009,36(3):372-375
[2]Pihlajaniemi T.Many dimensions of extracellular matrix research.Duodecim,2013,129(21):2262-2272
[3]Pace,James M,Corrado,et al.Caterina;Idetification,characterization and expression analysis of a new fibrillar collagen gene,COL27A1.Matrix Biology,2003,22(1):3-14
[4]武继民,今村 保忠,水野 一乘等.Ⅲ型和Ⅴ型胶原的制备及其结构研究.中国生化药物杂志,2003,24(5):239-241
[5]Fariz Nurwidya,Fumiyuki Takahashi,Akiko Murakami,et al.Epithelial mesenchymal transition in drug resistance and metastasis of lung cancer.Cancer Res Treat,2012,44(3):151-156
[6]Guarino M,Rubino B,Ballabio G.The role of epithelialmesenchymal transition in cancer pathology.Pathology,2007,39(3):305-318
[7]Hay ED.The mesenchymal cell,its role in the embryo,and the remarkable signaling mechanisms that create it.Dev Dyn,2005,233(3):706-720
[8]Robert L.The extracellular matrix in development and regeneration.Int J Dev Biol,2004,48(8):687-694
[9]Boyer B,Vallés AM,Edme N.Induction and regulation of epithelial-mesenchymal transitions.Biochem Pharmacol,2000,60(8):1091-1099
[10]Thiery J P.Epithelial-mesenchymal transitions in tumour progression.CurrOpin Cell Biol,2003,15 (6):740-746
[11]Bagnato A,RosanòL.Epithelial-Mesenchymal Transition in Ovarian Cancer Progression:a crucial Role for the endothelin axis.Cells Tissues Organs,2007,185(1-3):85-94
[12]Blick T,Widodo E,Hugo H,et al.Epithelial mesenchymal transition traits in human breast cancer cell lines.Clin Exp Metastasis,2008,25(6):629-642
[13]Matsumura T,Makino R,Mitamura K,et al.Frequent down-regulation of E-cadeherin by genetic and epigenetic changes in the malignant progress of hepatocellular carcinomas.Clin Cancer Res,2001,7(3):594-599
[14]Horikawa T,Yang J,Kondo S,et al.Twist and Epithelial-mesenchymal transition are induced by the EBV oncoprotein latent membrane protein 1and are associated with metastatic nasopharyngeal carcinoma.Cancer Res,2007,67(5):1970-1978
[15]Baumgart E,Cohen MS,Neto BS,et a1.Identification and prognostic significance of an epithelial-masenchymal transition expression profile in human bladder tumors.Clin Cancer Res,2007,13(6):1685-1694
[16]Iwano M,Plieth D,Danoff TM,et al.Evidence that fibroblasts derive from epithelium during tissue fibrosis.J Clin Invest,2002,110(3):341-350
