同步萃取Ni、Co和Zn在MH/Ni电池回收中的研究
2014-01-16王一乔苏玉长肖连生
王一乔,苏玉长,肖连生,曾 理
(1.中南大学材料科学与工程学院,湖南长沙 410083;2.先进储能材料国家工程研究中心,湖南长沙 430205;3.中南大学冶金与环境学院,湖南长沙 410083)
镍氢电池正极材料氢氧化镍中,主要金属元素为Ni,此外,Co、Zn和稀土金属(Re)都是必不可少的掺杂元素。传统的电池回收方法是将电芯用硫酸酸浸,浸出液通过化学沉淀,除去Re和Fe,P204萃取,除杂,分步除去Mn和Zn及残余的Re和Fe,得到仅含Ni和Co的溶液,再通过P507萃取分离Ni和Co,最后浓缩结晶,得到Ni和Co的工业级产品[1]。
该方法工艺成熟,但存在以下不足:化学沉淀除杂会造成有价金属Ni、Co的损失,一般工业上除杂的损失率在0.5%左右[2];化学除铁工序会残余极少量的Fe3+,将在后续P204萃取除杂中产生影响萃取过程的黄色Fe沉淀,影响分相效果,在持续反应中还会出现累积效应[3];P204萃取除杂将Zn作为杂质除去,但Zn与Ni、Co一样,在镍氢电池中都属于必要金属元素,反萃过程中Zn的单独回收导致成本增加;结晶是能耗较高的工序,导致成本较高[4]。实际作业过程中,还存在自动化程度不高、废水废气较多及操作过程繁杂等问题,与现代化、智能化生产的要求不符。
HBL110萃取剂是肟酸类复配混合萃取剂,具有优良的Ni/Co分离和Ni/Fe分离性能。在低质量浓度(<5~7 g/L)Cu、Ni、Co 的 H2SO4溶液中,它可实现有价金属 Cu、Ni、Co 与杂质元素 Fe、Cr、Mn、Mg、Ca 等的分离,回收 Cu、Ni、Co 等金属。由于具有对Ni较高的选择性,HBL110主要用于在红土镍矿浸出液中进行镍和铁的分离。HBL110还表现出对稀土金属的少量选择萃取性[5]。
考虑到稀土金属单独回收已有成熟的沉淀分离和萃取分离工艺[6],本文作者利用HBL110的特点,从废旧镍氢电池去稀土浸液中,直接萃取Ni、Co和Zn,找出各因素对萃取效率和结果的影响,以提高萃取效率和与其他元素的萃取分离效率,为电池回收利用提供一种思路。
1 实验
1.1 原料准备
萃原液:将废旧车用动力镍氢电池(湖南产)用0.5 mol/L H2SO4(湖南产,AR)浸出,将滤液按 n(Re)∶n(Na)=1∶1加入过量3倍的Na2SO4,在60℃下搅拌30 min后过滤,进行稀土分离,得到去稀土浸出液,再用4 mol/L NaOH(湖南产,AR)调节至合适的pH值,得到萃原液。
空载有机相:萃取剂HBL110(湖南产,工业级),用5 g/L H2SO4(湖南产,AR)洗至水相无色透明,再加入2 mol/L NaOH(湖南产,AR),皂化至合适pH值。pH值的检测方法为:用3C-pH计(上海产)检测皂化后的水相pH值。
1.2 实验过程
实验过程包括4个步骤:①量取适量的萃原液和空载有机相,依次加入到指定的梨形分液漏斗中;②将分液漏斗放入恒温水域振荡器,进行震荡,使得油相和水相充分混合,并完成离子交换;③将震荡完毕的分液漏斗静置分相,直到油相和水相的相界面清晰无气泡;④将分相完毕的水相分离出来,得到萃余液,并进行元素分析。
1.3 分析检测
用AAnalyst100原子吸收分光光谱仪(美国产)对萃原液和萃余液进行元素分析,检测参数均为标准参数[7]。
1.4 计算萃取率
采用按式(1)计算萃取率。

式(1)中:C萃原液、C萃余液分别为萃原液和萃余液的金属离子质量浓度。
2 结果与讨论
废旧车用动力电池经浸出和稀土分离,调节pH值,得到萃原液,各元素的质量浓度分析结果为:Ni 16.042 g/L、Co 1.385 g/L、Zn 0.205 g/L、Fe 0.121 g/L,Mn 0.442 g/L,其他元素痕量。
萃取剂HBL110通过控制溶液的pH值来实现元素分离。在萃取红土镍矿浸出液时,通过皂化,控制有机相的pH值为3.5~4.0,萃原液的pH值为3.0,且萃余液和萃原液pH保持基本一致,即可实现Ni和Fe的分离[8]。实验中,控制有机相的pH值为3.5~4.0,萃原液的pH值为3.0。
萃取工艺包括级数、萃原液的pH值、有机相的pH值和相比等。萃原液中的元素主要为 Ni、Co、Zn、Fe和 Mn等5种,因此萃取率主要考察这5种元素的萃取率情况。
2.1 逆流萃取级数的影响
依据在红土镍矿提纯过程中的萃取经验,控制有机相体积配比中肟酸类HBL110占27%、协萃剂占25%及磺化煤油占48%,萃取体系pH值为3.0~4.0时,空载有机相的萃取金属离子的饱和质量浓度为3.0~5.5 g/L。按萃原液Ni、Co和Zn总质量浓度为17~18 g/L计算,理论上相比3∶1~6∶1即可确保萃取剂将所有的Ni、Co和Zn萃取到油相中。相比是指在逆流萃取过程中油相和水相的体积比,可近似等同于萃原液中需要萃取的金属离子浓度与空载有机相饱和容量的比值。HBL110在逆流萃取时,单级萃取率约为80% ~85%,逆流萃取理论上3-4级,即可达到萃取彻底(Ni、Co和Zn 的质量浓度 <0.1 g/L)[9],控制相比4∶1(取理论相比的中间值),分别进行3级逆流萃取和4级逆流萃取,结果见表1。
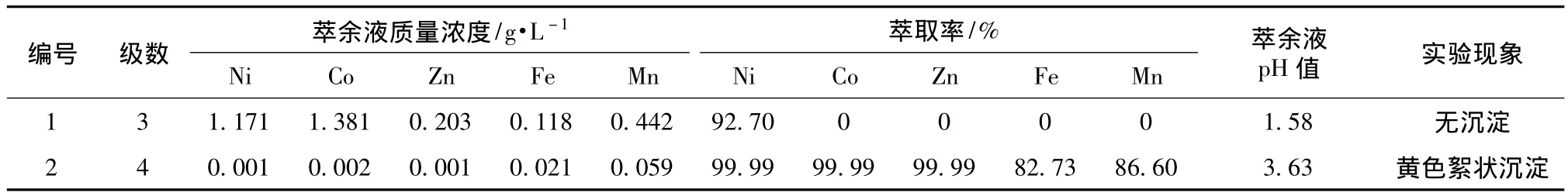
表1 逆流萃取级数对萃取率的影响Table 1 Effect of counter current series on extraction rate
逆流萃取级数对萃取效果的影响主要是:增加级数可延长萃取时间,使反应更彻底,但不能改变有机相的萃取容量。从表1可知,3级逆流萃取,Ni的萃取率均为92.70%,其他元素的萃取率为0%;而4级逆流萃取,不仅Ni、Co和Zn萃取率均为99.99%,其他杂质元素的萃取率也都达到了80%以上,未能有效分离有价金属和杂质金属。两组实验萃余液的pH值差别明显,相对于萃原液的pH值3.0,编号1萃余液pH明显下降,编号2萃余液pH明显上升。萃取体系pH值与空载有机相饱和容量呈正比关系,是导致萃取率产生显著差别的主要原因。只有萃取前后萃取体系的pH基本不变化或变化较小,才有利于整个萃取过程中有机相萃取饱和容量的稳定和萃取效率的保证。编号2在萃取过程中有黄色絮状沉淀生成,经检测为铁沉淀,原因为萃余液的pH值过高。铁沉淀使得相界面变得模糊,给萃取分相带来困难,该现象在连续萃取实验过程中出现了累积效应,导致相界面越来越模糊,不利于萃取的顺利进行。综合以上分析,为了优化萃取效果,应考虑在编号2的基础上降低萃取体系的pH值。
2.2 pH值的影响
降低萃取体系的pH值包括降低萃原液的pH值和降低空载有机相的pH值两种,萃余液的pH值变化是由反应过程产生的,无法直接在过程中调整。实验控制相比4∶1和逆流萃取级数4级,分别将空载有机相的pH值由3.5~4.0降低至3.0;萃原液的pH值由3.0降低至2.0,进行pH值对比,结果见表2,编号2为对照组。

表2 pH值对萃取率的影响Table 2 Effect of pH on extraction rate
从表2可知,随着空载有机相和萃原液pH值的降低,萃余液的pH值和萃取率降低。降低pH值,达到了避免产生铁沉淀的效果,说明降低pH值是可行的[10]。编号3出现了类似编号2的萃取效果,Ni、Co和 Zn的萃取率分别为99.99%、94.95%和86.0%,其他杂质元素的萃取率都在70%以上,编号4出现了类似编号1的萃取效果,Ni萃取率为92.70%,其他元素萃取率为0%。考虑到类似的萃取效果对应类似的萃余液pH值,控制好合适的萃余液pH值成为实验的关键。找到合适的pH值就能得到合适的空载有机相饱和容量,对比编号4和编号3的萃取率和萃余液pH值,理想萃余液的pH值应为1.50~3.32,从检测结果分析,应该更接近3.32。此外,萃余液pH值在1.50~3.63为敏感区间,即萃余液pH值变化率相对于萃原液pH值和空载有机相pH值变化率成倍数关系,这不利于产业化过程。在实际的工厂生产中,为降低出错的成本,最佳工艺条件应在一个较宽泛的范围内,即允许在一定范围内发生工艺控制异常。综合以上分析,可考虑通过调整相比来调整饱和容量,降低萃余液pH的敏感度,改善萃取效果。
2.3 相比的影响
考虑到相比较低的问题,在编号4的基础上通过提高相比来提高空载有机相饱和容量,以达到改善萃取效率的目的。实验控制级数4级,空载有机相的pH值为3.0,萃原液的pH值为2.0,进行相比提高对比,结果见表3,编号4为对照组。

表3 相比对萃取率的影响Table 3 Effect of phase ratio on extraction rate
从表3可知,萃取率随着相比的提高而增加,增加的幅度逐渐减少,萃余液的pH值也随着相比的提高而增加,但增幅不大,说明萃余液pH值的敏感度有所降低。结合红土镍矿的萃取情况,控制萃原液和萃余液的pH值都为3.0时,能达到Ni和Fe的最佳分离效果,因此应尽量控制萃余液的pH值不超过3.0。继续提高相比理论上有可能满足要求,但会导致成本提高和萃取量减少,经济性下降,不利于实际操作。在工厂萃取工序中,萃取剂价格对成本的影响往往更大,在减少萃取剂用量和降低萃取效果的敏感度上,需要找到一个平衡点。过低的萃余液pH值导致空载有机相饱和容量过低,是提高相比效果不明显的根本原因。可继续考虑提高萃原液pH值或空载有机相pH值,以达到提高萃余液pH值的目的。
2.4 优化实验
提高萃原液pH值或空载有机相pH值,都可达到提高溶液pH值的目的,实验暂选择略微提高萃原液pH值。控制相比6∶1,逆流萃取级数4级,提高萃原液pH值至2.3,进行逆流萃取,结果见表4,编号7为对照组。

表4 微调萃原液pH对萃取率的影响Table 4 Effect of fine adjusting pH on extraction rate
从表4可知,在该条件下,Ni的萃取率为99.98%,Co的萃取率为98.46%,Zn的萃取率为89.62%,而其他杂质元素不萃取。
3 结论
针对萃原液元素质量浓度Ni 16.042 g/L、Co 1.385 g/L、Zn 0.205 g/L、Fe 0.121g/L 及 Mn 0.442 g/L,Ni、Co和 Zn 总质量浓度为17~18 g/L的特点,控制萃原液pH值为2.3,空载有机相 pH值为 3.0,相比 6∶1,4级逆流萃取,可将99.98%的Ni、98.46%的Co和89.62%的Zn萃取到有机相中,其他杂质元素不萃取,萃取效率较高,分离效果较好。
HBL110是对溶液pH值特别敏感的萃取剂。在各影响因素中,提高相比和提高溶液pH值都能提高有机相的饱和质量浓度,从而提高萃取的效率。通过控制相比和溶液的pH值,使萃余液的pH值控制在尽量接近,但不超过3.0,实现了Ni、Co和Zn的同步萃取。该萃取剂对各元素的选择性依次为:Ni>Co>Zn>Fe>Mn。
用HBL110从除去稀土金属的硫酸浸出液中直接将Ni、Co和Zn同步萃取后,只需通过逆流反萃得到的Ni、Co和Zn的硫酸盐溶液,即可直接作为镍氢电池正极材料球镍的原料使用。该方法不需要进行化学除铁,能回避除铁带来的有价金属损失和铁沉淀的影响,还能绕过Zn的单独回收和高能耗的结晶工序。相对于传统的化学沉淀除杂工序,同步萃取镍钴锌还具有操作简单、自动化程度高、主要萃取试剂可循环使用及废水废气少等优点。
[1]HOU Xiao-chuan(侯晓川),XIAO Lian-sheng(肖连生),GAO Cong-jie(高从堦),et al.从废高温镍钴合金中浸出镍和钴的试验研究[J].Hydrometallurgy of China(湿法冶金),2009,28(3):164-168.
[2]WU Wei(吴魏),ZHANG Hong-lin(张洪林).废镍氢电池中镍、钴和稀土金属回收工艺研究[J].Chinese Journal of Rare Metals(稀有金属),2010,34(1):79 -84.
[3]XIA Li-bin(夏李斌),XIE Fa-zheng(谢法正),WANG Rui-xiang(王瑞祥).P507-Cyanex272协同萃取分离回收废旧镍氢电池中镍钴金属新工艺研究[J].China Nonferrous Metallurgy(中国有色冶金),2011(1):67-69.
[4]WEI Tao(魏涛),LONG Bing-qing(龙炳清),WANG Bin(王斌),et al.浅论废旧镍氢电池的资源化利用过程[J].Knowledge Economy(知识经济),2009(3):125-126.
[5]MO Xing-de(莫兴德),XIAO Lian-sheng(肖连生),ZHANG Guiqing(张贵清),et al.HBL110从红土镍矿加压浸出液中萃取镍的研究[J].Nonferrous Metals(有色金属),2014(6):30-33.
[6]HUANG Peng-mian(黄朋勉),LIU Zi-li(刘自力),ZHENG Miao(郑淼),et al.硫酸型稀土复盐的研制[J].Phosphate&Compound Fertilizer(磷肥与复肥),2003,18(4):56 -57.
[7]WANG Yang-jun(王杨军).AAnalyst 100/300原子吸收仪器维修及保养[J].Modern Instrument(现代仪器),2012,18(2):62 -63.
[8]ZHONG Yan-ping(钟燕萍),WANG Da-hui(王大辉),KANG Long(康龙).从废弃镍基电池中回收有价金属的研究进展[J].New Technology& New Process(新技术新工艺),2009(8):81-86.
[9]YU Rong-hua(玉荣华),GAO Da-ming(高大明),QIN Zuo-guan(覃祚观).用硫酸从镍氢电池负极板废料中浸出镍钴[J].Guangdong Chemical Industry(广东化工),2011,38(7):35 -36.
[10]ZHANG Bin(张彬),LUO Ben-fu(罗本福),GU Jing-chuan(谷晋川),et al.废旧镍氢电池回收再利用研究[J].Environmental Science& Technology(环境科学与技术),2014,37(1):135-143.
