锂离子电池二元硫化物电极材料的研究进展
2014-01-16廖友好李伟善
廖友好,李伟善
(华南师范大学化学与环境学院,电化学储能材料与技术教育部工程研究中心,广东高校电化学储能与发电技术重点实验室,广东广州 510006)
无机硫化物电极已用于锂离子电池,如Exxon公司设计的TiS2/Li电池[1]。金属锂负极在充放电过程中不能完全可逆的沉积与溶解,同一个方向沉积下来的金属锂会累积并产生枝晶。枝晶锂(死锂)不仅降低了负极的容量,还会刺破隔膜,导致电池短路,引发严重的安全问题,导致TiS2/Li电池未能商业化。采用层状的石墨代替金属锂负极,同时配置在高电位下可自由嵌脱Li+的层状钴酸锂(LiCoO2)作为正极材料,促成了锂离子电池的商业化。无机硫化物锂离子电池,也可通过采用层状电极材料来避免使用金属锂负极带来的问题。研究者又重新开始关注硫化物电极材料,并进一步研究性能,期望继续扩大硫化物电极材料在锂离子电池中的应用范围。
针对目前硫化物电极材料的发展现状,本文作者综述了常见二元硫化物的制备方法、性能及可能的改进措施。
1 常用二元硫化物
1.1 硫化钛
目前,应用于锂离子电池的硫化钛主要有两种:TiS2和TiS3,其中,TiS2是最早应用于锂离子电池的无机硫化物。M.S.Whittingham等[1]发现:在充放电过程中,Li+能够可逆地在层状LixTiS2中嵌脱,同时伴随着Ti(Ⅳ)/Ti(Ⅲ)可逆电对的还原氧化。常温下,该材料嵌脱锂的反应速度非常快,但不会改变LixTiS2主体的层状结构;循环1 100次后,能够至少保持理论容量的70%。为了提高硫化物电池的安全性能,人们尝试用其他液态电解质或全固态电解质取代传统易燃、易爆的有机溶剂组成的液态电解质。S.I.Moon等[2]采用浇铸涂膜法制备了PEO与LiClO4混合的固体聚合物电解质(SPE)膜;组装成TiS2|SPE|Li结构的电池,TiS2本体电阻及界面电阻之和为96 Ω·m2。含40%SPE的TiS2电池以0.02 mA/cm2的电流密度在1.6~2.6 V放电,比容量达173 mAh/g,仅含TiS2的电池,放电比容量只有146 mAh/g;同时,电池的循环性能得到了提高。TiS3虽具有较高的理论容量及初始放电容量,但在循环过程中会发生结构破坏,导致容量锐减,因此在锂离子电池中的应用受到限制。
1.2 硫化钒
层状结构的钒金属也引起了研究者的关注。目前主要集中研究LiVS2/VS2和Li2VS2/LiVS2这两对电对的性能。虽然LiVS2与LiTiS2的结构相似,但作为起始电极的嵌脱锂性能不理想,往往通过LiVS2嵌脱锂的性能去了解VS2及Li2VS2的性能。为了提高上述两对电对的循环性能,K.Takada等[3]将反应前驱体Li2S及V2S3按照计量比混合研磨、压片,放入抽真空的石英管中,在700℃下煅烧48 h,制得LiVS2,研究电极在固体电解质0.01Li3PO4-0.63Li2S-0.36SiS2中的电化学行为。Li2VS2/LiVS2及LiVS2/VS2两对电对均高度可逆,可以分别在0~0.8 V及0.8~2.3 V可逆循环,两对电对的比容量分别约为190 mAh/g和160 mAh/g。LiVS2/VS2电对可逆循环的原因,可能是固体电解质阻止了VS2的分解反应。A.Gupta 等[4]研究了 Li1+xV1-yMyS2(M=Cr、Ni;y=0、0.1;x≤0.8)的嵌脱 Li+行为。发现:在 0.1 C倍率下,Li1+xVS2活性物质从八面体结构转变为四面体结构后,在1.0 V处出现V(Ⅲ)/V(Ⅱ)稳定的电压平台,随着充放电电流的增大,LiVS2/Li2VS2的界面电阻增大,导致电压平台降低。在V位置掺杂Ni形成Li1+xV0.9Ni0.1S2,嵌入锂电位相对于Li1+xVS2提高0.1~0.2 V,但损失了部分放电比容量;而在V位置用Cr部分取代形成Li1+xV0.9Cr0.1S,对电压平台没有影响,但能明显提高循环稳定性。
1.3 硫化铌
在电池体系中使用较多的硫化铌主要有NbS2和NbS3。NbS2有两种比较特殊的六方结构:在单位晶胞中含有两层NbS2的2H-NbS2结构和在单位晶胞中含有三层NbS2的3RNbS2结构。NbS2层与层之间靠微弱的范德华力连接,Li+很容易嵌脱八面体位置的三明治层。这两种结构的差异是由NbS6三棱柱叠加顺序不同,导致Li+位置的改变而引起的。
G.L.Holleck等[5]将层状NbS2用做锂离子电池的正极材料,只是为了比较TiS2的性能。N.Kumagai等[6]将Nb与S在900℃下反应3 d,合成2H-NbS2,同时在700℃下反应3 d,合成3R-NbS2,比较了两种电极的电化学性能。使用1 mol/L LiClO4/PC电解液组装的半电池,在1.1~4.1 V很容易通过电化学充放电的方法获得LixNbS2(0≤x≤1),但容量及循环性能差别很大。当电流密度为0.20 mA/cm2时,2H-LixNbS2的首次放电比容量约为100 mAh/g,第10次循环时下降至75 mAh/g;而3R-LixNbS2的首次放电比容量约为180 mAh/g,循环100次后仍有约150 mAh/g,循环性能更好。为了提高2H-LixNbS2的性能,Y.H.Liao等[7]通过合成2HLi0.7NbS2的硫化物,对2H-NbS2性能进行研究,发现2HNbS2的嵌脱Li+性能比3R-NbS2好,可能的原因是初始结构中嵌入的部分Li+,在循环过程中即使发生Li+的嵌脱,也不会给层状结构带来明显的膨胀而破坏2H-NbS2的结构。NbS3在循环初期具有很高的容量,但衰减特别快,可能是因为在循环过程中伴随着结构的不可逆转变。
1.4 硫化钼
MoS2和MoS3是在锂离子电池中应用较广泛的两种硫化钼。特别是Moli公司推出Li/MoS2锂离子电池后,硫化钼的研究得到了广泛关注[8]。作为负极储锂材料,MoS2的比容量是目前报导的硫化物中最高的,循环性能也较理想。X.Fang等[8]将商品化MoS2作为研究对象,分析了不同电压区间的储锂机理。MoS2以0.10 mA/cm2的电流密度在1.00~3.00 V循环,可逆比容量约为150 mAh/g;而在0.01~3.00 V循环,可逆比容量为800 mAh/g。在两个电压区间的循环性能都比较好,但在首次放电时,结构发生了不可逆的转变。1.00~3.00 V的嵌脱锂产物可以立即溶解与析出;深度放电至0.01 V时,MoS2还原成Li2S及金属Mo,金属Mo充电至3.00 V时仍不能氧化,因此Li2S/S作为唯一的氧化还原电对进行循环,而非LixMoS2。此时,嵌脱锂反应的主体变为纳米金属钼及锂硫化合物(Mo/Li2Sx,1<x<8)。纳米颗粒状的金属钼被认为是提高电池循环稳定性的主要原因。因为钼在Mo/Li2Sx纳米组分的界面或者晶界部分储存能量的过程中起了电子导电相的作用,同时,抑制了氧化还原电对在电解液中的溶解。
采用不同形貌的碳源对MoS2进行改性,可提高MoS2的性能。K.Bindumadhavan等[9]将多壁碳纳米管(MWCNT)与MoS2研磨,两者质量比为1∶1的产物以100 mA/g的电流在0.01~3.00 V循环,首次充电比容量为1 214 mAh/g,循环60次的容量保持率约为85%。H.Hwang等[10]合成了由无序石墨烯组成的MoS2纳米板。层间距离的膨胀及石墨烯状物质的无序排列,使材料在0~3.0 V充放电时,50 C(53.1 A/g)倍率下仍有700 mAh/g的可逆比容量;测试了LiCoO2/MoS2扣式全电池的性能:以1 C在1.00~4.25 V循环,首次放电比容量为114 mAh/g,第60次循环的容量保持率为89%。
1.5 硫化铁
FeS和FeS2是目前研究较多的两种硫化铁。FeS的比容量可达609 mAh/g,电压平台约在1.6 V;FeS2的比容量约为894 mAh/g,同时出现2.3 V及1.6 V两个电压平台。C.Dong等[11]采用简单电化学沉积法将Ag包覆在FeS上,形成复合电极,以0.1 C的电流在0.8~2.5 V充放电,首次放电比容量为533.4 mAh/g,电流从0.1 C逐渐增大到1.0 C后,循环50次仍保持初始比容量的79.1%。在相同条件下测试FeS负极材料,首次比容量仅为425.8 mAh/g,保持率为29.1%。包覆Ag后容量提高的原因是提高了充电过程中Li2S的电子电导率及抑制了FeS在放电过程中的体积膨胀。D.Zhang等[12]用简单固相反应制备FeS2/C复合电极,孔状结构的FeS2周围全部包覆了无定形碳,提高了材料的可逆容量及循环性能。以0.05 C的电流在1.2~2.6 V循环50次,FeS2/C的比容量保持在495 mAh/g;而没有包碳的仅有345 mAh/g。这是因为提高了电子电导率,减少了单质硫的溶解及HF的腐蚀,在循环时稳定了FeS2的孔状结构。
1.6 硫化镍
在硫化镍中,NiS、Ni2S3、Ni3S4、NiS2、Ni7S6、Ni6S5和Ni3S4等都具有电化学活性,且与电解液的相容性较好。硫化镍的嵌脱锂机理与其他层状硫化物的过程不一样,一般硫化镍在嵌锂过程中被还原成单质Ni,伴随Li2S的生成;脱出锂的过程则生成相对应的硫化镍并释放出Li+。NiS电极具有较好的电子电导率及较高的比容量(590 mAh/g),在一次锂电池的研究中,发现 Li/NiS电池是比较好的体系[13]。S.C.Han等[13]采用机械合金化的方法合成了具有均匀纳米结构的NiS,并用作锂离子电池正极材料。在30℃下,NiS正极材料以100 mA/g的电流在1.0~3.0 V循环,比容量达到580 mAh/g;经过100次循环,比容量保持在400 mAh/g。J.Z.Wang等[14]通过溶剂热法合成了纯 Ni3S2及Ni7S6-NiS混合硫化镍,发现Ni7S6-NiS的容量高于纯Ni3S2,同时,离子液体与硫化镍电极的匹配性良好。
1.7 硫化钨
C.Feng等[15]用流变相反应法制备了WS2纳米片。产物以47.5 mA/g的电流在0.01~3.00 V循环20次,比容量保持在680 mAh/g,库仑效率约为90%,每次循环的容量衰减率约为0.69%。H.Liu等[16]采用真空辅助浸渍法制备了高比表面积、孔径分布比较窄的有序介孔结构WS2。产物以0.1 A/g的电流在0.01~3.00 V循环,第2次循环的放电比容量达871 mAh/g,第100次循环时仍有805 mAh/g,库仑效率约为98%;10 A/g时的比容量为503 mAh/g。该材料是目前报道的比容量、循环性能及倍率性能最好的硫化钨。
1.8 硫化锡
C.Zhai等[17]用简单水热法合成了超薄六方纳米片SnS2,产物以100 mA/g的电流在0.3~1.1 V循环50次,比容量为513 mAh/g,比容量保持率高达96%,优于商业化的石墨负极。Y.Li等[18]采用机械球磨法制备了循环稳定性好的纳米结构SnS,以40 mA/g的电流在0.02~1.50 V循环40次,可保持400 mAh/g的比容量。J.S.Zhu等[19]用均匀沉淀法合成了SnS-石墨烯纳米负极材料,以40 mA/g的电流在0.01~3.00 V循环30次,可逆比容量为679 mAh/g,比纯SnS或纯石墨烯的容量更高、循环稳定性更好。SnS可与石墨烯发生协同效应,提高整个体系的电化学性能。
1.9 硫化锆
J.T.Jang等[20]采用溶胶法合成的超薄纳米盘状结构ZrS2,厚度接近1.6 nm,用作锂离子电池负极材料时,显示出良好的纳米尺寸效应。以69 mA/g的电流从开路电位放电至0.005 V,首次不可逆比容量损失约为600 mAh/g。原因是在硫化锆层与层之间捕获了Li+,或形成了Li2S钝化层,而ZrS2还原成金属Zr后,伴随着Li-Zr合金的形成。ZrS2具有较低的电压平台、较窄的充放电电压范围、较高的初始容量、容量保持率及倍率性能,有望用作锂离子电池负极材料。
上述9种硫化物的物理、化学性能参数列于表1。
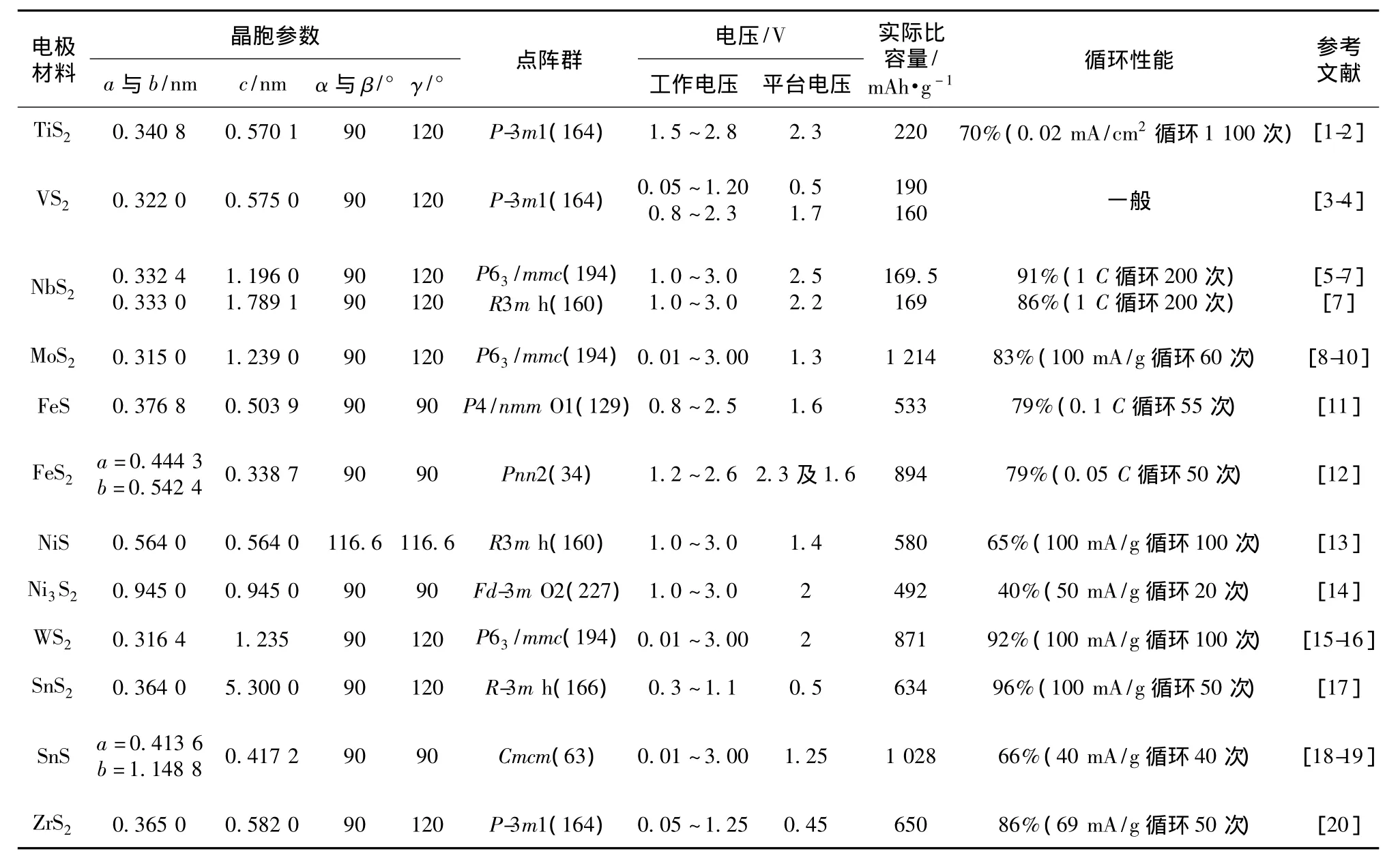
表1 各种二元硫化物的物理化学性能Table 1 Physical and chemical performance of various binary sulfide
2 其他硫化物
硫化铬、硫化铜、硫化锌和硫化钴等也是锂离子电池中研究较多的硫化物材料[21]。各类二元硫化物的嵌脱锂机理不尽相同,有些是直接在范德华层内嵌脱,有些是将金属元素进一步还原为金属单质,因而具有更高的嵌脱锂容量。掺杂是提高该类硫化物循环性能最佳的手段。以0.1 mA/cm2的电流密度在2.5~3.3 V循环,Li1-xCrS2电极的首次放电比容量只有30 mAh/g,掺杂钒形成Li1-xV0.25Cr0.75S2电极后增加至200 mAh/g,循环10次时,比容量仍有195 mAh/g,循环稳定性得到提高[21]。
3 展望
硫化物电极材料在液态电解质、聚合物电解质及固态电解质中已展开了应用,以硫化钛为代表的硫化物结合固体电解质使用后,显示了更好的电化学性能。
应针对硫化物的特性,采取不同方法改进缺点。例如,作为正极材料的硫化钛、硫化铌等,期盼通过掺杂、包覆或其他改进工艺提高电压平台;而容量较高的二元硫化物,如硫化钼、硫化锆等,则需进一步降低工作电压,以便用作负极材料。纳米化及与固态电解质结合使用,将成为二元硫化物的发展方向。
[1]Whittingham M S.Electrical energy storage and intercalation chemistry[J].Science,1976,192(4 244):1 126 -1 127.
[2]Moon S I,Kim J U,Jin B S,et al.Characterization of TiS2composite cathodes with solid polymer electrolyte[J].J Power Sources,1997,68(2):660 -663.
[3]Takada K,Inada T,Kajiyama A,et al.Research on highly reliable solid-state lithium batteries in NIRIM[J].J Power Sources,2001,97-98:762-764.
[4]Gupta A,Mullins C B,Goodenough J B.Electrochemical probings of Li1+xVS2[J].Electrochim Acta,2012,78:430 -433.
[5]Holleck G L,Driscoll J R.Transition metal sulfides as cathodes for secondary lithium batteries(Ⅱ).Titanium sulfides[J].Electrochim Acta,1977,22(6):647 -655.
[6]Kumagai N,Tanno K,Kumagai N.Charge-discharge characteristics and structural change in various niobium sulfide cathodes for lithium-nonaqueous secondary batteries[J].Electrochim Acta,1982,27(8):1 087 -1 092.
[7]Liao Y H,Park K S,Singh P,et al.Reinvestigation of the electrochemical lithium intercalation in 2H-and 3R-NbS2[J].J Power Sources,2014,245(1):27 - 32.
[8]Fang X,Hua C,Guo X,et al.Lithium storage in commercial MoS2in different potential ranges[J].Electrochim Acta,2012,81:155-160.
[9]Bindumadhavan K,Srivastava S K,Mahanty S.MoS2-MWCNT hybrids as a superior anode in lithium-ion batteries[J].Chem Commun,2013,49(18):1 823 -1 825.
[10]Hwang H,Kim H,Cho J.MoS2nanoplatesconsisting of disordered graphene-like layers for high rate lithium battery anode materials[J].Nano Lett,2011,11(11):4 826 - 4 830.
[11]Dong C,Zheng X,Huang B,et al.Enhanced electrochemical performance of FeS coated by Ag as anode for lithium-ion batteries[J].Appl Surf Sci,2013,265:114 -119.
[12]Zhang D,Mai Y J,Xiang J Y,et al.FeS2/C composite as an anode for lithium ion batteries with enhanced reversible capacity[J].J Power Sources,2012,217:229 -235.
[13]Han S C,Kim H S,Song M S,et al.Nickel sulfide synthesized by ball milling as an attractive cathode material for rechargeable lithium batteries[J].J Alloy Compd,2003,351(1 - 2):273 -278.
[14]Wang J Z,Chou S L,Chew S Y,et al.Nickel sulfide cathode in combination with an ionic liquid-based electrolyte for rechargeable lithium batteries[J].Solid State Ionics,2008,179(40):2 379 -2 382.
[15]Feng C,Huang L,Guo Z,et al.Synthesis of tungsten disulfide(WS2)nanoflakes for lithium ion battery application[J].Electrochem Commun,2007,9(1):119 -122.
[16]Liu H,Su D,Wang G,et al.An ordered mesoporous WS2anode material with superior electrochemical performance for lithium ion batteries[J].J Mater Chem,2012,22(34):17 437 - 17 440.
[17]Zhai C,Du N,Yang H Z D.Large-scale synthesis of ultrathin hexagonal tin disulfide nanosheets with highly reversible lithium storage[J].Chem Commun,2011,47(4):1 270 -1 272.
[18]Li Y,Tu J P,Wu H M,et al.Mechanochemical synthesis and electrochemical properties of nanosized SnS as an anode material for lithium ion batteries[J].Mater Sci Eng B,2006,128(1 -3):75-79.
[19]Zhu J S,Wang D L,Wang L,et al.Facile synthesis of SnS-graphene nanocomposites with high lithium storage capacity[J].Int J Electrochem Sc,2012,7(10):9 732 -9 737.
[20]Jang J T,Jeong S,Seo J W,et al.Ultrathin zirconium disulfide nanodiscs[J].J Am Chem Soc,2011,133(20):7 636 -7 639.
[21]Goodenough J B,Kim Y.Locating redox couples in the layered sulfides with application to Cu[Cr2]S4[J].J Solid State Chem,2009,182(10):2 904-2 911.
