糖尿病患者脂肪干细胞(ADSCs)的分离、培养及鉴定研究
2014-01-16刘志飞王晓军
朱 琳 刘志飞 张 星 王晓军
糖尿病是长期威胁人类健康的全球性难题,现有治疗方法均不甚理想。目前认为,糖尿病慢性并发症中血管病变是主要和始发的致病因素,而血管病变的关键靶组织为内皮细胞[1]。通过移植内皮细胞或者具有诱导分化为内皮细胞能力的干细胞便成为一种极具前景的治疗方法。最新研究发现,ADSCs 是血管组织工程优秀的种子细胞,可被诱导分化为血管内皮细胞。目前,关于糖尿病患者ADSCs 的研究较少,糖尿病患者ADSCs 是否具有和正常人ADSCs 类似的生物学特性,是实现糖尿病患者ADSCs 能否自体移植治疗的关键问题。本研究目的在于建立糖尿病患者来源ADSCs 的分离、培养流程,并比较其与健康人ADSCs 的差异,为实现糖尿病患者ADSCs 自体移植治疗提供理论依据。
资料与方法
1.材料:(1)实验试剂:高糖DMEM 培养基、胎牛血清(美国GIBCO 公司);Ⅰ型胶原酶、胰酶(美国Sigma 公司);CD29、CD44、CD105 荧光标记抗体(美国BD Bioscience 公司)。(2)脂肪组织:糖尿病患者脂肪组织来源于北京协和医院基本外科合并糖尿病的手术患者的腹壁脂肪。健康人脂肪组织来源于北京协和医院整形外科吸脂手术患者。
2.实验方法:(1)糖尿病患者ADSCs 提取培养:①取糖尿病患者腹壁脂肪组织30ml,充分剔除血管、结缔组织,充分剪碎为大小约1mm×1mm×1mm 小块。将脂肪悬液转入离心管内,共3 管,每管加入PBS 洗涤,650r/min 离心,离心后吸出下层洗涤液。3 管分为以下3 组:A 组(2 倍体积0.075%Ⅰ型胶原酶)、B 组(2 倍体积0.10%Ⅰ型胶原酶)、C 组(2 倍体积0.20%Ⅰ型胶原酶)。根据上述3 管终体积按1∶200比例加入双抗,封口膜封口后置入37℃恒温水浴箱振荡消化60min 并过滤备用;②3 个不同消化浓度的细胞悬液以220r/min 离心,小心吸去上层油脂和上清液,每管沉淀加入PBS 10ml 吹洗后1100r/min 离心,移出上层液体每管沉淀加入DMEM -HG +10%FBS 5ml 吹匀细胞,种植于T-25 培养瓶内。于48h 首次换液,之后每72h 换液1 次,达80%细胞融合时传代。(2)健康人ADSCs 提取培养:①取健康人吸脂所得脂肪组织30ml,650r/min 离心后,吸出下层吸脂麻醉药,PBS 洗涤后再次离心,吸出下层洗涤液后备用。根据脂肪组织量加入0.3%的胶原酶适量至胶原酶浓度0.075%、0.2%BSA 2ml,双抗按1∶200比例加入,封口膜封口后置入37℃恒温水浴箱震荡消化60min;②其余步骤同糖尿病患者ADSCs 提取培养步骤。(3)流式细胞术鉴定:P3 代ADSCs 以2.5g/L 胰酶消化,以2 ×105细胞量接种,分别加入CD29、CD44、CD105 抗体,进行流式细胞仪检测。
结 果
1.糖尿病患者ADSCs 的分离和培养:3 管不同浓度的细胞悬液种植于3 个T-25 培养瓶中,倒置显微镜下观察结果如下:(1)A 组:消化结束后管内组织分3 层,表层油滴,中层混合了大块未消化组织的悬液,下层为微混的消化液。接种于培养瓶后即时镜下观察可见大量圆形细胞,由于未使用红细胞裂解液,培养液中混杂的较小圆形红细胞比较多,同时还有部分未消化组织和油滴。12h 可见细胞逐渐开始贴壁变形,24 ~48h 后细胞基本变形为短梭形或者卵圆形。9 天后细胞平铺超过瓶底80%以上,常规消化传代,生长特性与正常人ADSCs 基本一致(图1)。(2)B 组:消化结果与A 管基本一致,仍存在未消化组织,但细胞数较多,原代培养经过7 天即可传代(图2)。(3)C 组:消化结束后管内组织分3 层,表层油滴,中层为大量黄色絮状组织,未消化颗粒基本消失,下层为消化液。接种后观察培养瓶内基本没有细胞,主要是未完全清洗干净的油滴,24h 后亦未见有贴壁细胞,未进行换液传代(图3)。
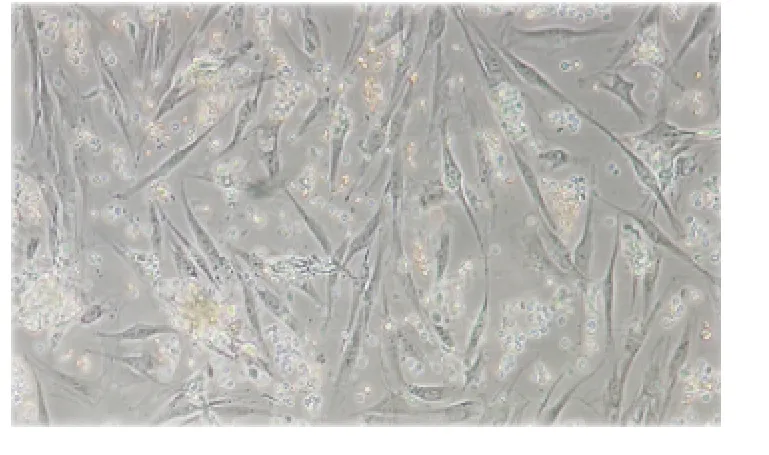
图1 A 组培养2 天后结果
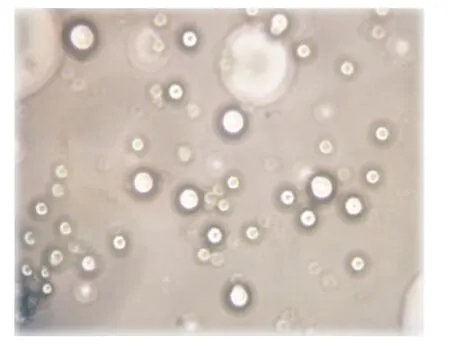
图3 C 组接种后即时观察结果
2.健康人ADSCs 的鉴定:详见表1。
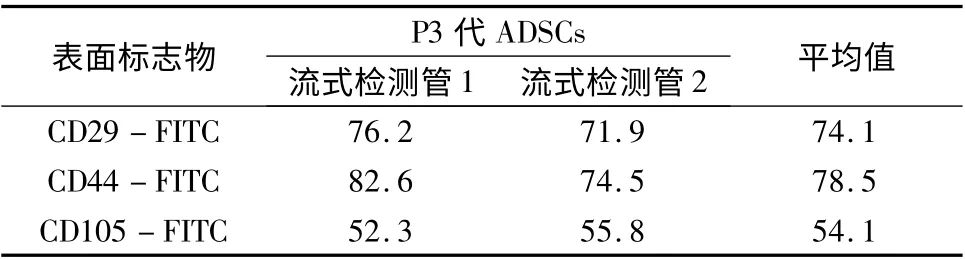
表1 流式细胞仪检测健康人ADSCs 表面标志物(%)
3.糖尿病患者ADSCs 的鉴定:流式细胞仪检测结果见表2。糖尿病患者ADSCs 鉴定可见CD29、CD44、CD105 表达阳性,表明其具有与正常人ADSCs类似的生物学性质。

表2 流式细胞仪检测糖尿病患者ADSCs 表面标志物(%)
讨 论
糖尿病并发症是一项全球性的治疗难题,研究者们一直致力于寻找一种安全、有效、经济的治疗方法。干细胞移植被认为是新的希望。一种合适的干细胞至少应该满足以下几个标准:①来源广泛,大量存在;②获取过程应无创或微创;③能够以可调控和可复制的方式向多个方向诱导分化;④能够安全有效的进行自体同源或同种异源移植;⑤能够以当前组织工程学流程大量制造[2]。ADSCs 具有大量的优势满足上述标准:脂肪组织在人体内大量存在,脂肪抽吸术创伤很小,不易造成供体部位病损;1g 脂肪组织可以分离得到5 ×103个细胞,是同质量骨髓组织所得间充质干细胞的500 倍[3];在分化性能上,ADSCs 表现尤为出色,具有向大多数中胚层组织分化的能力,包括成脂、成骨、成软骨、心肌、骨骼肌、平滑肌等,而对于非中胚层组织,可分化为内皮细胞、肝细胞、上皮细胞、神经元细胞及胰腺细胞[4]。
目前普遍认为,ADSCs 是来源于脂肪组织的间充质干细胞,因此其分离方法沿用了间充质干细胞的分离流程:即流式细胞分选法、磁珠分离法、密度梯度离心法和贴壁筛选法。本实验选择了反复贴壁筛选法,并采用了Hiroshi Mizuno 方法,即将脂肪组织洗涤以去除明显的红细胞、麻醉液、结缔组织,然后加入0.075%的胶原酶,在37℃消化0.5 ~1.0h[5]。实验中应注意随时观察离心管中组织悬液的状态,如果分为明显3 层,则说明消化已基本完成,应结束消化,如果观察到大量絮状物质,多为消化过度细胞碎裂产生,此时应适当缩短消化时间或者降低消化酶的浓度。消化结束后应使用等量的细胞培养基(DMEM +10%FBS)中止消化。在本实验中并未使用培养基中止,主要出于以下两点考虑:①大量多次培养需要的培养基较多,实验经费有限;②胶原酶主要作用部位是细胞外基质,对于细胞本身的消化作用较胰酶轻,如果消化时间把握较好,消化结束后可以迅速过滤离心,然后加入PBS 洗涤,那么不加培养基中止消化对最终细胞种植基本没有影响。
相比于正常人ADSCs,糖尿病患者ADSCs 的差异主要表现在以下两个方面:(1)供体年龄:一般除了1 型糖尿病以外,大多数2 型糖尿病患者年龄偏大,而年龄对于ADSCs 的影响目前尚未达成完全共识。一般认为,供者的年龄越小,细胞的黏附增殖活力越好[6,7]。Aust 等[8]研究后认为,ADSCs 的衰老与供体的体重指数呈负相关,而与年龄无关。Harris等[9]将来自不同年龄的ADSCs 进行CD31 的负分选,得到的细胞经诱导分化后检测CD31 的表达,最终的结果是认为ADSCs 表现出对年龄的独立性,后者并不影响ADSCs 向内皮细胞的分化。(2)获取脂肪的方式和部位:正常人的脂肪多数通过吸脂术获取,糖尿病患者脂肪则多数通过手术直接取得。吸脂术本身并不会对ADSCs 造成负面影响,但吸脂针的孔径会影响脂肪颗粒的大小,进而影响ADSCs 分离的难易程度,而手术直接获取脂肪组织虽然对ADSCs 活性不会有影响,但明显增加了分离的难度[10]。对于脂肪来源部位,Schipper 等[6]研究认为,与腹部、大腿和乳房来源的脂肪组织相比,同等体积的人前臂脂肪组织中含有更多的ADSCs。
在本实验糖尿病患者ADSCs 的分离中,考虑了以下几个方面:首先糖尿病患者通过手术直接获取的脂肪颗粒明显较粗,采用正常人一样的消化程序是否能获得相当数量的细胞?其次对于糖尿病本身潜在的对ADSCs 活性的影响,如何优化实验流程?在实际实验中,首先将获取的脂肪组织尽可能剪碎,这个步骤在这种非吸脂术获取的脂肪组织中很重要,因为足够细小的脂肪颗粒意味着更多与消化液接触的表面积,也就意味着更好的消化效果和更短的消化时间。其次设定了3 个梯度的消化酶浓度,其中0.075%是正常人ADSCs 的分离浓度,而0.10%则是考虑到上述消化难度的增加而设计,最后0.20%其实是一个试验性的浓度,观察在高浓度的消化酶作用下脂肪组织的消化表现,当然也不排除由于消化难度增加使之成为最合适的消化酶浓度的可能。最后的优化为放弃使用红细胞裂解液,考虑如下:①在正常人的ADSCs 培养中,使用红细胞裂解液仍然会残留红细胞,而这些红细胞通过数次换液传代是可以去除的,对细胞生长影响不大;②红细胞裂解液中普遍含EDTA,对红细胞裂解的同时该成分也会对其他细胞产生损伤;③红细胞裂解的时间较长,对细胞活性也会产生影响。
从结果来看,0.1%的消化酶浓度获得了最多的贴壁细胞,传代也更快,适用于正常人ADSCs 培养、传代也适用于糖尿病患者ADSCs,而更高的消化酶浓度(0.2%)会导致细胞破坏。最终总结得出以下结论:①采用和正常人ADSCs 类似的分离方法,可以分离得到来自糖尿病患者自身的ADSCs;②分离中尽可能剪碎组织很重要;③原代培养中放弃使用红细胞裂解液不会对ADSCs 的培养产生不利影响。
在本实验相同的培养条件下,并未发现糖尿病患者ADSCs 基质细胞相关标志物与正常人相比存在差异。由脂肪组织初始分离的贴壁细胞其实是一个混合的细胞系,其中包括了多种细胞的集落生成单位,如成纤维细胞、成脂细胞、造血干细胞、成骨细胞等,这找混合的细胞系基质细胞相关标志物的表达率并不高。而经过数代的贴壁培养,其他细胞逐渐凋亡,而间充质干细胞依靠强大的复制更新能力逐渐占据了主要地位,此时形态均一的贴壁细胞才成为ADSCs,而基质细胞相关标志物的表达亦逐渐上升。所以,对于ADSCs 进行基质细胞相关标志物的检测,其实是从另一方面印证了ADSCs 的复制更新能力。综合本实验得出结论,糖尿病患者自身ADSCs 基质细胞相关标志物与正常人相比没有差异。
在ADSCs 的培养中,实际上影响最终培养结果的因素较多,而本实验中限于标本来源有限(首先必须是开腹手术的糖尿病患者,其次每位患者能够取的脂肪远较吸脂术的少,约5 ~10 毫升/人),很多应该研究的糖尿病患者ADSCs 培养条件都没能进行,包括不同培养基的选择,不同的接种密度,不同的胎牛血清浓度。下一步应在充足的标本来源情况下,充分设计实验分析上述各个条件,进一步建立糖尿病患者ADSCs 最佳的分离和培养流程,并对其生物学特性展开进一步的研究。
1 Setacci C,Sirignano P,Galzerano G,et al. Endovascular first as "preliminary approach" for critical limb ischemia and diabetic foot[J].J Cardiovasc Surg,2013,54(6):679 -684
2 Buehrer BM,Cheatham B. Isolation and characterization of human adipose-derived stem cells for use in tissue engineering[J]. Methods Mol Biol,2013,1001:1 -11
3 Qureshi AT,Chen C,Shah F,et al. Human adipose -derived stromal/stem cell isolation,culture,and osteogenic differentiation[J].Methods Enzymol,2014,538:67 -88
4 Huang SJ,Fu RH,Shyu WC,et al. Adipose-derived stem cells:isolation,characterization,and differentiation potential[J]. Cell Transplant,2013,22(4):701 -709
5 Mizuno H. Adipose-derived stem cells for tissue repair and regeneration:ten years of research and a literature review[J]. J Nippon Med Sch,2009,76(2):56 -66
6 Scruggs BA,Semon JA,Zhang X,et al. Age of the donor reduces the ability of human adipose-derived stem cells to alleviate symptoms in the experimental autoimmune encephalomyelitis mouse model[J].Stem Cells Transl Me,2013,2(10):797 -807
7 Choudhery MS,Badowski M,Muise A,et al. Donor age negatively impacts adipose tissue-derived mesenchymal stem cell expansion and differentiation[J]. J Transl Med,2014,12(1):8
8 Aust L,Devlin B,Foster SJ,et al. Yield of human adipose-derived adult stem cells from liposuction aspirates[J]. Cytotherapy,2004,6(1):7 -14
9 Harris LJ,Zhang P,Abdollahi H,et al. Availability of adipose-derived stem cells in patients undergoing vascular surgical procedures[J]. J Surg Res,2010,163(2):105 -112
10 Harasymiak-Krzyzanowska I,Niedojadło A,et al. Adipose tissuederived stem cells show considerable promise for regenerative medicine applications[J]. Cell Mol Biol Lett,2013,18(4):479 -493
