阴囊热应激引起小鼠生殖系统HSP90α表达变化和抗氧化能力改变
2014-01-16韩俊岭孔晓君李建远
韩俊岭 孔晓君 李建远
热应激反应是指生物在高温环境下发生的应激反应。热应激能引起机体产生活性氧,导致氧化损伤,改变胞内的信号传递,该过程中生物体能够选择性合成一组多肽:热休克蛋白(HSPs)[1]。根据分子质量和等电点分为HSP90、HSP70、HSP60、HSP40 等家族[2]。其中HSP90 是HSPs 中高度保守的胞质蛋白,也是重要的成员,其中又以亚型HSP90α 研究最为广泛,且HSP90α 主要存在于大脑和睾丸中[3]。因此,了解阴囊热应激后机体生殖系统中HSP90α 的表达及机体抗氧化能力的改变具有重要意义。本实验通过建立阴囊热应激模型,探讨热应激后小鼠生殖系统HSP90 的表达规律及小鼠抗氧化能力的改变。
材料与方法
1.实验动物及试剂:实验所用雄性小鼠40 只,8 周龄,体重40 ~45g,SPF 级,由滨州医学院动物实验中心提供。SOD、MDA 检测试剂盒购自南京建成生物工程研究所。TUNEL 细胞凋亡检测试剂盒购自碧云天公司。实验中所用其他化学试剂均为分析纯。分光光度计为英国柏楉Biowave Ⅱ紫外可见分光光度计(Biochrom WPA Biowave Ⅱ),图像分析采用德国共聚焦激光扫描显微镜(LSM-510 META)分析仪,全自动精子分析仪采用美国汉密尔顿(IVOS-CASA)系统。
2.实验方法:(1)实验设计:将56 只小鼠随机分为正常对照组和热应激组。各组热应激后再按0、1、4、12、24、48h 随机分成7 个亚组,每组10 只小鼠。试验组小鼠在饲养7 天后进行热应激处理。热应激模型参照Cai 等[4]的研究方法:热应激组小鼠予5%水合氯醛(0.7ml/100g)麻醉后,将小鼠身体的下1/3 部分(包括阴囊、后腿、尾巴)浸于43℃恒温水中30min,擦干后回笼。对照组浸于22℃恒温水中30min。各亚组小鼠分别于热应激后0、1、4、12、24、48h 采用摘除眼球法取血,并分离血清检测血清中的SOD。待血液流尽后予颈椎脱臼处死,取左侧睾丸、附睾及肝脏称重,用于计算脏器系数,之后置于4%多聚甲醛溶液中固定24h,常规石蜡包埋、切片(5μm),用于组织学研究。右侧睾丸取一部分组织提取RNA,用作PCR 检测。右侧附睾用于制备精子悬液,计算精子活力、存活率及畸形率。(2)检测项目:①睾丸结构变化检测,通过荧光TUNEL 实验检测热应激后睾丸的细胞凋亡情况;②睾丸、附睾质量指数,睾丸、附睾质量系数公式为:质量指数=器官质量(mg)/小鼠质量(g);③精子活力、活率、畸形率检测,取出右侧附睾,置于适量37℃的PBS 中,用眼科剪剪碎,制成精子悬液。滴1 滴悬液于干净的玻片上,用全自动精子分析仪检测相关指标。评估精子的活力等级,将其分为3 级(快速前向运动;非前向运动精子;不运动精子)。累计检测400 个精子,计算精子活力。精子活力(%)=(前向运动+非前向运动)/精子总数×100%。取上述悬液滴加于玻片上,加等量的1%的伊红染液混匀,加盖玻片静置30s,用相差显微镜计数400个精子,计算精子存活率。将悬液涂片,干燥后用甲醇固定5min,用HE 染色。计数400 个精子并检查精子形态,计数结构完整精子;④睾丸、附睾中HSP90α 基因的RT-PCR 检测,提取睾丸和附睾中RNA,反转录后对HSP90α 基因和β-actin 进行PCR 扩增。取PCR 产物用1%琼脂糖凝胶进行电泳,采用凝胶成像系统拍照并进行光密度分析;⑤清SOD、MDA 检测,按照试剂盒操作说明测定对照组和应激后0、4、24、48h 组小鼠血液中SOD、MDA 含量,分析小鼠抗氧化能力的改变。
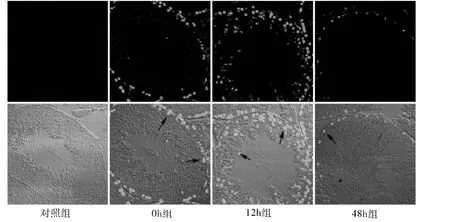
图1 热应激后睾丸细胞凋亡的情况(×400)
3.统计学方法:使用SPSS 13.0 进行统计学分析,采用单向方差分析,计量资料采用均数±标准差(±s)表示,P <0.05 表示差异有统计学意义。
结 果
1.热应激对睾丸细胞的影响:由结果可知,热应激后会造成小鼠睾丸细胞的凋亡,且主要集中在精原细胞和初级精母细胞,同时睾丸中其他细胞的凋亡也增加,并且细胞的凋亡程度在12h 时最为严重,48h时基本恢复正常(图1)。
2.阴囊热应激对小鼠脏器指数的影响:各组小鼠的睾丸、附睾的重量及质量指数结果见表1。随着应激时间的延长,其中各个时间点睾丸指数、肝脏指数与对照组相比无统计学差异(P >0.05)。0、1h 组的附睾指数与对照组相比差异有统计学意义(P <0.05)。
表1 阴囊热应激后小鼠脏器指数的变化(±s)
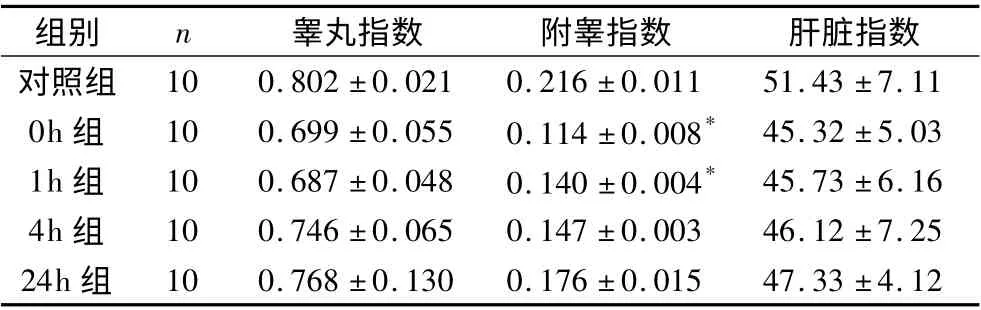
表1 阴囊热应激后小鼠脏器指数的变化(±s)
与对照组比较,* P <0.05
组别 n 睾丸指数 附睾指数 肝脏指数对照组10 0.802 ±0.021 0.216 ±0.011 51.43 ±7.11 0h 组 10 0.699 ±0.055 0.114 ±0.008* 45.32 ±5.03 1h 组 10 0.687 ±0.048 0.140 ±0.004* 45.73 ±6.16 4h 组 10 0.746 ±0.065 0.147 ±0.003 46.12 ±7.25 24h 组10 0.768 ±0.130 0.176 ±0.015 47.33 ±4.12
3.阴囊热应激对精子活力、存活率及形态的影响:阴囊热应激后,小鼠精子活力、存活率及正常精子率都有不同程度的下降,其中0h 组精子活力明显低于对照组(P <0.05),而存活率48h 内下降趋势不显著,与对照组间差异无统计学意义(P >0.05)。随着时间的延长,精子畸形率在12h 和24h 时最高,明显高于对照组(P <0.05),到48h 时基本恢复正常,结果见表2。
表2 阴囊热应激对精子活力、存活率及形态的影响(±s,%)
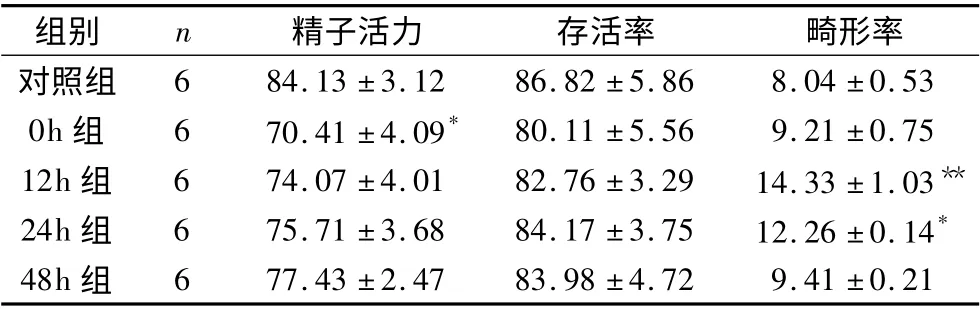
表2 阴囊热应激对精子活力、存活率及形态的影响(±s,%)
与对照组比较,* P <0.05,**P <0.01
组别 n 精子活力 存活率 畸形率对照组6 84.13 ±3.12 86.82 ±5.86 8.04 ±0.53 0h 组 6 70.41 ±4.09* 80.11 ±5.56 9.21 ±0.75 12h 组 6 74.07 ±4.01 82.76 ±3.29 14.33 ±1.03**24h 组 6 75.71 ±3.68 84.17 ±3.75 12.26 ±0.14*48h 组6 77.43 ±2.47 83.98 ±4.72 9.41 ±0.21
4.急性热应激对小鼠睾丸、附睾中HSP90α 表达的影响:在正常情况下,睾丸、附睾组织中HSP90α 的表达量较低。急性热应激处理后,睾丸中HSP90α 的表达水平开始升高,在4h 达到高峰(图2A)。0、1、4、12h 组均显著高于对照组(P <0.05),随着时间的延长HSP90α 表达量逐渐恢复,24、48h 组与对照组差异无统计学意义(P >0.05,图2B)。HSP90α 在附睾中的表达在0、1、4、12、24h 组均显著高于对照组(P<0.05),48h 组表达水平仍高于正常水平,但与对照组比较差异无统计学意义(P >0.05,图3)。
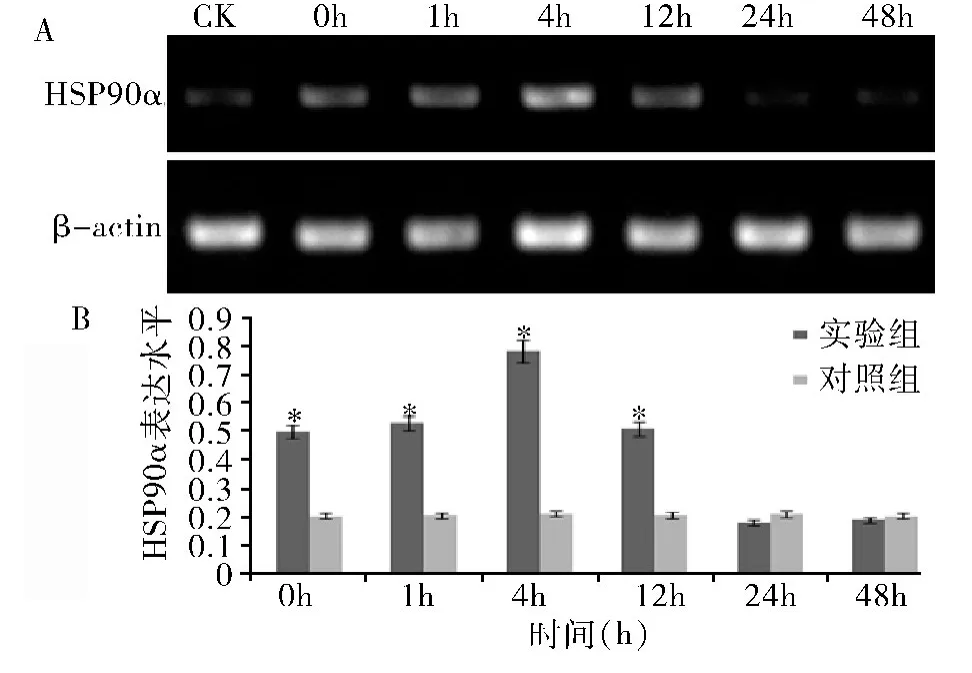
图2 热应激后HSP90α 在睾丸中的表达
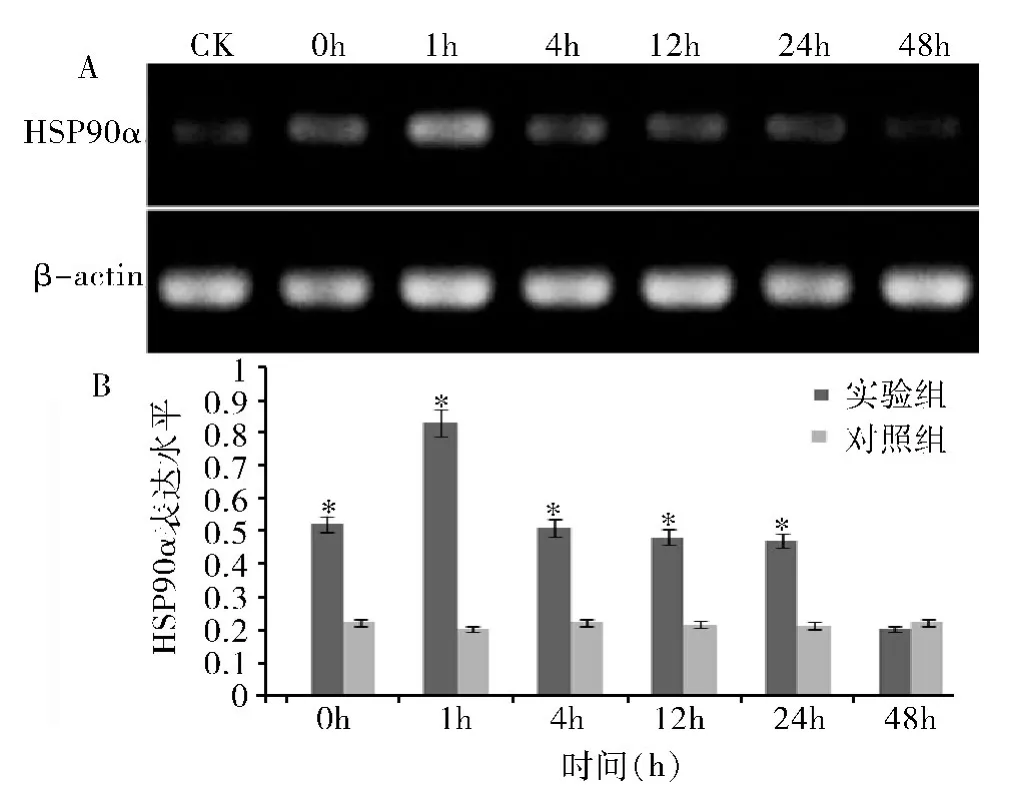
图3 热应激后HSP90α 在附睾中的表达
5.阴囊热应激对小鼠血清抗氧化能力的影响:热应激处理后,小鼠血清中SOD 水平明显升高,其中0、4h 组显著高于对照组(P <0.05),而24、48h 组基本恢复正常。血清中MDA 含量在热应激处理后4h 显著增加,明显高于对照组(P <0.05),24h 组有所下降,与对照组比较差异无统计学意义(P >0.05,表3)。
讨 论
哺乳动物的睾丸和附睾的温度比身体核心温度低,精子发生过程在睾丸内进行,只有睾丸保持较低的温度才能保证生精小管内精子的正常产生[5]。哺乳类动物睾丸位于体外的阴囊内,对温度的变化非常敏感,并且阴囊对温度有特殊的调节能力,可以使睾丸内保持适宜温度,有利于精子的发生。如果阴囊温度升高至一定程度,睾丸温度会随之升高而超出最适温度范围,致使睾丸组织正常的结构发生改变,引起生精细胞凋亡,最终导致睾丸的生精功能受到损害,精子畸形率升高、活力下降,而且性腺激素分泌量及成分发生改变,严重时可能导致雄性不育[6]。当阴囊温度升高,超过其调节能力时,也会对附睾内精子的成熟产生影响,导致精子相关指标下降。热休克蛋白普遍存在于原核和真核生物体内,高温、寒冷、低氧、创伤等均可引起热休克蛋白的高表达,其中HSP90 可通过维持信号分子蛋白的稳定性,参与细胞内多条信号转导通路的生理过程,从而协助机体对抗不良环境[7]。
表3 阴囊热应激对小鼠血清抗氧化能力的影响(±s)
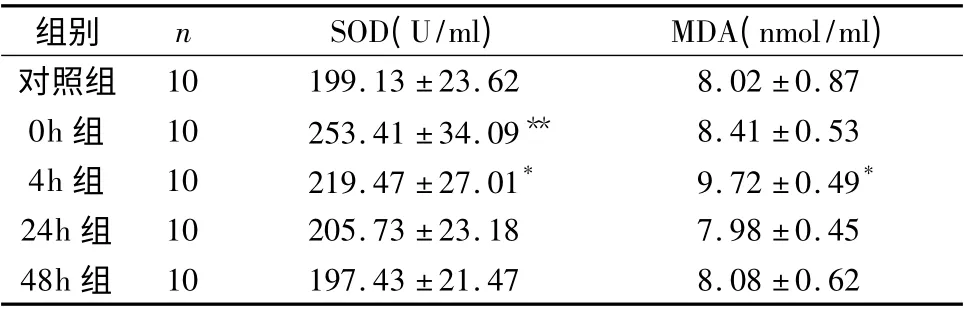
表3 阴囊热应激对小鼠血清抗氧化能力的影响(±s)
与对照组比较,* P <0.05,**P <0.01
组别 n SOD(U/ml) MDA(nmol/ml)对照组10 199.13 ±23.62 8.02 ±0.87 0h 组 10 253.41 ±34.09** 8.41 ±0.53 4h 组 10 219.47 ±27.01* 9.72 ±0.49*24h 组 10 205.73 ±23.18 7.98 ±0.45 48h 组10 197.43 ±21.47 8.08 ±0.62
本实验结果显示,在阴囊热应激后,睾丸细胞出现了明显的凋亡现象,该结果和相关的研究结果相似[8]。一般认为认为凋亡途径包括:内源性途径(也称线粒体途径)和外源性途径(也称死亡受体途径)。Absalan 等[6]研究发现,睾丸温度升高能够引起多种细胞凋亡相关因子的改变,如Bax、Bcl -2、P53、survivin-140 等,故推断阴囊热应激时通过两种凋亡途径引起睾丸细胞损伤。
热应激后不同时间点的试验组小鼠睾丸指数均有所下降,但与对照组相比,差异无统计学意义,但相对于睾丸指数的变化不显著,附睾指数则显著增加,该结果和曹文等[9]的研究结果一致。睾丸、附睾质量指数变化的趋势不同,该结果可能与他们的组织结构、生理功能不同相关,具体原因和机制需要进一步研究。此外阴囊热应激导致小鼠精子的活力明显下降、畸形率显著升高,引人注意的是12h 组精子的畸形率最高,其原因和机制有待进一步分析和研究。李德军等[10]的研究进一步表明,热应激能够降低小鼠的精子数,并损伤小鼠的精子。以上结果说明43℃的阴囊应激条件已经超出了其对温度的调节能力,并对生殖系统造成损伤。
HSP90α 是胞内蛋白,与热应急和氧化损伤密切相关,由于其作用底物与多种细胞信号转导通路密切相关,且可以作为分子伴侣发挥作用,其生理作用越发引起人们的关注,但在生殖系统中的研究较少[11]。本实验研究了热应激前、后HSP90α 在睾丸、附睾中的表达情况,PCR 结果显示热应激前HSP90α 在睾丸中有表达,但相对较弱。热应激后表达量明显增强,且有时间性。提示在阴囊热应激过程中,在不同的时间点HSP90α 发挥着对生殖系统的保护作用。本实验发现阴囊热应激时,在睾丸和附睾中HSP90α 高表达的同时血清中SOD 明显升高,MDA 也有所升高,提示机体整体的抗氧化能提高,具体机制需要做进一步研究。
综上所述,阴囊热应激对雄性小鼠的生殖系统造成了损伤。PCR 结果表明HSP90α 可能参与睾丸中精子的发生与附睾内精子的成熟,然而目前为止,对于HSP90α 在雄性生殖系统中的作用的认识非常有限。这些方面需要人们做进一步的研究,以便更深入地了解雄性生殖和雄性不育。
1 Zhang HJ,Xu L,Drake VJ,et al. Heat - induced liver injury in old rats is associated with exaggerated oxidative stress and altered transcription factor. activation[J]. FASEB Journal,2003,17:2293 -2295
2 Vos MJ,Hageman J,Carra S,et al. Structural and functional diversities between members of the human HSPB,HSPH,HSPA,and DNAJ chaperone families[J]. Biochemistry,2008,47(27):7001 -7011
3 戎成婷,韩俊岭,杜振宁. HSP9090ββ 在小在小鼠生殖系统中的表达及调控[J]. 南方医科大学学报,2013,33(4):491 -495
4 Cai H,Ren Y,Li XX,et al. Scrotal heat stress causes a transientalteration in tight junctions and induction of TGF - beta expression[J]. Int J Androl,2011,34(4):352 -362
5 Ivell R. Lifestyle impact and the biology of the human scrotum[J].Reprod Biol Endocrinol,2007,5:15 -22
6 Absalan F,Movahedin M,Mowla SJ. Germ cell apoptosis induced by experimental cryptorchidism is mediated by molecular pathways in mouse testis[J]. Andrologia,2010,42(1):5 -12
7 Chen JX,Meyrick B. Hypoxia increases Hsp90 binding to eNOS via PI3K-Akt in porcine coronary artery endothelium[J]. Laboratory Investigation,2004,84(2):182 -190
8 Paul C,Teng S,Spears PT. A single,mild,transient scrotal heat stress causes hypoxia and oxidative stress in mouse testes,which induces germ cell death[J].Biol Reprod,2009,80(5):913 -919
9 曹文,黄攀,张磊,等. 急性热应激对性成熟雄性小鼠睾丸、附睾、输精管中热休克蛋白70 表达的影响[J]. 中华男科学杂志,2009,15(3):200 -206
10 李德军,田文儒,刘运枫,等.热应激对鼠精液质量的研究[J]. 黑龙江畜牧兽医,2010,52:101 -102
11 Jascur T,Brickner H,Salles -Passador I,et al. Regulation of p21(WAF1/CIP1)stability by WISp39,a Hsp90 binding TPR protein[J]. Mol Cell,2005,17(2):237 -249
