芍药苷对LPS 诱导H9C2 细胞氧化应激损伤的作用
2014-01-16唐其柱
李 金 唐其柱 刘 源 焦 蓉
芍药苷是一种单萜类糖苷化合物,其药理作用广泛,不仅具有降低血液黏度、抗血小板聚集、扩张血管、改善微循环及抗惊厥等多种生物学效应,还有抗炎、抗氧自由基作用[1]。由此推测,芍药苷可能对心肌细胞的氧化应激损伤具有改善作用。有研究表明,LPS 侵入机体后不仅参与炎症反应,还可诱导氧化应激反应的发生[2,3]。因此本实验就尝试LPS 刺激H9C2 细胞产生氧化应激损伤反应,来探讨芍药苷对H9C2 细胞氧化应激损伤是否具有保护作用并初步探讨其作用机制。
材料与方法
1.药品及试剂:芍药苷(上海融禾医药科技发展有限公司,100mg,纯度>97%)、胰蛋白酶消化液(Gibco 公司)、新生牛血清(Gibco 公司)、DMEM 培养基(Corning Cellgro 公司)、双抗(Hyclone 公司)、细胞计数仪(Invitrogen 公司)、流式细胞仪(美国BD FACScalibur 公司)、荧光酶标仪(Synergy HT 公司)、DCFH-DA(碧云天生物技术研究所)。
2.H9C2 细胞的培养:H9C2 细胞购自于中国科学院,用含10%胎牛血清,1%的青霉素(10000U/L)/链霉素(10000μg/ml)的DEME 培养基于37℃、5% CO2饱和湿度培养箱内培养。传3 ~5 代,待状态稳定后用0.25%胰蛋白酶消化制成单细胞悬液,传到96 孔培养板上,每次传代时细胞密度控制在1 ×105/ml,每孔100μl,进行分组实验。
3.细胞培养分组及CCK8 检测:(1)观察不同浓度的芍药苷药物刺激对胞内ROS 含量的影响:随机分为正常对照组和LPS 刺激组。①正常对照组:细胞饥饿18h 后仅给予无血清的培养基处理(下同);②LPS 刺激组:细胞加药前饥饿18h(下同),加入10mg/ml 的LPS,处理2h;③芍药苷组:细胞饥饿后加入50μg/ml、100μg/ml、200μg/ml 不同浓度的芍药苷预培养60min,弃去培养基后同时加入与对照组相同浓度的LPS及相对应浓度的芍药苷。(2)观察芍药苷药物刺激不同时间对胞内ROS 含量的影响:随机分为正常对照组和芍药苷组。芍药苷组:选取上述的一个芍药苷浓度为100μg/ml,加入LPS及芍药苷刺激H9C2 细胞不同的时间,加入LPS 前要芍药苷预培养60min。(3)用流式细胞仪测ROS 阳性细胞数:随机分为正常对照组、LPS 刺激和芍药苷组。1)LPS 刺激组:加入10mg/ml LPS,培养2h;2)芍药苷组:加入相同浓度LPS 及100μg/ml 的芍药苷药物,培养相同的时间,加入LPS 前也是芍药苷预培养60min。
4.CCK8 检测:向96 孔板中加入100μl 的单细胞悬液,在培养箱预培养24h(37℃、5% CO2)后向培养板加入50、100、200μmol/L 不同浓度的芍药苷药物,在培养箱继续孵育12h,然后向每孔加入10μl CCK8 溶液,再孵育2h,最后用酶标仪测定在450nm 处的吸光度。
5.指标观测:(1)荧光酶标仪测细胞内ROS 水平:1)按照“细胞培养分组及CCK8 检测”项中(1)的分组及用实验因素处理2h 后加入DCFH-DA 探针在37℃培养箱孵育30min,用温PBS 洗3 次后用荧光酶标仪(激发光波长为485nm,发射光波长为525nm,下同)检测细胞内DCF 荧光强度,分别以每次实验的对照组荧光强度作为100%,计算ROS 含量[4]。2)按照“细胞培养分组及CCK8 检测”项中(2)的分组后,在96 孔黑板里直接加入DCFH-DA 探针,在37℃培养箱孵育30min,用温PBS 洗3 次,再用上述实验因素处理不同时间后用荧光酶标仪检测细胞内DCF 荧光强度,分别以每次实验的对照组荧光强度作为100%,计算ROS 含量。(2)流式细胞仪检测ROS 阳性细胞数:细胞接种于六孔板,药物处理前,先加DCFH-DA 探针在培养箱孵育30min,将细胞悬于PBS 中,用细胞计数仪使细胞数调整到1 ×106个,离心收集细胞,温PBS洗3 遍。1ml PBS 重悬,上机检测,使用488nm 激发波长,525nm 发射波长,实时或逐时间点检测刺激前后荧光的强度(DCF 的荧光光谱和FITC 非常相似,可以用FITC 的参数设置检测DCF),各组细胞碎片均通过设门除去,结果用荧光细胞即ROS 阳性细胞百分率表示,重复3 次。
6.统计学方法:应用SPSS 17. 0 统计软件进行统计分析,计量资料以均数±标准差(±s)表示,本组间计量资料使用One-way ANOVA 法分析,以P <0.05 为差异有统计学意义。
结 果
1.芍药苷对H9C2 细胞活力的影响:正常对照组细胞存活率为100%,则芍药苷在50、100、200μg/ml 浓度的细胞毒性活力分别为95. 1%、112.9%、110.2%,因此本实验设计的芍药苷浓度具有低细胞毒性,为了排除芍药苷对H9C2 细胞的毒性损伤而带来的影响细胞存活率,及干扰实验结果,本实验采用50、100、200μmol/L 作为本实验的药物浓度,详见表1。
表1 不同浓度的芍药苷刺激H9C2 细胞的细胞毒性活力(±s,n=6)

表1 不同浓度的芍药苷刺激H9C2 细胞的细胞毒性活力(±s,n=6)
与对照组相比,* P <0.05
组别 剂量(μmol/ml) OD 值(450nm) 细胞存活率(%)1.14 ±0.09 100.0芍药苷组Ⅰ 50 1.29 ±0.06* 112.9芍药苷组Ⅱ 100 1.26 ±0.06* 110.2芍药苷组Ⅲ对照组0 200 1.09 ±0.06 95.1
2.芍药苷随着药物浓度对细胞内ROS 水平的影响:LPS 刺激H9C2 细胞120min 后,胞内ROS 量明显上升,与对照组相比差异有统计学意义(P <0.05);加入50μg/ml 的芍药苷后胞内ROS 的量下降,随着药物浓度的增加,胞内ROS 下降趋势更明显,且与LPS 组相比差异有统计学意义(P <0.05),详见表2。
表2 不同浓度芍药苷药物刺激H9C2 细胞产生的ROS 水平(±s,n=6)

表2 不同浓度芍药苷药物刺激H9C2 细胞产生的ROS 水平(±s,n=6)
与LPS 组相比,* P <0.05;△浓度单位为毫克/毫升(mg/ml)
组别 剂量(μmol/ml)ROS 的含量与对照组比较(%)对照组 - 100.00 ±5.32*LPS 组 10△ 222.23 ±9.24 LPS+芍药苷组Ⅰ 50 191.20 ±8.74*LPS+芍药苷组Ⅱ 100 173.19 ±2.97*LPS+芍药苷组Ⅲ 200 145.40 ±9.89*
3. 芍药苷随着时间对胞内ROS 水平的影响:加入LPS 30min 后胞内ROS 含量开始上升,刺激120min 后胞内ROS 含量上升更明显,与对照组相比差异有统计学意义(P <0.05);加入芍药苷药物刺激后,胞内ROS 都有不同程度的降低,当刺激足够的时间胞内ROS 下降明显低于LPS 组,且差异有统计学意义(P <0.05),详见表3。
表3 LPS 与芍药苷药物刺激H9C2 细胞不同时间胞内ROS 水平(±s,n=6)
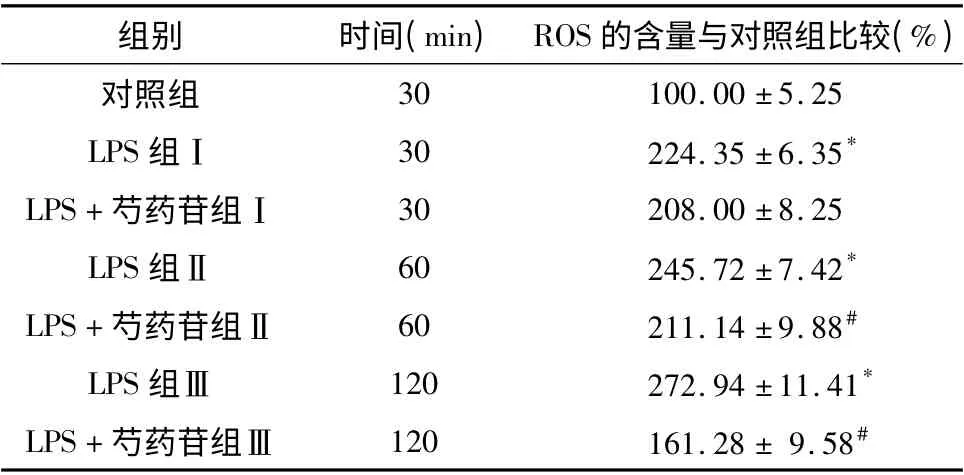
表3 LPS 与芍药苷药物刺激H9C2 细胞不同时间胞内ROS 水平(±s,n=6)
LPS 组与对照组相比,* P <0.05;LPS + 芍药苷组与LPS 组相比,#P <0.05
组别 时间(min) ROS 的含量与对照组比较(%)30 100.00 ±5.25 LPS 组Ⅰ 30 224.35 ±6.35*LPS+芍药苷组Ⅰ 30 208.00 ±8.25 LPS 组Ⅱ 60 245.72 ±7.42*LPS+芍药苷组Ⅱ 60 211.14 ±9.88#LPS 组Ⅲ 120 272.94 ±11.41*LPS+芍药苷组Ⅲ 120 161.28 ± 9.58对照组#
4. 流式细胞仪测定胞内ROS 水平:LPS 刺激H9C2 细胞2h 后,与对照组相比ROS 阳性细胞百分率明显增加,且差异有统计学意义(P <0.05);加入LPS 与芍药苷药物刺激相同的时间后,ROS 阳性细胞百分率与LPS 组相比明显下降,且(P <0.05)。
表4 不同处理因素刺激H9C2 细胞2h 对ROS 产生的影响(±s,n=3)

表4 不同处理因素刺激H9C2 细胞2h 对ROS 产生的影响(±s,n=3)
与对照组相比,* P <0.05;LPS +芍药苷组与LPS 组相比,#P <0.05
组别 ROS 阳性细胞百分率(%)1.98 ±2.14 LPS 组 3.30 ±1.81*LPS+芍药苷组 2.36 ±3.06*#对照组
讨 论
本研究发现,LPS 刺激H9C2 细胞30min 胞内ROS 水平开始上升,诱导细胞进入氧化应激状态,随着刺激时间的增加,胞内ROS 上升趋势更明显,且细胞培养时在光镜下也可观察到大量的细胞碎片、皱缩细胞,这都表明10mg/ml 的LPS 可以诱导H9C2 细胞出现氧化应激损伤反应。
本研究还发现,用LPS 与不同浓度的芍药苷药物刺激H9C2 细胞后,胞内ROS 含量明显低于LPS组(P <0.05),且下降趋势呈现浓度依赖性。LPS 与芍药苷药物共同刺激H9C2 细胞不同时间,胞内ROS含量明显低于相应的LPS 组(P <0.05),且下降趋势呈现时间依赖性。芍药苷能够降低胞内超负荷ROS的含量,这提示芍药苷药物能够改善H9C2 细胞氧化应激损伤。分析结果,我们推测芍药苷药物可能通过以下作用机制来改善氧化应激损伤:①抑制胞内氧自由基的产生及增加清除氧自由基的活性酶,当芍药苷药物达到适当的浓度及时间干预,可抑制胞内氧自由基的产生及增加清除氧自由基的活性酶,最终使胞内超负荷的ROS 明显下降[5];②稳定细胞膜通透性,平衡离子通道使细胞高分子物质如核酸、蛋白质等免受氧自由基的破坏,减轻细胞的损伤与死亡[6];③抑制炎症的发生,通过抑制LPS 的刺激而阻断因炎症诱发更多的氧化应激损伤反应[7]。
现代医学研究证实芍药苷具有抑制肿瘤细胞增殖、调节免疫功能及保护神经细胞的作用[8]。本实验证实芍药苷对H9C2 细胞氧化应激损伤具有改善作用。近年来氧化应激与心肌肥厚的关系受到了国内外越来越多学者的关注,大量文献也证实了氧化应激与心肌肥厚的形成密切相关[9]。本实验为我们应用芍药苷改善心肌细胞氧化应激损伤进而有效抑制心肌肥厚提供了理论依据,但本实验只是检测了活性氧指标,而未检测心肌肥厚相关的指标,且未涉及动物在体实验的部分,因此存在一定的局限性。
综上所述,本研究通过LPS 诱导H9C2 细胞氧化应激损伤观察到芍药苷对H9C2 细胞低毒性,可降低胞内ROS 的水平,具有改善H9C2 细胞氧化应激损伤的作用。希望以后可以进一步深入研究其作用机制及作用途径,为芍药苷防治心肌肥厚展示更广阔的前景。
1 金英善,陈曼丽,陶俊. 芍药化学成分和药理作用研究进展[J]. 中国药理学与毒理学杂志,2013,27(4):745 -749
2 Qiao Y,Bai XF,Du YG. Chitosan oligosaccharides protect mice from LPS challenge by in RAW attenuation of inflammation and oxidative stress[J].International Immunopharmacology,2011,11(1):121 -127
3 Park CM,Park JY,Noh KH,et al.Taraxacum officinale Weber extracts inhibit LPS - induced oxidative stress and nitric oxide production via the NF-κB modulation in RAW 264.7 cells[J].Journal of Ethnopharmacology,2011,133(2):834 -842
4 曾晓锋,段晓飞,张晶,等. MA 与HIV -Tat 协同作用致大鼠相关脑区ROS、GSH-PX 和SOD 的变化[J]. 中国法医学杂志,2012,26(6):431 -437
5 相湘,胡旭光,张思为. 芍药苷对脑缺氧和缺血再灌注损伤的改善作用研究[J].中国现代药物应用,2008,2(17):58 -60
6 郑世存,李晓宇,欧阳兵,等. 芍药苷药理作用研究新进展[J]. 中国药物警戒,2012,9(2):100 -103
7 朱江爱,方步武,吴咸中,等. 芍药甘草汤的抗炎作用研究[J]. 天津医药,2009,37(2):120 -123
8 王国峰,陈冬梅. 芍药苷诱导药理预适应抗脑缺血的神经保护作用[J]. 中国临床药理学与治疗学,2007,12(5):504 -511
9 顾玉梅,吴扬. 氧化应激在心肌肥厚中的作用及其机制[J]. 南通大学学报:医学版,2005,25(3):233 -235