阳离子脂质体介导的A20 基因转染人外周血单核细胞的可行性
2014-01-16徐丹曲鹏高静崔影
徐 丹 曲 鹏 高 静 崔 影
阳离子脂质体转染技术是当前研究特定基因表达调控及基因治疗的重要技术之一,其优越性主要表现在简单、安全、毒性低、不限制所携带DNA 的大小、易大量制备等多个方面,已经被广泛应用于各种原代细胞及细胞系的转染[1]。人外周血单核细胞是参与免疫炎症反应重要的功能细胞,是在医学基础研究及临床检验中常用的一类细胞,目前国内外关于人外周血单核细胞的转染方法及转染效率的报道相对较少。本研究组采用绿色荧光蛋白(greenfluorescent protein,GFP)作为报告基因,通过脂质体Lipofectamine TM 2000 包裹A20 基因,体外转染人外周血单核细胞,探讨脂质体介导A20 基因转染人外周血单核细胞的可行性及最佳转染条件,作为我们研究组的预实验,为外源性A20 基因后续体外及动物干预试验研究奠定基础。
材料与方法
1.材料:高效真核表达载体pCAGGS -GFP/A20 由比利时根特大学分子生物学系Dr K. Heyninck 和Prof. R. Beyaert提供;Lipofectamine TM 2000 转染试剂购自Invitrogen 公司;pCAGGS 质粒、pCAGGS-GFP 质粒、RT -PCR 试剂盒以及引物的设计、合成由宝生物工程(大连)有限公司构建;胎牛血清购自中美合资兰州民海生物工程有限公司;DMEM 培养基购自GIBCO 公司;Ficoll 细胞分离液购自上海普非生物有限公司。
2.技术路线:(1)Ficoll 淋巴细胞分离液分离正常人外周血单个核细胞。(2)pCAGGS -GFP/A20 重组质粒的鉴定:将获得的pCAGGS-GFP/A20 质粒菌保涂Amp 抗性的平板后,过夜培养。挑单菌落于3ml Amp 抗性的LB 培养基中37℃摇床中过夜培养,集菌后,使用TaKaRa MiniBEST Plasmid Purification Kit 进行小量质粒提取,并使用EcoR Ⅴ/Sma Ⅰ进行双酶切鉴定,酶切产物1%琼脂糖凝胶电泳。(3)无内毒素质粒的大量提取:将鉴定好的pCAGGS -GFP/A20 质粒菌保接种于100ml Amp 抗性的LB 培养基中过夜培养后,使用QIAGEN公司的Endo -Free Plasmid Maxi kit 进行无内毒素质粒的提取,溶于试剂盒中的TE 缓冲液,并使用EcoR Ⅴ/Sma Ⅰ进行双酶切鉴定,酶切产物1%琼脂糖凝胶电泳。将质粒DNA 提取物按适当比例稀释,置核酸浓度测定仪内,测定DNA 浓度,并用真空浓缩机将质粒浓度调整至1μg/μl。(4)pCAGGS -GFP/A20 质粒转染条件的筛选:根据表1 及表2 对Lipofectamine TM 2000 转染试剂和pCAGGS-GFP/A20 质粒稀释,分别取20μl 于稀释的转染试剂与25μl 稀释质粒的混合,在室温保温15min,然后将混合后的复合物加到24 孔板的细胞中,轻轻混匀。在孵箱中孵育5h,5h 后,弃去含有复合物的培养基,加入含10%胎牛血清的DMEM 培养基。转染48h 后在倒置荧光显微镜下观察GFP 的表达情况,计算表达GFP 单核细胞数与所有细胞数的比值,多张片子多个角度取平均值,选取单核细胞GFP 表达强度最强,表达数量最多的一组确定最佳转染条件,详见图1。(5)目的基因的检测:将实验设A1 组(空白对照组);A2 组(转染试剂组,培养液中加入Lipofectamine TM 2000 4μl,作用48h);A3 组(pCAGGS 组,转染空质粒3μg 作用48h);A4 组(pCAGGS-GFP 组,转染不含目的基因的质粒3μg 作用48h);A5 组(pCAGGS-GFP/A20 组,转染含有目的基因A20 的质粒3μg 作用48h),加入脂质体转染试剂及质粒含量按筛选出的最佳转染条件进行,通过荧光显微镜检测各组GFP 报告基因,RT-PCR 检测目的基因A20 的表达。(6)反转录聚合酶链式反应(RT -PCR):PCR 引物及扩增片段:外源性A20 引物:上游引物:5' - TTT GAG CAA TAT GCG GAA AGC -3';下游引物:5' -AGT TGT CCC ATT CGT CAT TCC-3',扩增片段长度319bp;β-actin 引物,上游引物:5' -AAC GAG CGG TTC CGA TGC CCT GAG -3',下游引物:5' -TGT CGC CTT CAC CGT TCC AGT T-3',扩增片段长度为249bp;外源性A20 反应条件:94℃5min,94℃50s,60℃58s,72℃60s,共进行30 个循环,最后72℃8min。

图1 pCAGGS-GFP/A20 质粒与转染试剂筛选比例

表1 Lipofectamine TM 2000 转染试剂的稀释方法(μl)

表2 质粒的稀释方法
结 果
1.pCAGGS-GFP/A20 质粒转染条件的优化:在倒置荧光显微镜下,以488nm 激发光波长激发荧光,察绿色荧光蛋白(green fluorescence protein,GFP)的表达,同一视野同时在荧光显微镜下及普通光镜下观察及摄片,计算表达GFP 细胞数与所有细胞数的比值,多张片子的多个视野取平均值,可见5C 孔表达最强,详见图2,即对于24 孔板的亚融合细胞来说,最佳脂质体与质粒的量之比为4μl∶3μg,确定了优化条件后就可以根据培养板表面积线性放大,进行本研究的干预实验。
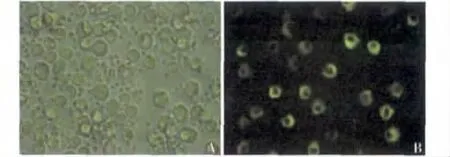
图2 pCAGGS-GFP/A20 质粒转染条件筛选结果
2.单核细胞转染后GFP 表达:荧光显微镜可见(图3):A1 组(空白对照组),A2 组(转染试剂组)及A3 组(pCAGGS 组)单核细胞胞质内均未见GFP 表达,而A4 组(pCAGGS -GFP 组),A5 组(pCAGGS -GFP/A20 组),两组单核细胞胞质内可见GFP 表达,提示真核表达载体pCAGGS 在单核细胞内转染成功。

图3 GFP 表达的特异性检测结果(×400)
3. RT -PCR 检测目的基因A20mRNA 表达:外源性A20mRNA 与β -actin RT -PCR 扩增产物琼脂糖凝胶电泳可见(图4),A1 组(空白对照组)、A2 组(转染试剂组)、A3 组(pCAGGS 组)、A4 组(pCAGGS-GFP 组)各组均未检测到外源性A20mRNA 的表达,而A5(pCAGGS -GFP/A20 组)组可检测到目的基因A20mRNA 的表达,提示Lipofectamine TM 2000介导的pCAGGS -GFP/A20 质粒转染可获得目的基因A20 的表达。
讨 论

图4 外源性A20mRNA 与β-actinRT-PCR扩增产物琼脂糖凝胶电泳图
新鲜分离的健康人外周血单核细胞是处于G0期、非分裂的原代细胞,这种细胞特性至少维持到体外分离后3 天以上,因此很难将外源基因导入单核细胞内,并获得高效表达[2,3]。作为真核细胞转染方法,脂质体转染技术的优越性主要表现在毒性低、对于所携带DNA 的大小无特殊要求、易大量制备等方面[4]。
更为重要的是,脂质载体的免疫原性通常较低,允许在体内转染实验时使用与体外实验相同的载体。阳离子脂质体通过静电作用与携带外源性目的基因的治疗结合形成脂质体复合物,然后被表面带负电荷的细胞膜吸附,再通过融合或细胞内吞作用进入溶酶体,内吞后脂复合体在细胞内形成的包涵体,在二油酰磷脂酰乙醇胺(DOPE)作用下,细胞膜上的阴离子脂质因膜的不稳定而失去原有的平衡扩散进入复合体,与阳离子脂质中的阳离子形成中性离子对,使原来与脂质体结合的DNA 游离出来,进入细胞质,进而通过核孔进入细胞核,最终进行转录并表达[5~7]。其转染效率与脂质体与DNA 的比例、细胞状态、转染时间以及靶细胞的选择性作用有关。一般认为,环状DNA 的转染效率高于线状DNA,越小的基因其转染效率越高[8~10]。
我们研究中应用的目的基因A20 为比利时根特大学分子生物学教研室构建的环状DNA,根据本研究组后续的动物实验需要,我们应用了阳离子脂质体转染方法对人外周血单核细胞进行外源性基因A20的转染实验,在本试验条件下,Lipofectamine TM 2000 转染试剂与pCAGGS - GFP/A20 质粒比例为4μl∶3μg 转染效果最佳,研究中我们发现,转染试剂本身的毒性会对体外培养的人外周血单核细胞的生长状态产生一定的影响,在转染过程中需要更换新的培养基以降低转染试剂对单核细胞的毒性,换液时间过早,脂质体/DNA 复合物因不能有效被内吞至胞体内而导致转染率相对较低,而换液时间过晚则会因为转染试剂的不良反应影响细胞状态,甚至会导致单核细胞活性降低,甚至是大量死亡,转染效率也会降低在本试验条件下,当转染后5h 更换培养液可获得相对较高的转染效率。本实验作为研究组的预实验,通过阳离子脂质体转染方法使得外源性A20基因在单核细胞获得了瞬时表达,未进行抗菌素的筛选。
本研究应用阳离子脂质体Lipofectamine TM 2000 介导外源性A20 基因转染人外周血单核细胞,通过GFP 报告基因以及RT-PCR 检测证实pCAGGS-GFP/A20 组转染后经培养至48h,获得了A20 基因的表达,从而证实了表达载体pCAGGS-GFP/A20 的有效性,为外源性A20 基因干预单核细胞炎症反应的研究以及动物干预实验打下良好基础。
1 Zhang S,Zhao B,Jiang H,et al. Cationic lipids and polymers mediated vectors for delivery of siRNA[J]. J Control Release,2007,123(1):1 -10
2 Muhlebach MD,Wolfrum N,Schule S,et al. Stable transduction of primary human monocytes bysimian lentiviral vector PBj[J]. Mol Ther,2005,12(6):1206 -1216
3 Wolfrum N,Mhlebach MD,Schle S,et al.Impact of viral accessory proteins of SIVsmmPBj on early steps of infection of quiescent cells[J]. Virology,2007,364(2):330 -341
4 钱亚芳,谷满仓. 阳离子脂质体在基因转染载体中的研究进展[J].中国药师,2008,11(9):1041 -1043
5 Tresset G. The multiple faces of self-assembled lipidic systems[J].PMC Biophysics. 2009,2(1):3
6 Wasungu L,Hoekstra D. Cationiclipids,lipoplexes and intracellular delivery of genes[J].Control Realease,2006,116(2):255 -264
7 黄柯鑫,赵斌. 阳离子脂质体的转染效率影响因素的研究进展[J].医学理论与实践,2012,25(5):1704 -1710
8 杨硕晔,陈西敬. 阳离子脂质体用做基因传递载体的研究进展[J].中国新药杂志,2010,9(20):1866 -1870
9 Madeira C,loura LM,Prieto M,et al.Liposome complexation efficiency monitored by FRET:effect of charge ratio,helper lipid and plasmid size[J].Eur Biophys J,2007,36(6):609 -620
10 Yang Y,Zhang Z,Chen L,et al.Effect of multifold charge groups and imidazole -44carboxaldehyde on physicochemical characteristics and transfection of cationic polyphosphazenes/DNA complexes[J]. Int J Pharm,2010,390(2):191 -197