AOAC方法检测大豆异黄酮的浅析
2014-01-14刘郭飞杨立峰萨仁高娃易德莲
刘郭飞,伍 林,童 玲,杨立峰,李 丹,童 坤,萨仁高娃,易德莲
(1.武汉科技大学应用化学研究所,湖北 武汉430081;2.武昌理工学院生命科学学院,湖北 武汉430223;3.日本北见工业大学生物材料大学院,日本 北见0900061)
大豆及大豆制品是我国以及其它亚洲国家的传统食品,大豆中含有丰富的油脂和植物蛋白,其中大豆异黄酮具有很高的营养价值而且能预防和治疗多种疾病。到目前为止,从大豆中提取分离出的大豆异黄酮的异构体共有12种,主要的有6种,分为结合型糖苷和游离型苷元,糖苷主要以黄豆苷(daidzin)、黄豆黄苷(glycitin)、染料木苷(genistin)的形式存在,而苷元主要以黄豆苷元(daidzein)、黄豆黄素(glycitein)和染料木黄酮(genistein)的形式存在[1-2]。大豆异黄酮(soybean isoflavones)是一种具有生物活性的植物雌激素,可以降低骨质疏松[3]、乳腺癌、更年期综合症[4-6]的发生几率。另外,还具有抑菌[7]、提高免疫力[8]、降低胆固醇[9]和改善动脉硬化的作用[10]。近几年还有研究证实大豆异黄酮具有抗高尿酸症[11]和降血糖[12]的作用。但是过量的大豆异黄酮也会带来负面影响,最近有研究指出大豆异黄酮作为植物激素过量使用时对小鼠的生殖系统产生了负面影响[13]。因此,大豆异黄酮的含量检测十分重要。2001年,AOAC(美国分析化学家协会)公布了大豆及大豆制品中异黄酮的测定方法。作者在此浅析了AOAC方法的实验条件和方法,希望能对国内大豆异黄酮的检测起一定的指导作用。
1 实验
1.1 材料与试剂
大豆样品(黑龙江产),市售,磨碎后于干燥环境中保存待用。
甲醇(分析纯)、冰醋酸(色谱纯)、氢氧化钠(分析纯)、甲醇(色谱纯),关东化学株式会社;黄豆苷、黄豆苷元、染料木苷、染料木黄酮、黄豆黄苷、黄豆黄素标准品(纯度≥99%),长良科技株式会社。
1.2 主要仪器
LC-10AT型高效液相色谱系统(SCL-10A型系统控制系统,SIL-10A型自动进样系统,SPD-10A型紫外检测系统,CTO-10A型柱温箱系统),日本SHIMADZU;EDU-1200型冷冻干燥机、NVC-2100型旋转蒸发仪、NTS-2000型恒温振荡器,日本EYELA;HIMAC CF 15R型高速冷冻离心机,日本HITACHI;MDF-392型超低温冰箱,日本SANYO;ML-50型加热干燥式水分测试计,日本AND株式会社。
1.3 方法
1.3.1 样品制备
按AOAC方法进行[14]。准确称取5.00g大豆样品粉末,加入80%甲醇溶液40mL,于65℃水浴中振荡2.0h,冷却至室温后加入3mL 2mol·L-1氢氧化钠溶液,于室温水浴中振荡10min;然后加入1mL冰醋酸,用甲醇定容至50mL,取定容后5mL上清液,加入4mL水,再次用甲醇定容至10mL,取上清液于1 500 r·min-1离心10min,取适量上清液用0.2nm过滤膜过滤后转入液相色谱瓶中待检测。每个样品设置3个平行样。
1.3.2 HPLC条件
色谱柱为Inertsil ODS-4色谱柱(4.6mm×250 mm,5μm);柱温40℃;流动相A为V水∶V甲醇∶V醋酸=44∶5∶1,流动相B为V甲醇∶V醋酸=49∶1,流速1 mL·min-1;梯度洗脱条件:0~30min,10%~60%B;30~33min,60%~100%B;33~35min,100%B;35~37min,100%~10%B;进样量10μL;检测波长260nm。
1.3.3 标准曲线绘制
按AOAC方法进行。称取6种标准品约1mg于10mL容量瓶中,用80%甲醇溶液溶解,定容,配成约0.1mg·mL-1的母液,摇匀储藏待用。黄豆苷、染料木苷分别用母液配成浓度约为10mg·mL-1、20mg·mL-1、40mg·mL-1、60mg·mL-1、80mg·mL-1、100mg·mL-1的浓度梯度待测,黄豆黄苷、黄豆苷元、染料木黄酮分别用母液配成浓度约为1mg·mL-1、4mg·mL-1、8mg·mL-1、12mg·mL-1、16 mg·mL-1、20mg·mL-1的浓度梯度待测,黄豆黄素用母液配成浓度约为0.6mg·mL-1、0.8mg·mL-1、1.0mg·mL-1、1.2mg·mL-1、1.4mg·mL-1、1.6mg·mL-1的浓度梯度待测。用HPLC色谱仪检测,绘制标准曲线。
2 结果与讨论
2.1 提取温度对大豆异黄酮含量检测的影响
提取时间为2.0h、甲醇体积分数为80%,考察提取温度对大豆异黄酮含量检测的影响,结果如表1所示。
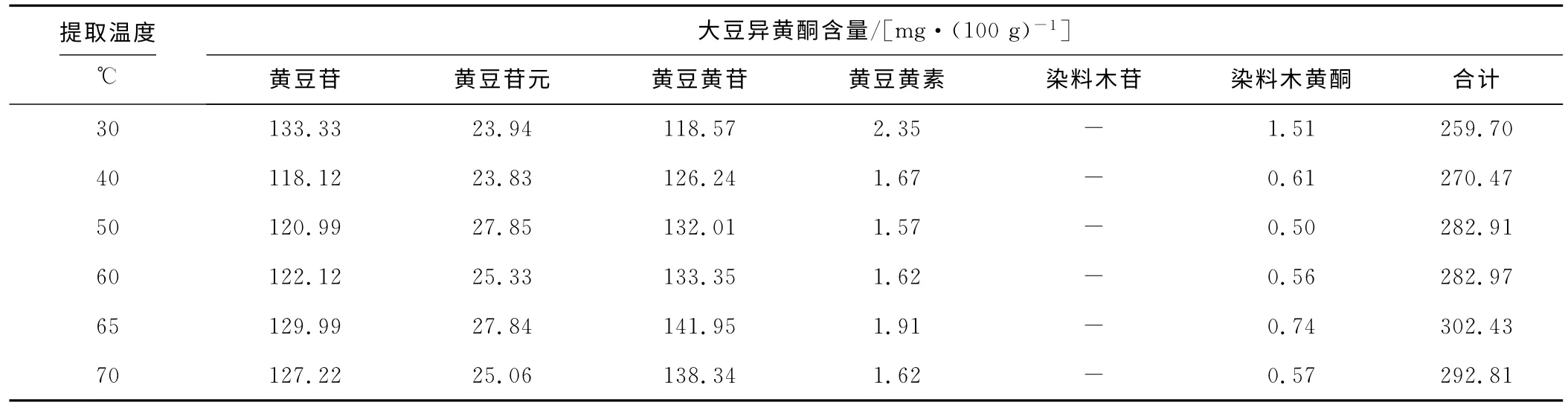
表1 提取温度对大豆异黄酮含量检测的影响Tab.1 The effect of extraction temperature on determination of soybean isoflavones
由表1可以看出:随着提取温度的升高,检测出的大豆异黄酮含量相应升高,65℃时达到最高,到70℃时检测出的含量反而下降。因此,选择最佳提取温度为65℃。
2.2 提取时间对大豆异黄酮含量检测的影响
提取温度为65℃、甲醇体积分数为80%,考察提取时间对大豆异黄酮含量检测的影响,结果如表2所示。
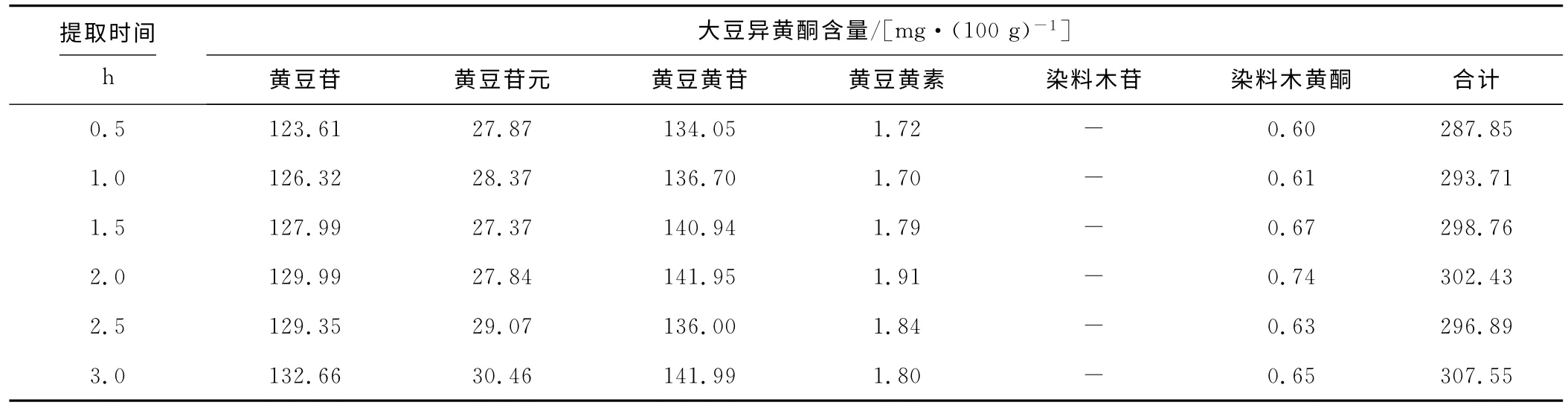
表2 提取时间对大豆异黄酮含量检测的影响Tab.2 The effect of extraction time on determination of soybean isoflavones
由表2可以看出:随着提取时间的延长,检测出的大豆异黄酮含量相应升高,但是2.0h之后,含量的升幅不明显。从经济和能源角度综合考虑,选择最佳提取时间为2.0h。
2.3 甲醇体积分数对大豆异黄酮含量检测的影响
提取温度为65℃、提取时间为2.0h,考察甲醇体积分数对大豆异黄酮含量检测的影响,结果如表3所示。
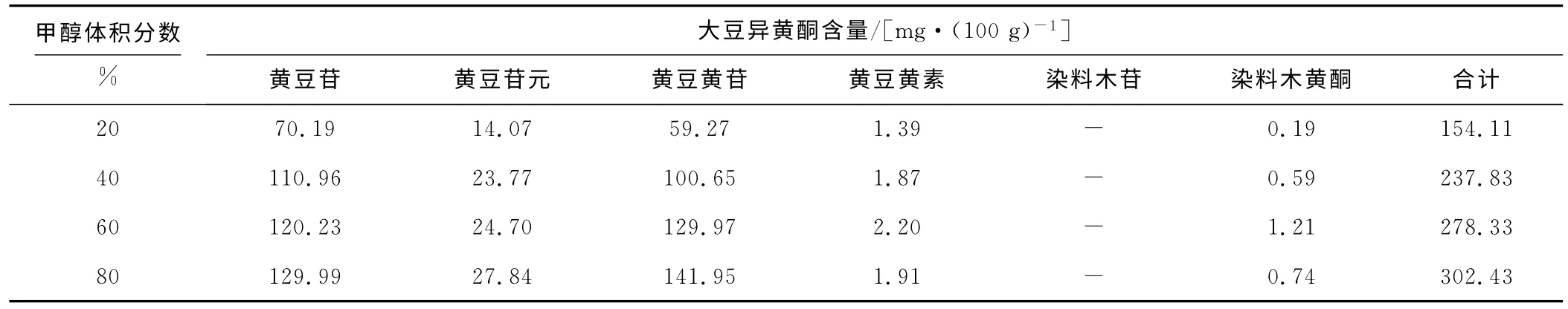
表3 甲醇体积分数对大豆异黄酮含量检测的影响Tab.3 The effect of methanol volume fraction on determination of soybean isoflavones
由表3可以看出:随着甲醇体积分数的增大,检测出的大豆异黄酮含量相应升高,但是由于80%甲醇溶液的沸点为69~70℃,若使用更高体积分数的甲醇来提取,甲醇会沸腾挥发,体积分数改变而影响检测结果。故选取最佳甲醇体积分数为80%。
2.4 日间精密度
提取温度为65℃、提取时间为2.0h、甲醇体积分数为80%,将提取后待检测提取液避光冷藏保存,连续5d检测大豆异黄酮含量,考察其稳定性,结果如表4所示。
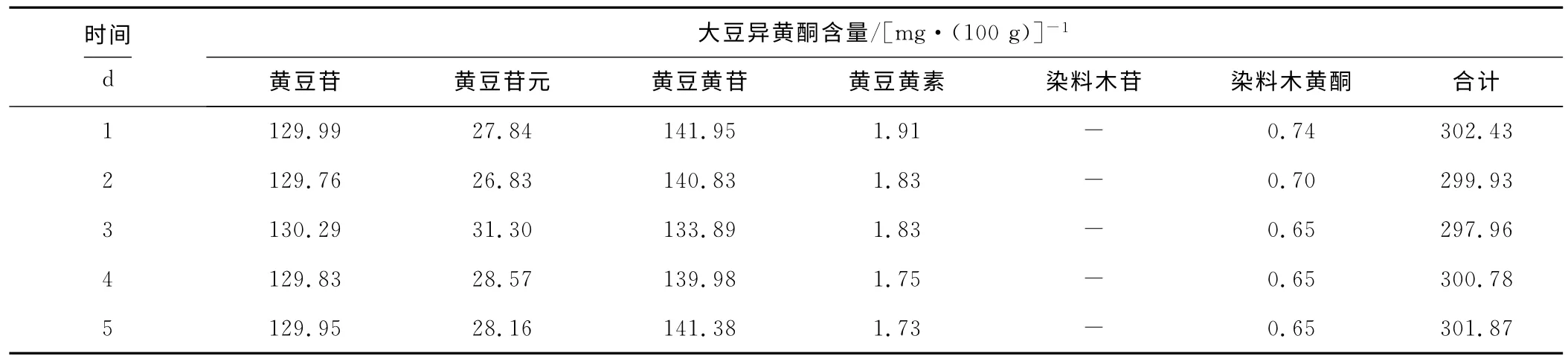
表4 大豆异黄酮含量检测的日间精密度Tab.4 The day to day precision of determination of soybean isoflovones
由表4可以看出,采用AOAC方法检测大豆异黄酮含量日间精密度良好,稳定性高,数据具有良好的可靠性。
2.5 标准曲线
6种大豆异黄酮的分离效果如图1所示,其标准曲线的线性回归方程如表5所示。

图1 6种大豆异黄酮的分离效果Fig.1 The separation effect of six kinds of soybean isoflavones
由图1可以看出,在设定的HPLC色谱条件下,6种大豆异黄酮保留时间适当,分离效果良好。
由表5可以看出,6种大豆异黄酮的标准曲线的线性回归系数良好,相关性高。
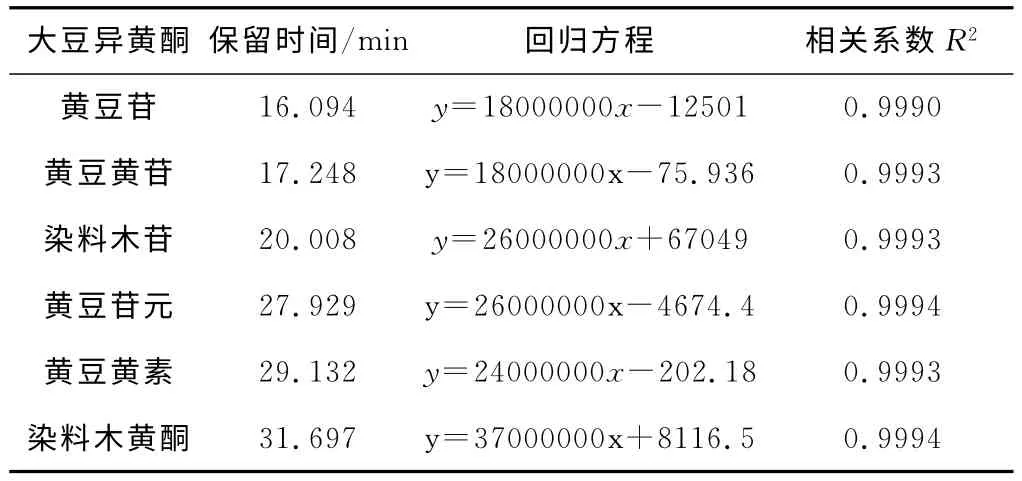
表5 6种大豆异黄酮的线性回归方程Tab.5 The linear regression equation of six kinds of soybean isoflavones
3 结论
研究表明,AOAC方法通过提取、皂化和液相色谱检测,能够简便而准确地检测出样品中大豆异黄酮的含量,其最佳提取温度为65℃、最佳提取时间为2.0h、最佳甲醇体积分数为80%。该方法在5d内的日间精密度良好,稳定性高。且AOAC方法中大豆异
黄酮的标准品的线性关系良好,可靠性高。只采用6种大豆异黄酮异构体就可检测出大豆异黄酮含量。AOAC方法操作简单、成本较低,对国内大豆异黄酮的测定具有较好的参考意义。
[1]张永忠,孙艳梅.大豆异黄酮研究中的名词术语[J].中国粮油学报,2004,19(4):46.
[2]高荣海,张春红,赵秀红,等.大豆异黄酮研究进展[J].粮食与油脂,2009,(5):1-4.
[3]崔洪斌,刘颖,陈近利,等.大豆中具有生命活性物质的研究与开发[J].大豆通报,1998,19(6):21-22.
[4]殷丽君,李里特,李再贵,等.大豆异黄酮的研究近况与展望[J].食品科学,2002,23(4):152-154.
[5]蔡娟,卢建,施寿荣,等.大豆、大豆异黄酮研究历程[J].饲料工业,2013,34(3):17-20.
[6]高秀芝,刘慧,丁雪莲,等.大豆异黄酮的研究与应用进展[J].食品科学,2004,25(11):386-391.
[7]石治强,吴雨珊,杨文钰,等.大豆异黄酮抑菌的研究进展[J].大豆科学,2011,30(6):1047-1050.
[8]谢明杰,高爽,邹翠霞,等.大豆异黄酮的生理功能研究进展[J].食品与发酵工业,2004,30(5):94-98.
[9]李琳,钱忠明.大豆异黄酮的药理作用和保健功能的研究进展[J].中国药学杂志,2002,37(10):724-726.
[10]刘志胜,李里特.大豆异黄酮及其生理功能研究进展[J].食品工业科技,2002,21(1):78-80.
[11]陈玉胜.大豆异黄酮抗高尿酸血症活性研究初探[J].大豆科学,2013,32(2):279-282.
[12]黄进,罗琼,李晓莉,等.大豆异黄酮的降血糖活性研究[J].食品科学,2004,25(1):166-170.
[13]迟晓星,张涛,郑丽娜,等.大豆异黄酮对青年雌性大鼠的抗氧化作用研究[J].中国食品学报,2010,10(5):78-82.
[14]STEPHEN P,KLUMP M C,ALLRED J L,et al.Determination of isoflavones in soy and selected foods containing soy by extraction,saponification,and liquid chromatography:Collaborative study[J].Food Composition and Additives,2001,84(6):1865-1878.
