MTNR1a基因在内蒙古绒山羊下丘脑、垂体及卵巢中的表达
2014-01-14赵艳红王琳张铁佳张文广张燕军苏蕊刘志红王瑞军李金泉
赵艳红,王琳,张铁佳,张文广,张燕军,苏蕊,刘志红,王瑞军,李金泉
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古农业大学动物遗传育种与繁殖重点实验室,呼和浩特 010018)
MTNR1a基因在内蒙古绒山羊下丘脑、垂体及卵巢中的表达
赵艳红1,2,王琳1,2,张铁佳1,2,张文广1,2,张燕军1,2,苏蕊1,2,刘志红1,2,王瑞军1,2,李金泉1,2
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古农业大学动物遗传育种与繁殖重点实验室,呼和浩特 010018)
采用RT-PCR和原位杂交方法检测MTNR1a mRNA在内蒙古绒山羊下丘脑、垂体及卵巢中的表达及分布。结果表明,MTNR1a基因在内蒙古绒山羊下丘脑、垂体、卵巢中均有表达,且在下丘脑、垂体组织中呈广泛表达,在卵巢的卵泡膜细胞阳性表达。下丘脑、垂体、卵巢是褪黑激素作用靶器官,阐明褪黑激素对内蒙古绒山羊繁殖力的影响是通过与靶器官受体基因结合发挥其功能,为进一步探讨褪黑激素对内蒙古绒山羊繁殖影响的作用途径及调控机理奠定基础。
MTNR1a;绒山羊;下丘脑;垂体;卵巢;表达;RT-PCR;原位杂交
内蒙古绒山羊属于季节性繁殖动物,其发情周期受光照时间影响,一般在光照由长变短的秋季发情,由于光照时间变短促使机体分泌多种激素参与调节繁殖,其中下丘脑-垂体-性腺轴对机体内激素的调控起重要作用[1]。调节哺乳动物生殖的神经中枢是下丘脑的正中隆起和视交叉[2]。通过大脑皮层的神经递质将动物体内的激素和外部的刺激,传递到下丘脑,并产生促性腺激素释放激素。促性腺激素释放激素一方面作用于垂体,使其产生LH、FSH及黄体生成,LH促进雌性排卵而FSH刺激卵泡发育,另一方面促性腺激素释放激素也可直接与卵巢作用[3],使卵巢分泌的类固醇激素对下丘脑或垂体起负反馈作用。研究表明,下丘脑中存在雌激素受体,雌激素与受体结合进而影响下丘脑神经元结构和功能[4]。使促性腺激素释放激素释放呈波动式[5]。因此,下丘脑、垂体、卵巢之间是相互制约、相互影响、共同调控动物繁殖性能的统一体。
褪黑激素(Melatonin,MEL)是吲哚类激素[6],在人和哺乳动物体内主要由脑部松果腺分泌,其分泌受光照影响,表现出明显的昼低夜高的节律变化。动物褪黑素的分泌还能根据年光照周期变化而变化,调整内分泌系统等以适应环境变化。作为神经内分泌传感器的松果腺,能接受来自视网膜和视交叉上核的光照信息,通过调节褪黑激素的分泌将这一信息传递给靶组织和靶细胞。光照控制褪黑激素分泌,呈昼少夜多、长日照少、短日照多分泌规律[7]。研究表明,季节性繁殖动物的生殖行为随褪黑激素分泌周期变化而变化,褪黑激素是哺乳动物繁殖节律系统重要因子[8]。光通过视网膜作用于松果体,使之分泌褪黑激素,褪黑激素通过下丘脑-垂体-性腺轴影响动物繁殖系统功能。
研究表明,褪黑激素主要作用于下丘脑MBH区,在下丘脑水平上调节促性腺激素分泌,影响生殖系统功能,完成其对动物繁殖的光周期调节作用,也可直接作用于垂体腺结节部(Parstuberalis,PT)介导光周期信号[9]。垂体中存在大量的褪黑激素受体(MR),褪黑激素与受体结合抑制垂体对下丘脑分泌GnRH反应,使垂体FSH和LH分泌量减少,使性腺轴处于发育迟缓状态,随年龄增长,垂体中褪黑激素受体(MR)数量减少,缺少与褪黑激素结合受体,对垂体抑制作用减弱甚至消失,从而对生殖轴的抑制作用随之消失。褪黑激素也可与卵巢、睾丸[10]和肾上腺细胞中褪黑激素受体结合直接影响性腺激素分泌和合成,控制生殖器官发育和成熟。通过对蟾蜍的线粒体分离培养,发现褪黑激素可刺激枸缘酸氧化,提高C/F值,而蟾蜍C/F值是反应性机能特征值,一般秋季最高,抑制排卵[11]。
本研究以内蒙古绒山羊为研究对象,采取成年母羊卵巢、下丘脑、垂体组织,采用ISH和RTPCR技术检测褪黑激素受体1a基因(Melatonin receptor 1a,MTNR1a)在以上三个组织中核酸水平表达及分布,阐明褪黑激素对季节性繁殖动物变化影响,以期通过人为手段调节绒山羊的季节发情,提高山羊繁殖能力。
1 材料与方法
1.1 材料
所有样品均采自内蒙古鄂尔多斯市鄂托克旗阿尔巴斯种羊场成年母山羊,将获得的下丘脑、垂体及卵巢组织一部分用4%多聚甲醛固定,用于制作原位杂交用的石蜡切块,另一部分于-80℃冷冻保存,用于RNA提取。
1.2 方法
1.2.1 总RNA提取、纯化及反转录
按照Promega公司提供的试剂盒说明书进行总RNA提取、纯化及反转录,最后将获得的cDNA分装,并于-20℃保存。
1.2.2 引物设计
根据GenBank中公布的绵羊、牛、人、鼠和黑猩猩等动物的MTNR1a基因的mRNA序列,进行序列比对找到保守序列,利用Premier 5.0设计软件和引物设计原则进行设计,其中上游引物5'CTGTCC GTGTATCGGAACAAG 3',下游引物5'CCTGGGG CTTTAGTTTCGGTTTGT 3',扩增片段大小为550 bp,引物为跨内含子。在获得的550 bp的MNTR1acDNA上再设计一对引物,上游引物5'AACTACGA GCATCGGAACT 3',下游引物5'CTTGGCACTGGC GTCTAT 3',预计目的片段为364 bp,将获得的产物进行克隆、标记,作为制备MNTR1a探针模板,引物序列均由大连宝生物公司合成。
1.2.3 RT-PCR扩增
RT-PCR扩增反应总体积25 μL:模板cDNA约(50 ng·L-1)1.0 μL、上下游引物(10 pmol·L-1)各1.0 μL、Mix 12 μL、三蒸水10 μL。
RT-PCR反应程序:95℃预变性5 min;94℃变性30 s,退火温度分别为59和56℃,30 s,72℃延伸30 s,经过33个循环后;于72℃延伸10 min。RT-PCR扩增产物于1.2%琼脂糖凝胶电泳检测。
1.2.4 mRNA结果检测
取总mRNA 4 μL,电压80 V,时间25 min,用1.2%琼脂糖凝胶进行电泳检测,紫外灯观察并拍照保存。
1.2.5 RT-PCR扩增产物检测
取PCR产物5 μL,100 V电压,25 min,1.5%琼脂糖凝胶电泳检测,以DL2000 Marker作分子质量对照,在紫外灯下将明亮单一的条带切胶回收,并进行测序,其余于4℃保存。
1.2.6 组织原位杂交(ISH)
1.2.6.1 组织切片的制备
将下丘脑、垂体及卵巢组织放在4%多聚甲醛中,4℃过夜固定;次日,用1×PBS缓冲液冲洗固定好的组织样4次,每次1.5 h,之后,于4℃过夜;次日,分别用95%、90%、75%酒精脱水、透明,最后浸蜡、包埋;连续切8 μm厚的切片,载玻片用多聚赖氨酸处理,然后将切片贴于载玻片上,在40℃烘箱中烘烤24 h。
1.2.6.2 探针制备
将获得的片段为364 bp的MNTR1acDNA扩增产物,凝胶回收并纯化;将纯化产物与PGM-T载体连接,并用DH5α感受态细胞转化,选取白斑单菌落,进行过夜培养;经过凝胶电泳鉴定后提取质粒DNA,并以质粒DNA为模板,用通用引物SP6、T7进行PCR扩增,扩增产物分别作为反义链、正义链探针的模板。选用Roche公司生产的DIG试剂盒进行探针标记,制备好的探针保存于-80℃冰箱中。
1.2.6.3 原位杂交
将贴于载玻片上的已烘烤好的下丘脑、垂体、卵巢组织切片于无酶水中展片,继续42℃烘烤24 h。然后经过预杂交、杂交、显色、封片,最后于37℃烘干,并拍照分析。
2 结果与分析
2.1 RNA提取结果
取4 μL总RNA,电压80 V,时间25 min, 1.2%琼脂糖凝胶电泳检测,可见28S RNA和18S RNA两条带较清晰明亮、无拖尾痕迹(见图1),说明提取的RNA完整、无降解。
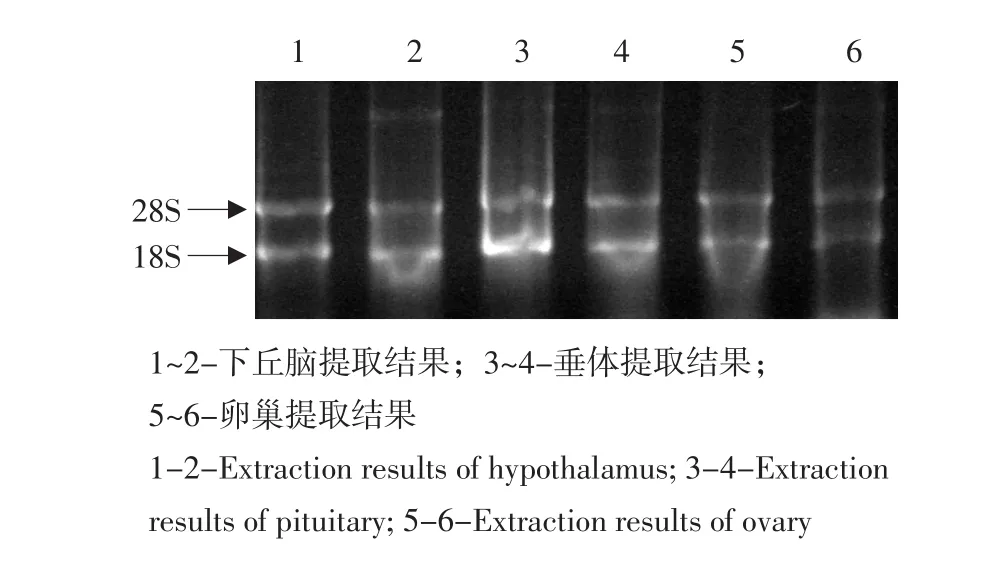
图1 下丘脑、垂体及卵巢总RNA提取结果Fig.1 RNA extract of the hypothalamus, pituitary and ovary
2.2 总RNA的纯化结果
经紫外分光光度检测,所提取的总RNA OD260/280比值均在1.9和2.0之间,说明RNA纯度较高,可以进行后续试验。
2.3 RT-PCR扩增结果
利用设计的两对引物分别在下丘脑、垂体及卵巢组织中扩增出550和364 bp清晰明亮的MTNR1acDNA特异片段,与预计片段大小一致,经过克隆、测序证实为内蒙古绒山羊MTNR1acDNA序列。将两段扩增序列进行琼脂糖电泳检测,得到结果如图2、3所示。

图2 MTNR1a RT-PCR扩增结果Fig.2 RT-PCR amplification results of MTNR1a

图3 MTNR1a cDNA PCR扩增结果Fig.3 PCR amplification results of MTNR1a
2.4 原位杂交结果
2.4.1MTNR1a在下丘脑、垂体及卵巢组织中表达分布
用下丘脑组织扩增出的364 bp序列作为MTNR1a基因的cDNA探针,分别在卵巢、下丘脑、垂体组织切片上进行ISH检测,在下丘脑和垂体组织中检测到呈广泛表达的较强阳性信号(见图4A、B),在卵巢的卵泡膜细胞和颗粒细胞中检测到较强的阳性信号(见图4C)。
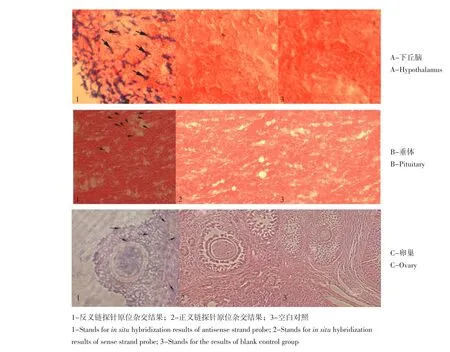
图4 内蒙古绒山羊MNTR1a在下丘脑、垂体、卵巢原位杂交结果Fig.4 In situ hybridization results of Inner Mongolia cashmere goat MNTR1a in the hypothalamus,pituitary and ovary
3 讨论与结论
有关褪黑激素分泌与季节性繁殖的联系可能存在于下丘脑-垂体-性腺轴上。研究发现,MTNR1a基因在不同种属的不同组织均有广泛表达,在表达分布上不同种属间存在特异性[12-13],Poblos等提出褪黑激素受体在所有细胞中均存在表达[14]。MTNR1a受体基因在老鼠大脑动脉、松果体、视丘下部都存在表达。存在于下丘脑中的MTNR1a在褪黑激素调节昼夜节律功能中发挥重要作用[15],而在垂体MTNR1a则是与生殖反应有关[16]。Yu等认为褪黑激素可能作用于多个位点[17],将不同位点作用累积,多动物生殖腺系统起调节作用。在下丘脑的多个部位中也存在MTNR1a表达,到目前为止,下丘脑参与调节活动的部位仍不明确[18]。何兰花研究表明[19],光照对生殖机能的调节通过褪黑激素介导传递到下丘脑一垂体一性腺轴,褪黑激素对长日照季节性繁殖动物的生殖系统有抑制作用,在下丘脑水平上调节促性腺激素分泌,影响生殖系统功能,还能直接调节性腺激素如LH和FSH等激素的合成和分泌。Tamura等研究发现褪黑激素直接影响卵巢功能是通过卵巢颗粒细胞中的受体来实现[20]。
褪黑激素调节绵羊的繁殖功能是通过视丘下部乳头前体实现,Migaud等利用ISH和RT-PCR技术在绵羊的视丘下部乳头前体检测到MTNR1受体基因的cDNA表达[21],通过35S标记羊的MTNR1a肋骨探针ISH方法,证实MTNR1amRNA在视丘下部乳头前体表达。MTNR1受体基因在许多绵羊品种中存在多态,体现褪黑激素影响季节性繁殖效应。结果显示MTNR1amRNA在绵羊视丘下部乳头前体表达,且存在昼夜节律差异。
本研究采用RT-PCR技术,在内蒙古绒山羊下丘脑、垂体及卵巢中检测到MTNR1a基因表达。通过ISH技术检测到MTNR1a基因在下丘脑、垂体中广泛表达,在卵巢的卵泡膜细胞和颗粒细胞均有表达。因此,认为下丘脑、垂体和卵巢可能是褪黑激素作用的靶器官,褪黑激素与这些组织中MTNR1a受体结合,对季节性繁殖哺乳动物的繁殖产生影响。
[1]王建辰.家畜生殖内分泌[M].北京:农业出版社,1993:32-102.
[2]谢启文.神经内分泌学[M].沈阳:辽宁科学技术出版社,1990.
[3]袁其晓.排卵[J].国外医学-计划生育、妇产科学分册,1980(4): 144.
[4]Dufourny L,Warembourg M.Estrogen modulation of neu-ropeptides:somatostatin,neurotensin and substance P,in theventrolateral and arcuate nuclei of the female guinea pig[J].Neurosci Res,1999,33(3):233-238.
[5]Tilbrook A J,De Kretser D M,Cummins J T,et al.Thenegative feedback effects of testicular steroids are predom-inantly at the hypothalamus in the ram[J].Endocrinology,1991,129(6):3080-3092.
[6]Cutando A,Gómez-Moreno G,Arana C,et al.Melatonin stimulates osteointegration of dental implants[J].J Pineal Res,2008,45 (2):174-179.
[7]王林枫.光照和埋植褪黑激素对内蒙古白绒山羊含氮物质分配和产绒性能的影响及调控的研究[D].呼和浩特:内蒙古农业大学,2005:31-32.
[8]Carter D S,Goldman B D.Progonadal role of the pineal in the Djungarian hamster(Phodopus sungorus sungorus):Media-tion by melatonin[J].Endocrinology,1983,113(4):1268-1273.
[9]von Gall C,Stehle J H,Weaver D R.Mammalian melatonin receptors:Molecular biology and signal transduction[J].Cell Tissue Res,2002,309(1):151-162.
[10]宋兴超,薛海龙,魏海军,等.外源褪黑激素对水貂睾丸形态及组织学结构的影响[J].东北农业大学学报,2012,43(9):107-112.
[11]Atenoer M,Romero J R,Brauckmann E,et al.Effects of the pineal gland and MT on the metabolism of oocytes in vitro on ovulation in Bufo arenarum[J].J Exp Zool,1994,268:436.
[12]Williams L M,Hannah L T,Hastings M H,et al.Melatonin receptors in the rat brain and pituitary[J].J Pineal Res,1995,19 (4):173-177.
[13]Shin S Y W,Ng N,Pang S F.A molecular perspective of the genetic relationship of G-protein coupled melatonin receptor subtypes[J].J Pineal Res,1996,20(4):198-204.
[14]Pablos M I,Guerrero J M,Oritz G G,et al.Both melatonin and a putative nuclear melatonin receptor agonist CGP 52608 stimulate glutathione peroxidase and glutathione reductase activities in mouse brain in vivo[J].Neuroendocrinol Lett,1997,18(2):49-58.
[15]Weaver D R,Stehle J H,Stopa E G,et al.Melatonin receptors in human hypothalamus and pituitary:Implications for circadian and reproductive responses to melatonin[J].J Clin Endocrinol Metab, 1993,76(2):295-301.
[16]Ross W A,Morgan P J.The pars tuberalis as a target of the central clock[J].Cell Tissue Res,2002,309(1):163-171.
[17]Yu Z H,Chow P H,Pang S F.Identification and characterization of I[125-I]-iodomelatonin binding sites in the rat epididymis[J].J Pineal Res,1994,17(4):195-201.
[18]Shiu S Y W,Yu Z H,Chow P H,et al.Putative melatonin receptors in the male reproductive tissues[J].Front Horm Res, 1996,21:90-100.
[19]何兰花.褪黑激素的研究进展[J].动物科学与动物医学,2002,19 (10):10-12.
[20]Tamura H,Nakamura Y,Korkmaz A,et al.Melatonin and the ova-ry:Physiological and pathophysiological implications[J].Fertil Steril,2009,92(1):328-343.
[21]Migaud M,Daveau A,Malpaux B.MTNR1A melatonin receptors in the ovine premammillary hypothalamus:day-night variation in the expressionofthetranscripts[J].BiolReprod,2005,72(2):393-398.
Expression ofMTNR1agene in hypothalamus,pituitary and ovary of Inner Mongolian cashmere goats
ZHAO Yanhong1,2,WANG Lin1,2,ZHANG Tiejia1,2, ZHANG Wenguang1,2,ZHANG Yanjun1,2,SU Rui1,2,LIU Zhihong1,2,WANG Ruijun1,2,LI Jinquan1,2(1.School of Animal Science,Inner Mongolia Agricultural University,Huhhot 010018,China;2.Key Laboratory of Animal Genetics,Breeding and Reproduction,Inner Mongolia Agricultural University, Hohhot 010018,China)
Using RT-PCR andin situhybridization method to checkMTNR1amRNA expression localization in hypothalamus,pituitary and ovary of Inner Mongolian cashmere goats.It turned out that MTNR1aexpressed in hypothalamus,pituitary and ovary of Inner Mongolian cashmere goats,in addition,there were a stronger expression signal in the hypothalamus and pituitary,the expression signal could be seen in thecal cells of ovary.Therefore,hypothalamus,ovary and pituitary were the target organs of melatonin.It also showed melatonin,which combined with target organs'receptor gene,affected reproductive performance of Inner Mongolian cashmere goats,which laid a foundation for making a further explore to the pathway,regulation and control mechanism with melatonin.
MTNR1a;cashmere goats;hypothalamus;pituitary;ovary;expression;RT-PCR;in situ hybridization
S827.913.4;Q786
A
1005-9369(2014)05-0092-05
2013-11-26
国家自然科学基金项目(31160447,30760163);内蒙古自然基金项目(2013MS0417)
赵艳红(1967-),女,副教授,博士,研究方向为绒山羊遗传育种与繁殖。E-mail:13947196432@163.com
时间2014:01:07[URL]http://w40512.0901.014.html
赵艳红,王琳,张铁佳,等.MTNR1a基因在内蒙古绒山羊下丘脑、垂体及卵巢中的表达[J].东北农业大学学报,2014,45(5): 92-96.
Zhao Yanhong,Wang Lin,Zhang Tiejia,et al.Expression ofMTNR1agene in hypothalamus,pituitary and ovary of Inner Mongolian cashmere goats[J].Journal of Northeast Agricultural University,2014,45(5):92-96.(in Chinese with English abstract)
