产甲酸草酸杆菌细胞数群体感应系统基因hdtS克隆和功能分析
2014-01-14姜巨全刘贺男肖鸿禹付晓薇朱光宇
姜巨全,刘贺男,肖鸿禹,付晓薇,朱光宇
(东北农业大学生命科学学院,哈尔滨 150030)
产甲酸草酸杆菌细胞数群体感应系统基因hdtS克隆和功能分析
姜巨全,刘贺男,肖鸿禹,付晓薇,朱光宇
(东北农业大学生命科学学院,哈尔滨 150030)
为鉴定产甲酸草酸杆菌(Oxalobacter formigenes)是否具有细胞数群体感应(QS)系统,将费氏弧菌(Vibrio fischeri)和荧光假单胞菌(Pseudomonas fluorences)QS系统相关基因与产甲酸草酸杆菌(O.formigenes)基因组序列进行比对,初步确定hdtS和AGPA为QS系统候选基因。通过PCR和T-A克隆方法分别克隆以上两个基因并将其构建成表达载体pET19-hdtS和pET19-AGPA,借助SDS-PAGE凝胶电泳证实以上两个基因均在大肠杆菌(Escherichia coli)BL21(DE3)中高效表达,采用平板菌株报告法鉴定hdtS具有酰基高丝氨酸内酯(AHL)合成酶的功能,而AGPA则不具有该功能。这是国内外首次报道产甲酸草酸杆菌(O.formigenes)中QS系统有关基因,对该菌株QS系统了解及分析影响该菌株在人肠道内定殖因素具有重要意义。
克隆;鉴定;产甲酸草酸杆菌;细胞数群体感应系统;hdtS;AGPA
细胞数群体感应(Quorum-sensing system,QS)效应是细菌群体行为调控机制。QS系统作用机制是细菌产生并释放一种自诱导物(Autoinducer,AI)酰基高丝氨酸内酯(Acylhomoserine lactone,AHL),当该物质积累到一定浓度(阈值)时,可被自身及其他细菌检测到,诱导细菌中QS相关基因表达[1]。研究表明,细菌通过QS系统可获得单个菌体本身无法完成的群体性生理功能[2-4]。如双歧杆菌属(Bifidobacterium)等肠道益生菌在肠道定殖及与肠道共生作用[2-3],病原微生物霍乱弧菌(Vibrio cholerae)对机体病原性侵染等[4]。
目前,革兰氏阴性菌的QS系统根据AHL合成酶及其调控蛋白可分为3类:LuxI-LuxR系统[1]、LuxM-LuxN/AinS-AinR系统[5-7]和HdtS[8-9]。前两类系统的研究比较深入详细,均由AHL合成酶及其调控蛋白组成;第三类QS系统研究却非常有限。在荧光假单胞菌(Pseudomonas fluorences)中,HdtS蛋白能够产生3-羟基-碳14∶1、碳10∶1或碳6∶1的3种AHL[8]。在专性嗜酸的氧化亚铁硫杆菌(Acidi⁃thiobacillus ferrooxidans)中,Act蛋白与荧光假单胞菌中的HdtS有37%同源性,编码该蛋白的act基因与编码甘氨酸tRNA合成酶的α、β亚单位的glyQ和glyS及编码磷酸脂酶的gph形成一个基因簇。这一基因位点在整个变性菌门(Proteobacteria)中具有高度保守性,基因序列一致。Act蛋白被证实编码合成链长为14碳AHL,后者负责调控氧化亚铁硫杆菌(A.ferrooxidans)中Lux类型QS系统[9]。第三类QS系统仅限于AHL合成酶鉴定,但未发现与其相关的任何调控蛋白。
产甲酸草酸杆菌(Oxalobacter formigenes)是一株专性厌氧的革兰氏阴性菌,以草酸作为唯一碳源和能源。试验表明,产甲酸草酸杆菌对降低尿中草酸浓度具有重要作用:①可通过降解食物中的草酸,减少血液从肠道食物中吸收的草酸,进而降低尿中草酸浓度[10-11];②可与肠道黏膜相互作用,使血液中过高的草酸向肠道反向转运,降低血液中草酸浓度和尿中草酸浓度[12]。临床调查显示,在肾结石患者肠道内,产甲酸草酸杆菌定殖率明显低于其在健康人肠道内定殖率[12-13]。产甲酸草酸杆菌定殖与肾结石的再发率呈显著负相关[14]。目前影响产甲酸草酸杆菌定殖的因素仍不清楚。只有少数研究报道,在肾结石患者中,该菌株的丧失与抗生素的过量服用有密切关系[15]。
既然很多肠道细菌的定殖受QS系统控制[2-4],该系统也可能对产甲酸草酸杆菌的定殖同样起到重要作用。至今尚无任何关于产甲酸草酸杆菌的QS系统的报道。因此,为鉴定该菌QS系统,本研究对QS系统中有关基因进行克隆及功能分析,结果发现hdtS基因具有AHL合成酶功能。这是国内外首次报道产甲酸草酸杆菌(O.formigenes)中QS系统有关基因,对增进对该菌株QS系统了解及分析影响该菌株在人肠道内定殖因素具有重要意义。
1 材料与方法
1.1 材料
1.1.1 供试菌株与载体
产甲酸草酸杆菌HOxBLS和根瘤菌(Sinorhizobi⁃um meliloti)Rm1021来自本实验室;根癌农杆菌(Agrobacterium tumefaciens)NTL4(pZLR4)由中国农业大学张立群教授提供,该菌株含有一个包括融合基因traI:lacZ和traR的pTiC58质粒(庆大霉素抗性);大肠杆菌(E.coli)DH5α、BL21、Trans-T1感受态细胞均购自全式金生物公司。原核表达载体pET19-pp-histag(氨苄霉素抗性)由美国维克森林大学W.Todd Lowther教授提供,该载体由提供者在Qiagen公司购买的原核表达载体pET19的组氨酸残基后,加入一个PreScission Proteinase蛋白酶的酶切位点。
1.1.2 主要仪器
美国Bio-Rad公司Gel Doc XR+凝胶成像系统,美国Bio-Rad公司PowerPac HC型电泳仪,TC-96/G/H(b)B型PCR仪,宁波新芝生物公司N&DN系列(LCD)型超声波细胞粉碎机,美国ThermoFisher公司Pico17离心机,上海安亭TGL-16B台式离心机等。
1.1.3 主要药品与试剂
氨苄青霉素、庆大霉素购自美国AMRESCO公司;核酸和蛋白Marker、Taq DNA聚合酶、dNTPs、普通琼脂糖凝胶DNA回收试剂盒均购自天根生物技术有限公司;Nde I、Bam H I均购自Ta⁃KaRa公司;pEASY-T3 Simple Cloning Kit、Easy Pfu DNA polymerase、T4DNA连接酶均购自北京全式金生物技术有限公司。
1.1.4 培养基和培养条件
LB培养基(1 L):酵母提取物5 g,蛋白胨10 g,NaCl 10 g,用5 mmol·L-1NaOH调pH至7.0。如需配制固体培养基,加入15 g琼脂。大肠杆菌(E.coli)转化子在LB平板上37℃培养;根癌农杆菌(A.tumefaciens)NTL4在LB液体培养基中160 r·min-1、28℃培养24 h。
TY培养基(1 L):酵母提取物3 g,蛋白胨5 g,CaCl20.6 g,用5 mol·L-1NaOH调pH至7.0。如需配制固体培养基,加入15 g琼脂。根瘤菌Sm1021在液体培养基中160 r·min-1、28℃振荡培养24 h。
AB培养基:5×A母液(1 L):(NH4)2SO42 g,Na2HPO49.6 g,KH2PO43 g,NaCl 3 g,用蒸馏水定容至200 mL;1×B母液(1 L):0.1 mol·L-1CaCl21 mL,1 mol·L-1MgCl21 mL,0.003 mol·L-1FeCl31 mL,用蒸馏水定容至800 mL,分别121℃灭菌30 min备用。配制AB培养基时,将200 mL 5×A与800 mL 1×B混合,并向AB培养基中加入终浓度为0.2%葡萄糖或0.4%醋酸盐作为碳源。
1.2 方法
1.2.1 QS系统候选基因的全基因组分析
产甲酸草酸杆菌OXCC13(序列号ACDQ 00000000.1)和HOxBLS(序列号ACDP00000000.2)的基因组已经被测序完成。在本研究中,借助已知的QS系统模式菌株费氏弧菌(V.fischeri)的luxI/ luxR基因(序列号YP_206882.1/AAQ90196.1)、luxM/luxN基因(序列号BAF43686.1/BAF43687.1)和ainS/ainR基因(序列号YP_204420.1/YP_ 204419.1)以及荧光假单胞菌的hdtS基因(序列号AEV60042.1),与产甲酸草酸杆菌的基因组进行比对,获得QS系统的候选基因。
1.2.2 热启动PCR扩增基因
根据QS系统候选基因序列,使用Primer Pre⁃mier 5.0设计引物,由华大基因合成,引物序列见表1,其中:CATATG为Nde I酶切位点;GGATCC为Bam H I酶切位点。平末端加A之后,琼脂糖凝胶DNA回收试剂盒回收目的片段。

表1 hdtS与AGPA上下游引物Table 1 Upstream and downstream primers of genes hdtS and AGPA
1.2.3 T-A克隆载体构建
按照北京全式金生物技术有限公司pEASY-T3 Cloning Kit的说明书进行连接转化。蓝白斑法挑取菌落白色的阳性克隆,提取质粒,进行PCR验证及双酶切验证,基因测序由华大基因公司完成。
1.2.4 表达载体构建
提取质粒pET19-pp-histag和T-A克隆的重组质粒,分别用Nde I、Bam H I进行双酶切(100 μL双酶切体系:10×Buffer 10 μL,质粒50 μL,Nde I 2 μL,Bam H I 2 μL,ddH2O 36 μL)。将双酶切后的pET19-pp-histag及目的基因片段,用琼脂糖凝胶DNA回收试剂盒回收后,16℃过夜连接(连接方法按T4DNA连接酶使用说明书操作)。取适量连接体系,转化大肠杆菌(E.coli)BL21感受态细胞。操作方法按大肠杆菌(E.coli)BL21(DE3)感受态细胞使用说明书操作。
培养后挑取阳性重组子,进行PCR及双酶切验证正确后,送华大基因公司测序,最终确定hdtS与AGPA是否融合到表达载体histag的开放阅读框架(ORF)内。
1.2.5 候选基因在大肠杆菌中的诱导表达
分别过夜培养BL21/pET19-HdtS、BL21/pET 19-AGPA,转接100 mL LB培养基,继续培养至OD600为1.0。各取1 mL上述两种菌液,离心收集菌体,作为诱导前样品。向上述两种培养液中分别添加终浓度1 mol·L-1的IPTG,37℃诱导表达3 h。各取1 mL上述两种菌液,离心收集菌体,作为诱导后样品。将上述两种菌液剩余部分,离心收集菌体,用50 mmol·L-1的PBS(pH 7.2~7.4)缓冲液清洗两次,离心,去上清,再取适量缓冲液重悬细胞(保证菌体破壁后蛋白总量与1 mL菌液的蛋白量相同),同时加入终浓度为1 mmol·L-1的PMSF,最后在冰浴中进行超声波破碎至菌液澄清(超声波的具体参数为10%Hz,工作时间20 min,每次超声1 s,间隔时间1.5 s)。取破碎液,离心,收集上清及沉淀。上清作为可溶性蛋白样品,沉淀用等体积的缓冲液重悬,作为不可溶性蛋白样品。以上所有样品进行SDS-PAGE蛋白质电泳检测。
1.2.6 AHL合成酶的平板菌株报告法
分别将根癌农杆菌NTL4、根瘤菌Rm1021、BL21/pET19-HdtS、BL21/pET19-AGPA和BL21/ pET19-pp-histag分别接入AB基本培养基(X-gal终浓度为40 μg·mL-1)中,28℃恒温培养后观察菌落周围颜色是否变蓝。
2 结果与分析
2.1 QS系统候选基因的确定
如表2所示,在两株产甲酸草酸杆菌的基因组中,没有任何序列与ainS/ainR基因具有同源性;而一些序列分别与luxI/luxR基因、luxM/luxN基因具有非常低的同源性(4.6%~15.8%);然而,一个编码推测的1-酰基-sn-甘油-3-磷酸转移酶(Puta⁃tive 1-acyl-sn-glycerol-3-phosphate acyltransferase)的基因(在HOxBLS中的序列号为OFAG_01224)与荧光假单胞菌的hdtS具有高度同源性(分别为36.0%和36.7%)。
研究发现,该基因不仅与荧光假单胞菌的hdtS高度同源,而且与目前被鉴定的氧化亚铁硫杆菌中的编码HdtS型AHL合成酶的act基因也高度同源(见图1)。此外,产甲酸草酸杆菌中hdtS基因与编码甘氨酸tRNA合成酶的α、β亚单位的glyQ和glyS以及编码磷酸脂酶的gph形成一个基因簇(见图2),这与氧化亚铁硫杆菌中的act基因与编码甘氨酸tRNA合成酶的α、β亚单位的glyQ和glyS及编码磷酸脂酶gph形成的基因簇的基因顺序也高度一致。因此,推测编码1-酰基-sn-甘油-3-磷酸转移酶的基因很可能就是产甲酸草酸杆菌中编码HdtS类的QS系统候选基因,定名为hdtS。

表2 产甲酸草酸杆菌HOxBLs及OXCC13的群体感应系统基因组学分析Table 2 Genomic analyses for quorum sensing systems ofOxalobacter formigenesHOxBLS and OXCC13
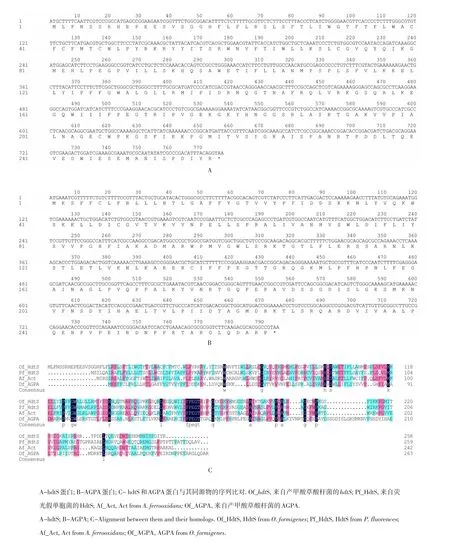
图1 hdtS和AGPA的推测氨基酸序列及其与同源物的同源性比对Fig.1 Deduced amino acid sequences of hdtS and AGPA,together with alignment between them and their homologs

图2 HOxBLS的hdtS基因及其上下游序列形成的基因簇结构Fig.2 Mapping of hdtS and its upstream and downstream sequences from O.formigenes HOxBLS
在基因组分析过程中,还意外发现另一个基因(序列号OFAG_01272)也被推测为编码1-酰基-sn-甘油-3-磷酸转移酶,该基因编码蛋白与荧光假单胞菌hdtS蛋白(41.7%)、氧化亚铁硫杆菌中Act蛋白(36.7%)及上述HdtS蛋白(19.7%)均具有一定同源性(见图1C)。选择AGPA作为另一个AHL合成酶的候选基因,将其定名为AGPA(putative 1-acyl-sn-glycerol-3-phosphate acyltransferase)。基因hdtS和AGPA的核苷酸序列和推测蛋白序列如图1A、B。
2.2 QS系统候选基因克隆载体和表达载体的构建
以产甲酸草酸杆菌HOxBLS基因组DNA为模板,使用PCR分别扩增hdtS与AGPA基因,并通过T-A克隆方法将PCR产物克隆到pEASY-T3载体上,转化大肠杆菌Trans-T1感受态细胞得到阳性克隆,经测序验证二者均与原序列一致。为验证这两个基因是否具有AHL合成酶功能,将hdtS与AGPA构建到表达载体pET19-pp-histag中,转化大肠杆菌(E.coli)BL21(DE3)感受态细胞,经PCR扩增、双酶切及测序验证,hdtS与AGPA均成功融合到表达载体histag的开放阅读框架(ORF)内。转入表达载体大肠杆菌(E.coli)BL21(DE3),分别命名为BL21/pET19-hdtS和BL21/pET19-AGPA。
2.3 pET19-hdtS及pET19-AGPA在大肠杆菌中的诱导表达
为鉴定hdtS与AGPA是否表达,分别对BL21/ pET19-hdtS与BL21/pET19-AGPA进行IPTG诱导,并在诱导前后取样,将样品与相应细胞破碎后的上清和沉淀样品进行SDS-PAGE凝胶电泳。如图3所示,BL21/pET19-hdtS与BL21/pET19-AGPA在35 ku附近均出现一条明显的粗带,与预测hdtS或AGPA蛋白分子质量(34 ku)接近,表明hdtS与AG⁃PA基因在大肠杆菌(E.coli)BL21(DE3)中被高效诱导表达。此外,在BL21/pET19-hdtS或BL21/ pET19-AGPA细胞破碎后的上清液中也出现同样大小且浓度相近的粗带(见图3),表明诱导表达的hdtS或AGPA蛋白大部分可溶,说明在大肠杆菌(E.coli)BL21(DE3)中异源表达后,hdtS或AGPA蛋白应该正确折叠且具有活性。

图3 hdtS与AGPA在大肠杆菌中的诱导表达及蛋白可溶性分析Fig.3 Expression and solubility analysis of hdtS and AGPA in E.coli BL21
2.4 hdtS及AGPA的功能分析
使用平板菌株报告法,验证BL21/pET19-hdtS及BL21/pET19-AGPA是否具有AHL合成酶功能。报告菌株根癌农杆菌NTL4含1个包括融合基因traI:lacZ和traR的pTiC58质粒,如果受测试菌株产生AHL,而AHL又可以由胞内向胞外分泌,这样就可以通过AHL诱导该质粒lacZ的表达,从而降解X-gal而使平板上的菌落周围产生蓝色圆圈。根瘤菌Rm1021自身可以产生AHL,故被用作正对照检测试验体系正确与否。如图4中所示,在根瘤菌(Rm1021周围产生蓝色菌圈,说明试验体系正确。BL21/pET19-pp-histag和BL21/pET19-AGPA周围并没有产生蓝色菌圈,而BL21/pET19-hdtS周围却产生明显的蓝色菌圈。由此可以证明hdtS蛋白确实具有AHL合成酶功能,而AGPA蛋白并不具有该功能。
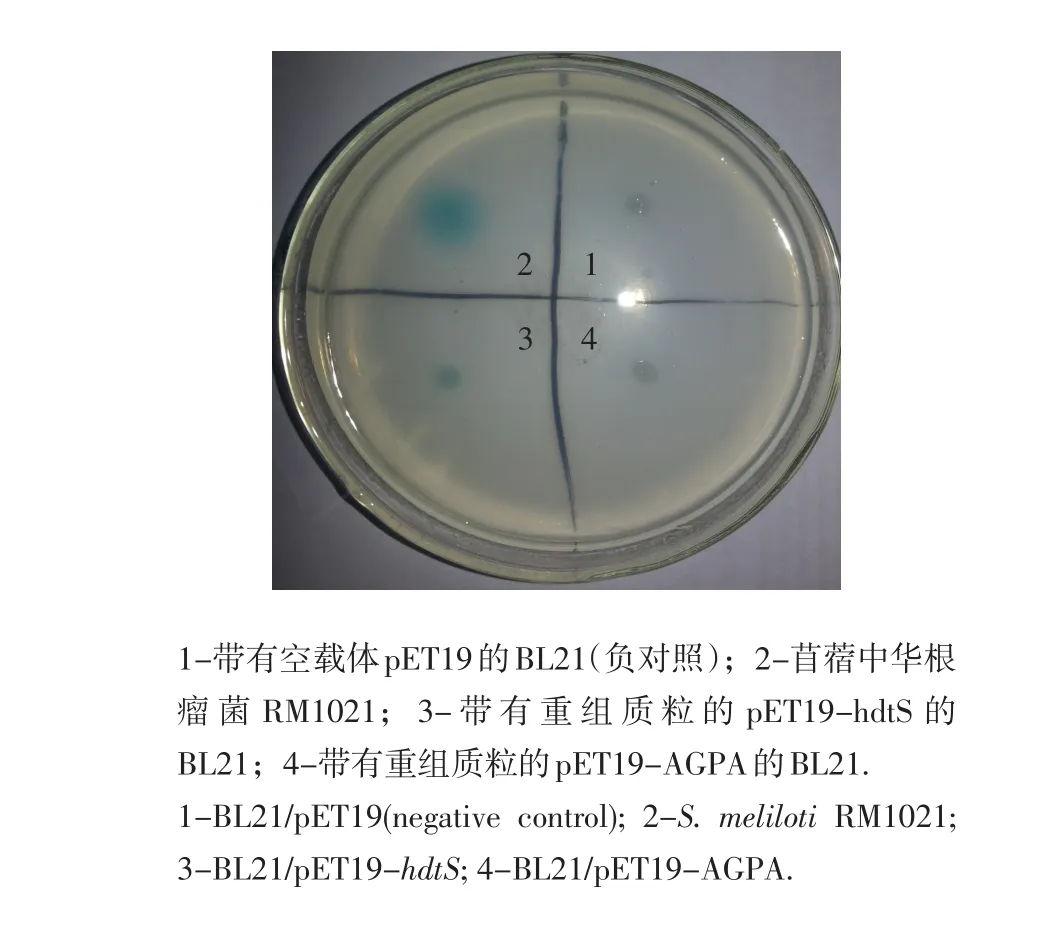
图4 平板菌株报告法检测AHL合成酶活性Fig.4 Identification of an AHL synthase using a reporter strain Agrobacterium tumefaciens NTL4
3 讨论与结论
至今为止,没有任何产甲酸草酸杆菌的QS系统有关基因报道。本研究首次克隆该菌hdtS类的QS系统基因并对基因功能进行鉴定。借助生物信息学方法,将已知的QS系统基因与产甲酸草酸杆菌的基因组进行比对,发现HOxBLS中存在一个编码推测的1-酰基-sn-甘油-3-磷酸转移酶的基因与hdtS基因高度同源,通过对该基因的克隆与功能分析,最终确定该基因是产甲酸草酸杆菌中hdtS类的QS系统基因。
目前普遍使用AHL检测方法是生物学方法,即平板菌株报告法[2-4]。本研究中,根癌农杆菌NTL4作为报告菌株,在一定浓度X-gal存在的平板上,能快速、且直观地检测到菌落周围是否显示蓝色,从而证明所克隆基因是否编码AHL[2-4]。通过验证,发现HdtS蛋白确实具有AHL合成酶功能。在对hdtS基因鉴定的过程中,发现AGPA与前者具有一定同源性,但通过功能分析,确定后者不具有AHL合成酶功能。
对细菌中AHL进行选择性定量检测方法为气谱-质谱联用(GC-MS)法。该方法可评估不同生长阶段AHL产生模式[6],对检测表达多种独立信号系统细菌培养物中的AHL在量上变化更为有效[7-8],可进一步研究确定其生物合成途径及AHL独特细胞交流功能[1-2,9],在对群体感应系统信号分子研究中应用广泛[1-2]。在平板菌株报告法结论基础上,后续研究将对BL21/pET19-hdtS细菌培养提取物进行GC-MS检测,进一步证明其具有AHL合成酶功能,确定HdtS具体合成AHL种类和不同生长阶段AHL变化动态。
[1]Waters C M,Bassler B L.Quorum sensing:Cell-to-cell communi⁃cation in bacteria[J].AnnuRev Cell Dev Biol,2005,21:319-346.
[2]Sturme,M H,Franke C,Siezen R J,et al.Making sense of quo⁃rum sensing in Lactobacilli:A special focus on Lactobacillus plan⁃tarum WCFS[J].Microbiology,2007,153:3939-3947.
[3]Mitsuma T,Odajima H,Momiyama Z,et al.Enhancement of gene expression by a peptide p(CHWPR)produced by Bifidobacterium lactis BB-12[J].Microbiol Immunol,2008,52:144-155.
[4]Hammer B K,Bassler B L.Quorum sensing controls biofilm for⁃mation in Vibrio cholerae[J].Mol Microbiol,2003,50:101-104.
[5]Bass ler B L,Wright M,Showalter R E,et al.Intercellular signal⁃ling in Vibrio harveyi:Sequence and function of genes regulat⁃ing expression of luminescence[J].Mol Microbiol,1993(9):773-786.
[6]Milton D L,Chalker V J,Kirke D,et al.The LuxM Homologue VanM from Vibrio anguillarum directs the synthesis of N-(3-Hy⁃droxyhexanoyl)homoserine Lactone and N-hexanoyl-homoser⁃ine Lactone[J].J Bacteriol,2001,183:3537-3547.
[7]Gilson L,Kuo A,Dunlap P V.AinS and a new family of autoin⁃ducer synthesis proteins[J].J Bacteriol,1995,177:6946-6951.
[8]Laue B E,Jiang Y,Chhabra S R,et al.The biocontrol strain Pseu⁃domonas fluorescens F113 produces the Rhizobium small bacterio⁃cin,N-(3-hydroxy-7-cis-tetradecenoyl)homoserine lactone,via HdtS,a putative novel N-acylhomoserine lactone synthase[J].Mi⁃crobiology,2000,146:2469-2480.
[9]Rivas M,Seeger M,Jedlicki E,et al.Second acyl homoserine lac⁃tone production system in the extreme acidophile Acidithiobacil⁃lus ferrooxidans[J].Appl Environ Microbiol,2007,73:3225-3231.
[10]Mittal R D,Kumar R,Mittal B,et al.Stone composition,metabol⁃ic profile and the presence of the gut-inhabiting bacterium Oxalo⁃bacter formigenes as risk factors for renal stone formation[J].Med Princ Pract,2003(12):208-213.
[11]Mikami K,Akakura K,Takel K,et al.Association of absence of intestinal oxalate degrading bacteria with urinary calcium oxalate stone formation[J].Int J Urol,2003,10:293-296.
[12]Troxel S A,Sidhu H,Kaul P,et al.Intestinal Oxalobacter formi⁃genes colonization in calcium oxalate stone formers and its rela⁃tion to urinary oxalate[J].J Endourol,2003,17:173-176.
[13]Kwak C,Jeong B C,Kim H K,et al.Molecular epidemiology of fe⁃cal Oxalobacter formigenes in healthy adults living in Seoul,Ko⁃rea[J].J Endourol,2003,17:239-243.
[14]Kaufman D W,Kelly J P,Curhan G C,et al.Oxalobacter formi⁃genes may reduce the risk of calcium oxalate kidney stones[J].J Am Soc Nephrol,2008,19:1197-1203.
[15]Kharlamb V,Schelker J,Francois F,et al.Oral antibiotic treat⁃ment of Helicobacter pylori leads to persistently reduced intestinal colonization rates with Oxalobacter formigenes[J].J Endourol, 2011,25:1781-1785.
Cloning and identification ofhdtSgene fromOxalobacter formigenes encoding an acylhomoserine lactone synthase of quorum-sensingsystem/
JIANG Juquan,LIU Henan,XIAO Hongyu,FU Xiaowei,ZHU Guangyu(School of Life Sciences,NortheastAgricultural University,Harbin 150030,China)
To identify the quorum-sensing system(QS)genes inOxalobacter formigenes,QS-related genes fromVibrio fischeriandPseudomonas fluorenceswere aligned with the genome sequence ofO. formigenes.The geneshdtSandAGPAwere chosen as the candidate QS-related genes,cloned by PCR into the vector pEASY-T3,and constructed into pET19-pp-histag.The resulting expression vectors designated pET19-hdtS and pET19-AGPA were transformed intoEscherichia coliBL21(DE3),respectively, followed by the induction by IPTG.SDS-PAGE showed that the genes hdtS and AGPA were over-expressed inE.coliBL21(DE3).ThehdtSgene,butAGPAnot,was finally established to encode an acylhomoserine lactone(AHL)synthaseviaan AHL reporter strain,Agrobacterium tumefaciensNTIA(pZLR4)through the double-agar diffusion method.To the best of our knowledge,this is the first report on the cloning andidentification of the QS-realted gene fromO.formigenes,which is very helpful for better understanding of the quorum sensing system ofO.formigenesand analysis of impact factors of its colonization in human intestines.
cloning;identification;Oxalobacter formigenes;quorum-sensing system;hdtS;AGPA
Q933;Q751
A
1005-9369(2014)06-0049-08
时间 2014-6-11 16:17:57 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1617.017.html
姜巨全,刘贺男,肖鸿禹,等.产甲酸草酸杆菌细胞数群体感应系统基因hdtS克隆和功能分析[J].东北农业大学学报,2014,45 (6):49-56.
Jiang Juquan,Liu Henan,Xiao Hongyu,et al.Cloning and identification ofhdtSgene fromOxalobacter formigenesencoding an acylhomoserine lactone synthase of quorum-sensing system[J].Journal of Northeast Agricultural University,2014,45 (6):49-56.(in Chinese with English abstract)
2014-04-02
黑龙江省自然科学基金留学项目(LC201025);教育部留学回国人员基金项目(2012940);哈尔滨市科技创新人才项目(2012RFLXN004)
姜巨全(1977-),男,教授,博士,博士生导师,研究方向为分子微生物学与生物技术制药。E-mail:jjqdainty@163.com.
