伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位对佐剂性关节炎大鼠的治疗作用
2014-01-13付雪艳郝文婧康小兰张新慧
付雪艳, 郝文婧, 康小兰, 董 琳, 张 妍, 张新慧
(宁夏医科大学 宁夏回药现代化工程技术研究中心,宁夏 银川750004)
铁棒锤是毛茛科乌头属植物伏毛铁棒锤Aconitum flavum Hand. -Mazz. 的干燥块根[1],其性热,味辛苦,有大毒,具有祛风除湿、活血祛瘀等药理活性,主要用于类风湿性关节炎、关节痛、跌打瘀痛等疾病的治疗,是我国西北地区(陕、甘、宁、藏)民间治疗类风湿性关节炎的常用药[2]。
类风湿性关节炎(RA)是一种以累及周围关节为主的多系统性自身免疫性疾病,具有发病广、病程长、致残率高、不易治愈等特点,RA 的发病机制与细胞因子的量息息相关,其中,IL-1β、IL-6 和TNF-α 水平的升高,IL-2 水平的下降是RA 发病的重要因素。本课题组前期对铁棒锤流浸膏治疗类风湿性关节炎进行了研究,并对流浸膏大孔吸附树脂30%乙醇洗脱部位进行抗炎镇痛研究,发现铁棒锤流浸膏对类风湿性关节炎有一定的治疗作用,大孔吸附树脂30%乙醇洗脱部位有较强的抗炎镇痛作用[3-4]。本研究在此基础上,选用免疫性炎症模型佐剂性关节炎(AA)模型作为实验的动物模型[5-6],进一步研究伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位对类风湿性关节炎的治疗作用并在细胞因子水平探讨其作用机制,为更深入的明确伏毛铁棒锤的物质基础及作用机制提供依据。
1 实验材料
1.1 药品与试剂 伏毛铁棒锤采购于宁夏明德中药饮片有限公司,经宁夏医科大学生药学教研室鉴定为伏毛铁棒锤Acontium flavum Hand. -Mazz 的干燥块根;通过大孔吸附树脂分离富集得到伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位;雷公藤多苷片 (江苏美通制药有限公司,批号232021007);完全弗氏佐剂 (美国Sigma 公司,批号F5881-10 mL);羧甲基纤维素钠(天津试剂有限公司);大鼠TNF-α 试剂盒、大鼠IL-1β、IL-2、IL-6 试剂盒均购自欣博盛生物科技有限公司。
1.2 实验动物 清洁级Sprague-Dawicy(SD)大鼠48 只,雄性,体质量(180 ±20)g,动物许可证号:SYXY(宁)2006-0001,由宁夏医科大学实验动物中心提供。所有大鼠适应性喂养1 周。分笼饲养,室温(22 ±2)℃,相对湿度45% ~50%,通风良好,自然光照的条件下饲养,自由摄食、饮水。
1.3 伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位的制备将伏毛铁棒锤块根洗净、晾干、粉碎,共得粗粉3 kg,用70%分析乙醇微波回流提取(料液比为1 ∶8,g/mL),过滤,滤液合并回收后,减压浓缩,得到0.3 kg 粗提浸膏。将0.3 kg 粗提浸膏,用蒸馏水制成混悬液后,加入装有已处理好的D101 大孔吸附树脂层析柱中,以2 BV/h 的体积流量吸附有效部位,然后用去离子纯化水洗脱,至颜色变浅直到无色为止;再用30%乙醇洗脱,至颜色变浅直到无色为止,收集30%乙醇洗脱液,减压浓缩洗脱液,即得30%醇部位棕黄色流浸膏12 g,将浸膏用0.5%羧甲基纤维素钠(CMC-Na)水溶液溶解。伏毛铁棒锤30%醇部位(高、中、低组),以0.5%的CMC-Na 水溶液配成6、3、1.5 mg/kg 的溶液。
2 实验方法
2.1 大鼠模型的建立及给药 AA 大鼠模型制备[7-8]:临用前从冰箱取出弗氏完全佐剂(CFA),充分振荡、混匀。大鼠的右后肢用75%乙醇消毒后将其拉直,用l mL 注射器针头于足跖皮内注射,每只大鼠注射0.1 mL CFA 致炎,正常对照组注射0.1 mL PBS。将SD 雄性大鼠48 只随机分为6 组,每组8 只,分别设为空白对照组(0.5%的CMC-Na水溶液),模型对照组(0.5%的CMC-Na 水溶液),阳性药对照组(雷公藤多苷片0.945 mg/mL)。造模后第8 天开始灌胃给药(给药体积,1.0 mL/100 g),每日1 次。30%醇部位高、中、低组以30% 醇部位溶液 (60、30、15 mg/kg)灌服;阳性药对照组以雷公藤多苷片混悬液(9.45 mg/kg)灌服;空白对照组、模型对照组以0.5%的CMC-Na 水溶液灌服。连续灌胃给药21 d,于末次给药2 h后对大鼠进行相应处理。
2.2 观察项目与方法
2.2.1 AA 大鼠继发性踝关节肿胀度测定 大鼠分别于致炎前1 天以及致炎后第1、8、14、21 和29 天,分别在足容积测量仪上测定致炎侧足容积,求出关节肿胀度 (△mL=致炎后容积-致炎前容积)以观察AA 大鼠继发性炎症病变。
2.2.2 AA 大鼠多发性关节炎指数的测定 致炎后第7 天开始,每隔4 d 对大鼠四肢关节炎进行一次观察评分,累计为关节炎指数(Arthritis Index,AI),全身病变按5 级评分法评价,根据未注射佐剂的其余3 只肢体的病变程度累计积分,计算出AI。0 分,无红肿;1 分,发红或小趾关节红肿;2 分,中度肿胀,即趾关节和足跖肿胀;3 分,踩关节以下的足爪肿胀;4 分,包括踝关节在内的全部足爪肿胀。把各个关节的积分累计起来,即为每只大鼠的AI。
2.2.3 组织形态学观察[9-10]10%甲醛溶液中固定48 h 的踝关节标本,脱钙处理,即用5%硝酸溶液脱钙,每天更换脱钙液,用针刺入标本无阻力感停止脱钙。脱钙后标本用自来水流水冲洗多余的固定液,过夜。在室温下梯度乙醇脱水,二甲苯透明后,石蜡包埋,常规切片,将组织附于处理过的载玻片上,60 ℃恒温烘箱烤片12 h,用于苏木素-伊红(HE)染色。HE 染色法:石蜡切片常规脱蜡至水;苏木素染色10 min,将细胞核染成蓝色;0.5%盐酸乙醇(70%乙醇)分色;0.5%氨水返蓝;用自来水冲洗1 ~2 h;伊红染色3 min,细胞质染成红色;用90%乙醇分色处理,镜下控制。70%乙醇,80%乙醇各2 次;常规脱水、透明;用中性树胶封片,显微镜观察结果,细胞核呈蓝色,细胞浆呈红色;照相。
2.2.4 血清细胞因子检测 实验第29 天末次给药后2 h,收集标本,心脏穿刺取血,摇匀后在4 ℃,3 000 r/min 离心5 min,取上清液测定。采用ELISA 法测定血清TNF-α、IL-1β、IL-2、IL-6 水平。严格按照ELISA 试剂盒说明书操作。
2.2.5 数据处理 统计学处理:用SPSS 17.0 软件进行单因素方差分析(One-Way ANOVA),各组数据以均数±标准差(±s),检验差异显著性,以α =0.05 为检验水准,以P <0.05 为有统计学意义。
3 结果
3.1 对AA 模型大鼠右后足肿胀度变化的影响 致炎8 d后模型组及各给药组大鼠的关节肿胀度明显与正常对照组比较均有显著性差异(P <0.05),表明造模成功。给药后第15 天,与模型组比,30%醇高、中、低剂量组均可降低AA 大鼠的关节肿胀度。给药第29 天,与模型组比,30%醇高、中、低剂量组均可显著降低AA 大鼠的关节肿胀度,具有显著性差异(P <0.05)。结果见表1。
表1 各组AA 大鼠右后足肿胀度的比较(±s,n=8)
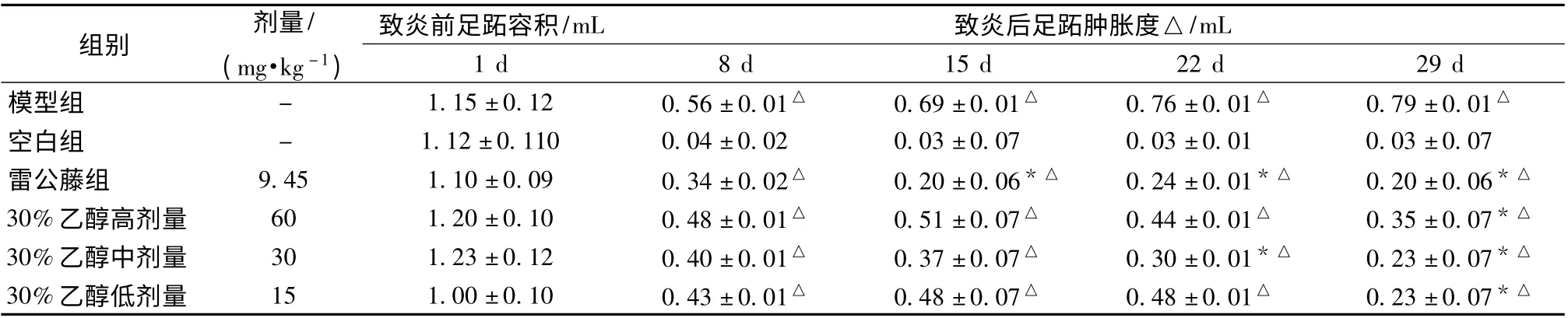
表1 各组AA 大鼠右后足肿胀度的比较(±s,n=8)
注:与模型组比较,* P <0.05;与空白组比较,△P <0.05
组别 剂量/(mg·kg -1)致炎前足跖容积/mL 致炎后足跖肿胀度△/mL 1 d 8 d 15 d 22 d 29 d模型组 - 1.15 ±0.12 0.56 ±0.01△ 0.69 ±0.01△ 0.76 ±0.01△ 0.79 ±0.01△空白组 - 1.12 ±0.110 0.04 ±0.02 0.03 ±0.07 0.03 ±0.01 0.03 ±0.07雷公藤组 9.45 1.10 ±0.09 0.34 ±0.02△ 0.20 ±0.06*△ 0.24 ±0.01*△ 0.20 ±0.06*△30%乙醇高剂量 60 1.20 ±0.10 0.48 ±0.01△ 0.51 ±0.07△ 0.44 ±0.01△ 0.35 ±0.07*△30%乙醇中剂量 30 1.23 ±0.12 0.40 ±0.01△ 0.37 ±0.07△ 0.30 ±0.01*△ 0.23 ±0.07*△30%乙醇低剂量 15 1.00 ±0.10 0.43 ±0.01△ 0.48 ±0.07△ 0.48 ±0.01△ 0.23 ±0.07*△
3.2 对AA 大鼠关节炎指数的影响 致炎后,正常组大鼠,动作敏捷,关节无红肿;模型组大鼠,动作缓慢,非致炎足爪关节明显肿胀,表明造模成功。造模第14 天,非致炎足爪关节发生红肿,关节炎指数随时间推移而逐渐增高,第21 天达最高。给药第14 天,30%醇高、中、低剂量组均能使大鼠关节的肿胀程度明显减轻,明显低于模型组的指数(P <0.01);给药第21 天,各组大鼠关节的肿胀程度均减轻,明显低于模型组的指数(P <0.01),提示伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位对AA 大鼠的关节炎有一定的抑制作用,如表2 所示。
3.3 HE 染色结果 对AA 大鼠的膝关节软骨进行HE 染色发现正常大鼠的软骨组织滑膜衬里层由1-2 层滑膜细胞组成,表面光滑,未见炎细胞浸润。AA 大鼠模型组的膝关节滑膜组织明显增生,关节间隙变窄,部分关节软骨破坏,滑膜里层细胞逐渐增加至10 层,细胞肿胀,部分空泡变性,可见滑膜囊内有大量炎细胞浸润,如单核细胞、淋巴细胞和中性粒细胞,观察到乳头状突出。大孔吸附树脂30%乙醇洗脱部位治疗组可使AA 大鼠致炎侧膝关节的组织水肿与炎细胞浸润明显减轻,滑膜细胞少量增生,关节间隙轻度狭窄,症状明显轻于AA 大鼠模型组。提示伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位治疗组可使AA 大鼠关节炎症有明显的改善作用。见图1。
表2 不同药物对AA 大鼠关节炎指数的影响(±s,n=8)

表2 不同药物对AA 大鼠关节炎指数的影响(±s,n=8)
注:与模型组比较,**P <0.01
组别 剂量/(mg·kg -1) 关节炎指数8 d 14 d 21 d 28 d模型组2.50 ±0.53 5.88 ±0.64 7.38 ±0.74 6.88 ±0.64雷公藤组 9.45 2.13 ±0.64 3.63 ±0.52** 4.63 ±0.74** 3.88 ±0.83**30%乙醇高剂量组 60 2.25 ±0.46 4.00 ±0.76** 5.38 ±0.92** 4.50 ±0.93**30%乙醇中剂量组 30 2.13 ±0.64 3.88 ±0.64** 5.00 ±0.53** 4.13 ±0.83**30%乙醇低剂量组 15 2.25 ±0.46 4.63 ±0.92** 5.63 ±1.19** 4.50 ±1.20-**

图1 佐剂性关节炎大鼠HE 染色
3.4 对各组大鼠血清中IL-1β、TNF-α、IL-2、IL-6 水平的影响 与正常对照组大鼠相比,其他各组大鼠在急性关节炎造模之后细胞因子IL-1β 水平显著上升(P <0.05),模型组大鼠升高程度与正常组大鼠具显著差异(P <0.05),30%低剂量组AA 大鼠血清TNF-α 水平明显低于正常对照组(P <0.05),可显著降低AA 大鼠血清中产生过高的TNF-α;与空白对照组大鼠相比,其他各组大鼠在急性关节炎造模之后细胞因子IL-2 水平显著降低(P <0.05),与模型组大鼠相比,其他各组大鼠在药物治疗之后细胞因子IL-2均有上升,伏毛铁棒锤有效部位30% 部位中剂量组(30 mg/kg)能够使AA 大鼠过低的IL-2 水平恢复最好;与空白对照组大鼠相比,除伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位中剂量组(30 mg/kg),其他各组大鼠在急性关节炎造模之后细胞因子IL-6 水平显著上升(P <0.05);与模型组大鼠相比,其他各组大鼠在药物治疗之后细胞因子IL-6 均有下降,其中阳性药物组、伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位中、高剂量组(30、60 mg/kg)均能够使AA 大鼠过高的IL-6 水平恢复,具有统计学意义(P <0.05)。实验结果见表3。
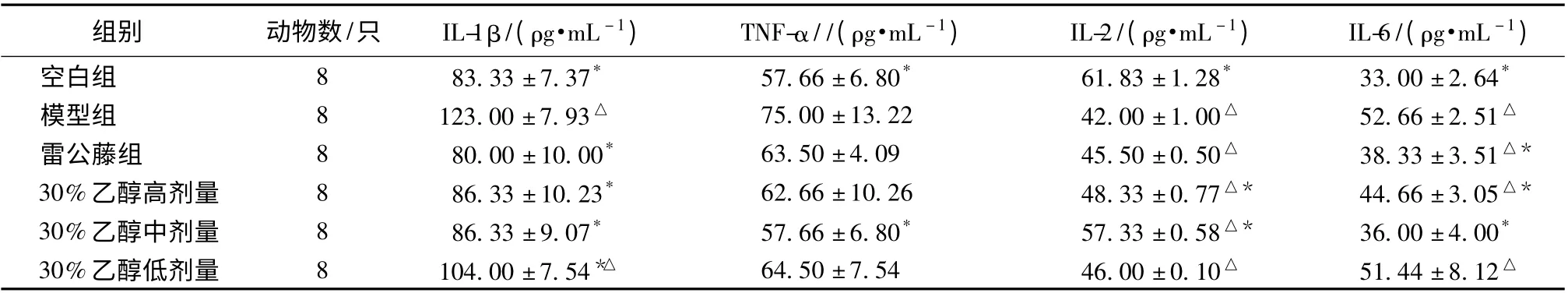
表3 各组大鼠IL-1β、TNF-α、IL-6 水平测定
4 讨论
RA 是一种以累及周围关节为主的多系统性自身免疫性疾病,其主要的发病机制是免疫功能的异常所致,T 淋巴细胞和单核巨噬细胞共同参与了RA 的发展。这些细胞因子的局部定位能解释RA 的许多病变和临床表现[11-12]。IL-1β 和TNF-α 是重要的炎症介质,多数情况下表现为协同生物学效应,能促进骨髓释放中性粒细胞,诱导单核细胞和多核粒细胞趋化浸润到炎症局部,是RA 滑膜炎症级联反应的中心和始动环节。本实验表明伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位高、中剂量组可以明显抑制佐剂性关节炎大鼠的TNF-α、IL-1β 水平,其机制有可能是伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位抑制了抗原提呈细胞对T 细胞的激活,来调节免疫反应,改善其免疫功能。
RA 骨的丢失与骨髓中IL-6 水平高度相关,它可促进B细胞合成抗体,刺激T 细胞增殖[13-14]。IL-2 是保障机体正常免疫功能的关键环节,在机体的免疫应答中起着重要的作用,具有诱导T 淋巴细胞增殖和分化的作用[15]。本实验结果表明,伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位能够使AA 大鼠过低的IL-2 水平恢复,使过高的IL-6 水平下降,使紊乱的体液免疫状态得到恢复,起到免疫调节作用。
总之,30%乙醇高、中、低剂量组均可降低AA 大鼠的关节肿胀度及关节炎指数,不仅如此,HE 染色表明,铁棒锤大孔吸附树脂30%乙醇洗脱部位治疗组可使AA 大鼠致炎侧膝关节的组织水肿与炎细胞浸润明显减轻,滑膜细胞少量增生,症状明显轻于AA 大鼠模型组。其机制可能通过增强抑制IL-1β 和TNF-α 在大鼠体内的分泌,阻碍致炎因子IL-6的释放,以及使IL-2 水平的恢复,来调控大鼠体内的各种炎症因子的平衡,表明伏毛铁棒锤大孔吸附树脂30%乙醇洗脱部位对RA 起到一定的治疗作用,此实验为更深入地明确伏毛铁棒锤的物质基础及作用机制提供依据。
[1] 罗达尚. 中华藏本草[M]. 北京:民族出版社,1997:62-63.
[2] 阎文玫,陈德昌,高艳珍,等. 伏毛铁棒锤的研究[J].中草药,1983,14(9):32-36.
[3] 张义伟,董 琳,马学琴,等. 铁棒锤浸膏对大鼠佐剂性关节炎治疗作用的研究[J]. 宁夏医科大学学报,2009,31(1):9-10.
[4] 付雪艳,康小兰,张百通,等. 伏毛铁棒锤活性部位化学成分及抗炎镇痛作用研究[J]. 中药材,2013,4(2):71-73.
[5] Pearson C M. Development of arthritis,periarthritis and periostitis in rats given adjuvants[J]. Exper Biol Med,1956:91(1):95-101.
[6] 张钧田. 现代药理实验方法[M]. 北京:北京医科大学中国协和医科大学联合出版社,1998:1383.
[7] 胡成穆,金 涌,姚宏伟,等. 美洛昔康凝胶剂对佐剂性关节炎大鼠的治疗作用[J]. 安徽医科大学学报,2002,37(2):27-29.
[8] Kay J,Calabrese L. The role of interleukin-l in the pathogenesis of rheumatoid arthritis[J]. Rheumatology (Oxford),2004,43(3):112-119.
[9] 徐叔云. 药理实验方法学[M]. 2 版. 北京:人民卫生出版社,1999:723-724.
[10] Feldmann M,Brennan F M,Maini R N. Role of cytokines in rheumatoid arthritis[J]. Annu Revlmmunol,1996,14:397-440
[11] Cush J,Lipsky P. The immune pathos genesis of rheumatoid arthritis:the role of cytokines in chronic inflammation[J]. Clin Aspects Autoimmune,1987,1(4):2-13.
[12] Firestein G,Tsai V,Zvaifler N. Cellular immunity in the joints of patients with rheumatoid arthritis and other forms of chronic sonorities[J]. Rheum Dis Clin North Am,1987,13(2):191.
[13] Hong J,Pettit A,Ohmura K,et al. Critical roles for interleuk in 1 and tumor necrosis factor alpha in antibody-induced arthritis[J]. J Exp Med,2002,196(1):77-85.
[14] Houssiau F A,Pevogelaer J P. Interleulin-6 in synovial fluid and serum of patient with rheumatoid arthritis and anther inflammatory authorities[J]. Arthretis Rheum,1988,31 (6):784-788.
[15] Baumann H,Kushner I. production of interleulin-6 by synovial fibroblasts in rheumatoid arthritis[J]. Am J Pathology,1998,152(3):641-644.
