iScore、PLAN和ASTRAL评分对急性缺血性卒中患者不良结局风险预测价值探讨
2014-01-11金迪陈忠云李婧李珊珊徐志伟杜继臣杨旭
金迪,陈忠云,李婧,李珊珊,徐志伟,杜继臣,杨旭
iScore、PLAN和ASTRAL评分对急性缺血性卒中患者不良结局风险预测价值探讨
金迪,陈忠云,李婧,李珊珊,徐志伟,杜继臣,杨旭
目的:探讨国外iScore、PLAN和ASTRAL评分对我国急性缺血性卒中(AIS)患者3个月的不良结局预测价值。方法:前瞻性收集2012年12月至2013年8月在我科住院的AIS患者221例,记录有关基线资料,并使用3个量表进行评分。以卒中后3个月出现死亡或功能残障(改良Rankin评分≥3分)作为不良预后事件。通过受试者工作特征曲线下面积(AUC)比较3个量表的预测价值;使用法判断模型的拟合优度;应用相关分析评估实际与预期结局事件的关联程度。结果:在AIS后3个月,71例(32.1%)出现不良预后。iScore、PLAN和 ASTRAL评分的 AUC分别为 0.816、0.830和 0.841;法x2值分别为1.676、5.976和12.858(均>0.05);相关系数分别为0.899、0.857和0.939(均<0.05)。结论:iScore、PLAN和ASTRAL量表对AIS患者3个月发生不良事件的风险预测能力强,与预期结局事件关联程度高。
缺血性卒中;预后;量表;受试者工作特征曲线
急性缺血性卒中(acute ischemic stroke,AIS)致死率、致残率高[1],给患者及其家庭带来沉重的生活障碍和经济负担。研究表明,AIS患者的预后与年龄、卒中机制、卒中严重程度等诸多因素有关[2,3]。若能够早期判断AIS患者的预后,积极干预,可有效降低不良预后的风险。国外 iScore、PLAN和ASTRAL评分是最近2年研发的AIS预后量表,对死亡风险的预测效能良好,但对不良功能结局的预测价值研究尚少[4-6]。而且,由于种族差异,这些量表在中国人群的适用价值仍需进一步验证[7]。基于此,本研究通过受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC),探讨iScore、PLAN和ASTRAL评分在我国AIS患者3个月时不良结局的预测价值。
1 资料与方法
1.1 一般资料
连续收集2012年12月1日至2013年8月31日在我科住院治疗的AIS患者,均签署知情同意书。纳入标准:①年龄≥18岁;②第一诊断为AIS;③头颅CT/MRI证实为AIS;④有与梗死灶对应的新发症状;⑤起病到入院时间<14 d。排除短暂性缺血发作、出血性卒中患者。剔除基线信息不完整和失访的患者。本研究已通过伦理委员会的审批。
1.2 方法
1.2.1 数据录入 通过纸质版病例报告表登记患者的临床资料,包括年龄、性别、美国国立卫生院卒中量表(NIH stroke scale,NIHSS)得分、卒中病因分型、危险因素及基础疾病等。信息来源于问询患者和病历记录。使用Epidata 3.1软件建立电子数据库。参与病例收集和录入的人员均经过培训。
1.2.2 量表评分 所有患者采用iScore、PLAN和ASTRAL评分进行评估,见表1。变量选择、数据来源和概念定义等参考文献[4-6]。由于iScore评分使用加拿大神经科量表(Canada neural scale,CNS)判断卒中的严重程度,因此在统计数据时将NIHSS评分转变为CNS评分,NIHSS≤8分对应CNS≥8分,NIHSS 9~13分对应CNS 5~7分,NIHSS 14~22分对应CNS 1~4分,NIHSS>22分对应CNS 0分[5]。根据TOAST分型对每位患者进行病因分型[8]。
1.3 结局事件与随访
从入组时间开始计算,3个月后对患者进行随访,时间误差≤7 d。由受过培训的研究者通过电话或当面问询对患者进行预后评价。主要结局事件定义为AIS患者3个月时出现不良预后。不良预后定义为:①死亡,且AIS为死亡的直接或间接原因;②中重度残疾,生活不能完全自理,即改良 Rankin量表(modified Rankin scale,mRS)≥3分。根据患者的mRS评分将其分为预后良好组与预后不良组。

表1 iScore、PLAN和ASTRAL量表的评分项目及分值
1.4 统计学处理
2 结果
2.1 基线资料
合计AIS患者249例于我科住院,其中有22例(8.8%)因未进行头颅影像学检查、合并其它严重疾病、缺乏关键基线特征等原因被剔除;失访6例(2.6%)。最终纳入患者221例,在3个月随访时出现不良预后71例(32.1%)为预后不良组,其中死亡9例(4.1%),预后良好组150例。221例患者中,男164例(66.1%);年龄(66.3± 12.2)岁;入院前不能自理22例(9.9%);到院时间>3 h 208例(94.1%);中位NIHSS评分为3分(1~6分),<9分180例(81.4%),9~13分24例(10.9%),14~22分8例(3.6%),>22分9例(4.1%);主要临床症状为上肢力弱明显42例(19.0%),下肢力弱明显37例(16.7%),忽视或失语41例(18.6%),视野缺损14例(6.3%);意识水平为清醒202例(91.4%),嗜睡或昏睡12例(5.4%),昏迷7例(3.2%);卒中亚型为腔梗25例(11.3%),非腔梗142例(64.3%),病因不明54例(24.4%);危险因素为房颤30例(13.6%),充血性心衰2例(0.9%);合并癌症6例(2.7%),合并肾透析 0例;血糖≥7.5 mmol/L 96例(43.4%),<3.7 mmol/L或>7.3 mmol/L 101例(45.7%)。①预后良好组,男106例(70.6%);年龄(64.0±12.1)岁;入院前不能自理4例(2.7%);到院时间>3 h 144例(96.0%);中位NIHSS评分为2分(1~4分),<9分141例(94.0%),9~13分8例(5.3%),14~22分 0例,>22分 1例(0.7%);主要临床症状为上肢力弱明显8例(5.3%),下肢力弱明显5例(3.3%),忽视或失语19例(12.7%),视野缺损6例(4.0%);意识水平为清醒147例(98.0%),嗜睡或昏睡 2例(1.3%),昏迷 1例(0.7%);卒中亚型为腔梗22例(14.7%),非腔梗92例(61.3%),病因不明26例(24.0%);危险因素为房颤13例(8.6%),充血性心衰0例;合并癌症1例(0.7%),合并肾透析0例;血糖≥7.5 mmol/L 62例(41.3%),<3.7 mmol/L或>7.3 mmol/L 67例(44.7%);②预后不良组,男40例(56.3%);年龄(71.2±10.8)岁;入院前不能自理18例(25.3%);到院时间>3 h 64例(90.1%);中位NIHSS评分为6分(3~13分),<9分39例(54.9%),9~13分16例(22.5%),14~22分8例(11.3%),>22分8例(11.3%);主要临床症状为上肢力弱明显34例(47.9%),下肢力弱明显32例(45.1%),忽视或失语22例(30.9%),视野缺损8例(11.3%);意识水平为清醒55例(77.5%),嗜睡或昏睡10例(14.9%),昏迷6例(7.6%);卒中亚型为腔梗 3例(4.2%),非腔梗50例(70.4%),病因不明18例(25.4%);危险因素为房颤17例(23.9%),充血性心衰2例(2.8%);合并癌症5例(7.0%),合并肾透析0例;血糖≥7.5 mmol/L 34例(47.9%),<3.7 mmol/L或>7.3 mmol/L 34例(47.9%)。与预后良好组相比,预后不良组的年龄,男性比例,入院前不能自理比例,中位NIHSS评分及NIHSS评分<9分、9~13分、14~22分、>22分比例,上、下肢力弱明显比例,意识水平比例有显著性差异(<0.01);腔梗、房颤、合并癌症比例差异有统计学意义(<0.05)。
2.2 量表评分
3个量表评分均不服从正态分布。全部患者iScore、PLAN和ASTRAL评分的中位得分及四分位数分别为117(99~133)、7(5.5~8.8)和19(16~23)。根据预后对患者进行分层,预后不良组的中位得分为 140(121~178)、10(7~13)和24(21~31),预后良好组的中位得分为112(95~125)、6(5~7)和17(15~20),前者中位得分高于后者,有显著性差异(均<0.01),见图1~3。
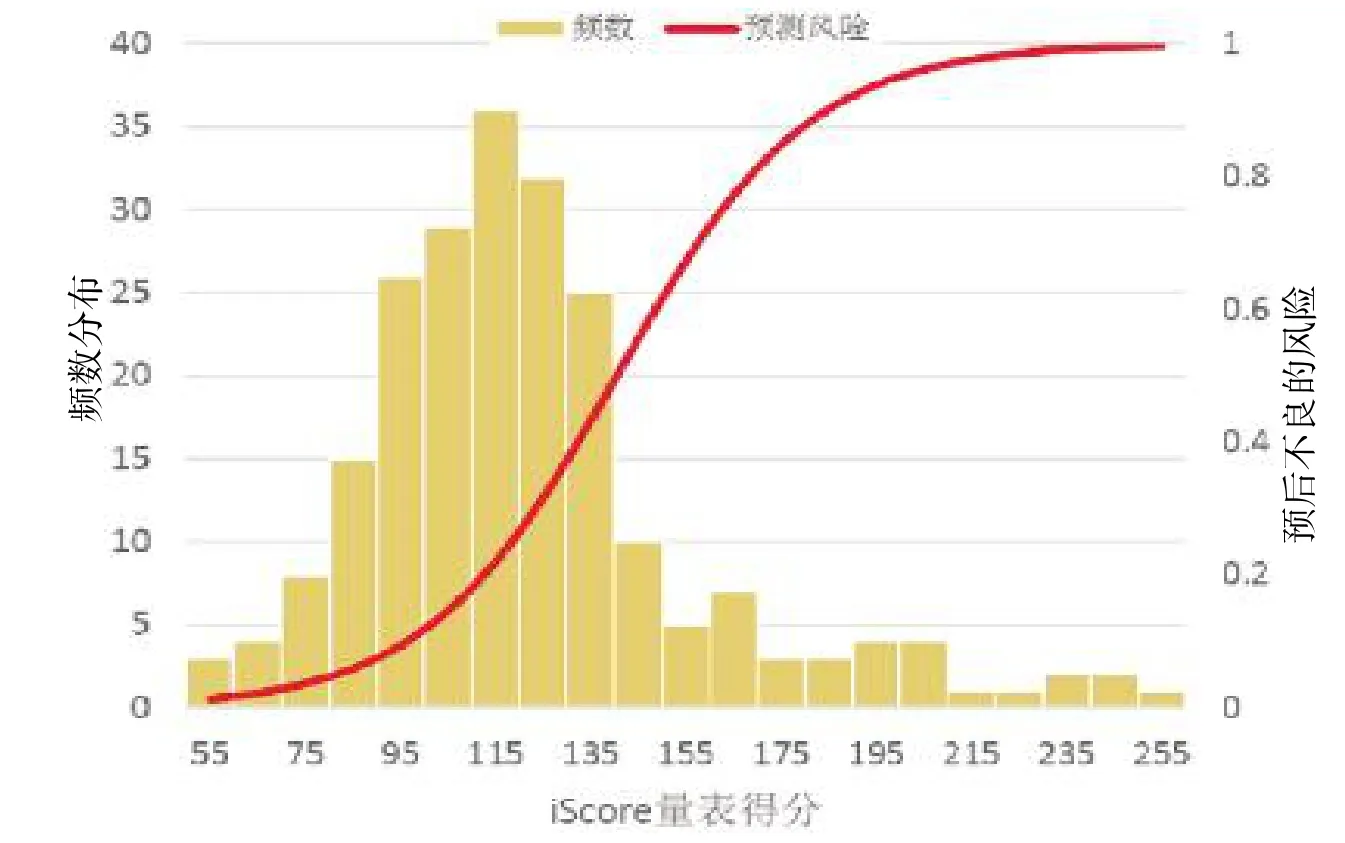
图1 iScore量表分值与不良预后风险的关系
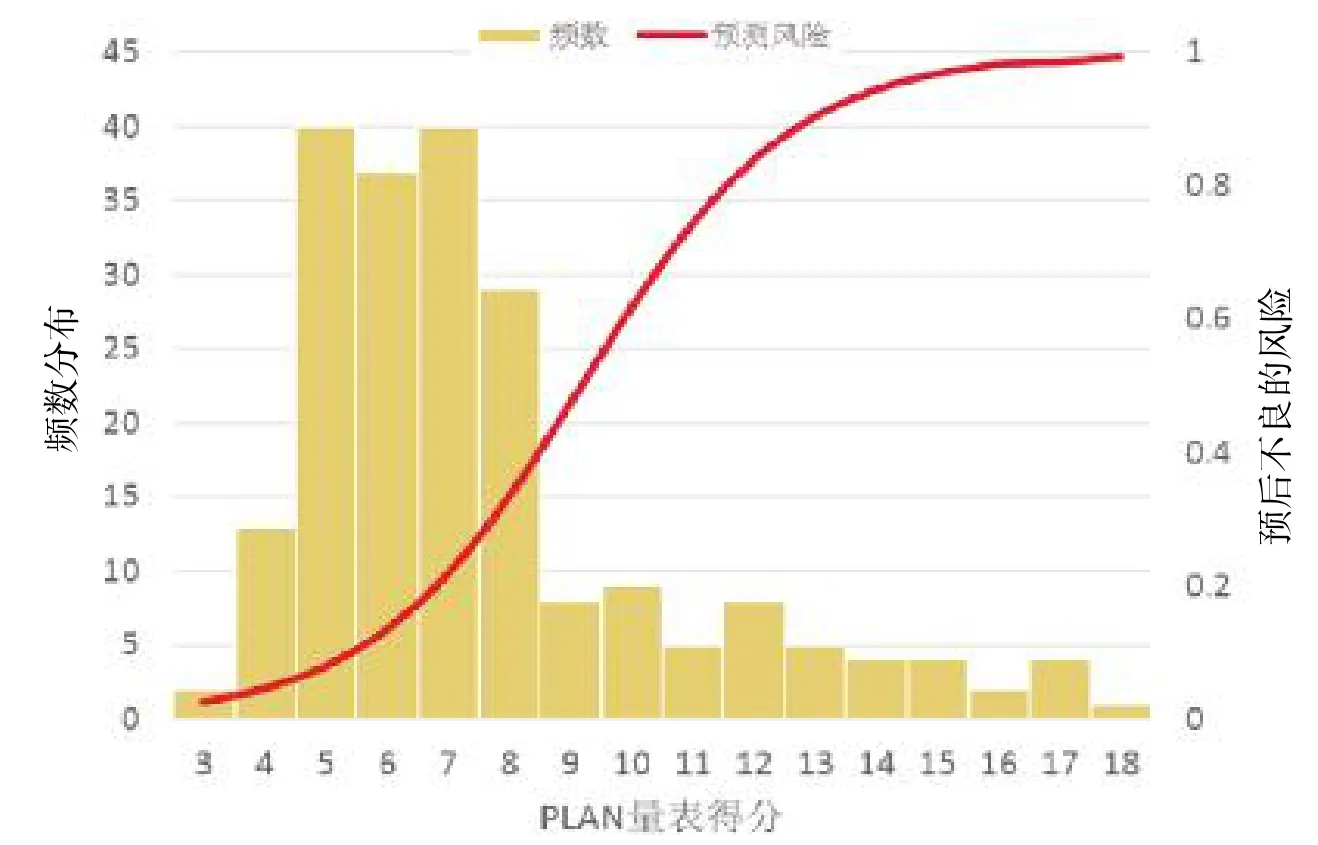
图2 PLAN量表分值与不良预后风险的关系

图3 ASTRAL量表分值与不良预后风险的关系
2.3 辨识能力和预测准确度
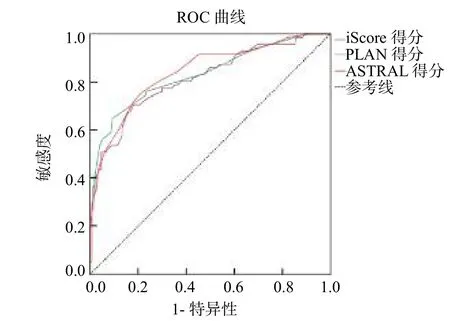
图4 预测不良结局的ROC曲线

图5 预测死亡事件的ROC曲线
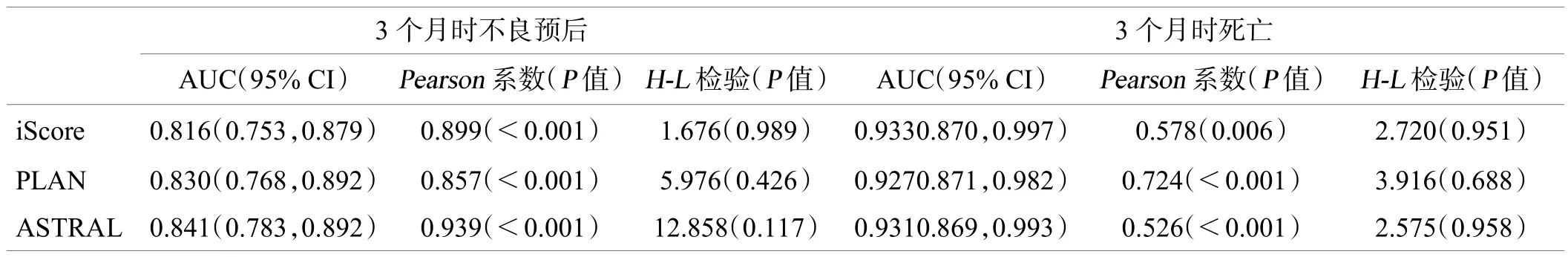
表2 iScore、PLAN和ASTRAL评分的辨识能力和预测准确度
预测 3个月不良预后时,iScore、PLAN和ASTRAL评分的AUC值分别为0.816、0.830和0.841,3个量表之间差异 无 统 计 学 意 义(>0.05);法x2值分别为1.676、 5.976和12.858(均>0.05);进一步应用相关分析,相关系数分别为0.899、0.857和0.939(均<0.05),见图4、图5、表2。PLAN评分原用于预测死亡和重度残疾风险,本研究也尝试以mRS评分≥ 5分(n=20,9.0%)作为结局事件进行分析,其AUC值为0.954[95%CI为(0.925,0.983)],此时iScore和ASTRAL评分的AUC值分别是0.954[95%CI为(0.919,0.989)]和 0.956 [95%CI为(0.923,0.989)]。另外,由于ASTRAL评分要求患者的入院前mRS评分<3分,故剔除这部分患者(n=23,10.4%)后,ASTRAL评分的AUC为0.803[95%CI为(0.731,0.874)]。
3 讨论
近年来,许多学者尝试制定卒中结局预测量表,但往往存在预测能力低、无外部验证等缺陷[9-13]。iScore、PLAN和 ASTRAL评分是最新发布的卒中预后量表,主要用于预测AIS后的死亡风险,均源自于大规模队列研究,在国外人群中预测效能良好,但在我国的应用价值仍需探讨。2011年,Saposnik等根据加拿大卒中网络注册中心设计了iScore评分[5]。与依赖年龄和卒中程度的量表相比,iScore评分更重视全身因素(如卒中危险因素、发病机制、基础性疾病、卒中前自理能力等),因此对于年龄和卒中程度相似而基础病情不同的患者,iScore评分能够更有效地判断的预后情况。在原始队列中,该量表对AIS患者30 d和1年死亡风险的预测效能良好(AUC分别为0.850和0.823)。Zhang等[14]对iScore评分在我国人群中进行效能评价,认为该量表可准确预测中国缺血性卒中患者病后30 d和1年时的死亡风险(AUC分别为0.825和0.822),但没有探讨其对不良结局事件的预测能力。Saposnik等[15]认为iScore评分可准确预测AIS患者出院时的不良预后风险(mRS评分≥3分,AUC=0.940)。韩国学者[16]用其预测3个月时的不良预后并取得较理想的结果(AUC=0.819)。本研究中,iScore预测AIS患者死亡风险的能力较好,AUC值为0.933,预测不良结局事件的AUC值为0.816,与国内外已有的研究结果相符,提示该量表在中国人群中具有稳定的预测效能。
PLAN评分发布于2012年,亦源于加拿大RCSN数据库,其优点在于弱化了NIHSS评分和卒中发病机制的作用,评估者无需掌握神经科理论知识,仅通过临床表现即可预测AIS患者30 d(AUC=0.88)和1年(AUC=0.84)的死亡风险[6]。与其它只能预测死亡风险的量表相比,PLAN评分的另一个关键优势是能对死亡与重度残疾事件(mRS评分≥5分)进行复合预测(AUC=0.89)。O’Donnell等[6]曾尝试在PLAN评分的基础上加入生命体征和实验室结果(体温、血压、肌酐、血糖、白细胞及血红蛋白),但新生成的PLAN-IT评分并未提高预测效能,提示PLAN评分足以在日常实践中使用。PLAN评分目前还未经过外部队列验证。本研究中PLAN评分对AIS患者3个月的中重度(mRS≥3)功能残障的AUC为0.830,结果与原文相近,但其预测效能比重度残疾事件(mRS评分≥5分,AUC值0.954)稍差,这种现象也出现在iScore和ASTRAL评分中,提示这些量表在预测患者的重度功能残障结局事件时可能更为准确。
ASTRAL评分是首个预测卒中后3个月时mRS评分的量表[4],包括年龄、NIHSS、到院时间、视野范围、急性期血糖和意识水平6个评分项目,预测效能良好(AUC=0.850)。ASTRAL评分的优势在于计算过程相对简单,并且不需要头颅影像学检查结果,提升了该量表的实用性。Liu等[17]认为ASTRAL评分能有效预测中国AIS患者3个月和 1年时的预后情况(AUC分别为0.82和0.81)。本研究中ASTRAL评分在3个月不良预后的AUC值为0.841,结果与文献相符,说明其在国内外人群中的预测效能较稳定。本研究还进一步应用ASTRAL评分预测3个月的死亡风险,其AUC为0.931,说明该量表也可用于预测AIS患者的死亡风险。由于ASTRAL评分的推导队列要求患者入院前mRS评分<3分,在剔除这部分患者后AUC值下降至0.803,考虑原因可能与本研究样本量较小、病重患者较少有关。由于在ASTRAL评分中,年龄和NIHSS分值的权重最大,因此这两个因素可能依然是AIS预后量表评分的主要依据。
iScore评分更注重全身性的危险因素,PLAN评分可同时面向神经科和非神经科医师,ASTRAL评分构成相对简单、容易掌握。3个量表各具特色,且风险预测能力差异不大,存在一定的局限性:只适用于IS,并不能用于短暂性缺血发作或出血性卒中;均依赖于一定的临床危险因素、实验室检查结果,如不能提供准确的病史,或未能完善某项检查指标,评分便无法完成;由于PLAN和ASTRAL评分总分值较低,分值跨度小,准确进行鉴别不同预后风险的患者有时候存在困难。
[1]Wu X,Zhu B,Fu L,et al.Prevalence,incidence,and mortality of stroke in the chinese island populations:a systematic review[J].PLoS One,2013,8:e78629.
[2]Adams HJ,Davis PH,Leira EC,et al.Baseline NIH Stroke Scale score strongly predicts outcome after stroke:A report of the Trial of Org 10172 in Acute Stroke Treatment(TOAST)[J]. Neurology,1999,53:126-131.
[3]Roquer J,Rodriguez-Campello A,Gomis M, et al.Comparison of the impact of atrial fibrillation on the risk of early death after stroke in women versus men[J].J Neurol,2006,253: 1484-1489.
[4]Ntaios G,Faouzi M,Ferrari J,et al.An integer-based score to predict functional outcome in acute ischemic stroke:the ASTRAL score[J]. Neurology,2012,78:1916-1922.
[5]Saposnik G,Kapral MK,Liu Y,et al.IScore: a risk score to predict death early after hospitalization foran acute ischemic stroke[J]. Circulation,2011,123:739-749.
[6]O'Donnell M J,Fang J,D'Uva C,et al.The PLAN score:a bedside prediction rule for death and severe disability following acute ischemic stroke [J].Arch Intern Med,2012,172: 1548-1556.
[7]Ueshima H,Sekikawa A,Miura K,et al.Cardiovascular disease and risk factors in Asia:a selected review [J].Circulation,2008,118: 2702-2709.
[8]Adams HJ,Bendixen BH,Kappelle LJ,et al. Classification of subtype of acute ischemic stroke.Definitions for use in a multicenter clinical trial.TOAST.Trial of Org 10172 in Acute Stroke Treatment[J].Stroke,1993,24:35-41.
[9]Kramer AA,Zimmerman JE.Assessing the calibration of mortality benchmarks in critical care:The Hosmer-Lemeshow test revisited[J]. Crit Care Med,2007,35:2052-2056.
[10]Weimar C,Konig IR,Kraywinkel K,et al. Age and National Institutes of Health Stroke Scale Score within 6 hours after onset are accurate predictors of outcome after cerebral ischemia:development and external validation of prognostic models[J].Stroke,2004,35:158-162.
[11]Solberg OG,Dahl M,Mowinckel P,et al. Derivation and validation of a simple risk score for predicting 1-year mortality in stroke[J].J Neurol,2007,254:1376-1383.
[12]Williams GR,Jiang JG.Development of an ischemic stroke survival score[J].Stroke,2000, 31:2414-2420.
[13]Smith EE,Shobha N,Dai D,et al.Risk score for in-hospital ischemic stroke mortality derived and validated within the Get With the Guidelines-Stroke Program[J].Circulation,2010, 122:1496-1504.
[14]Zhang N,Liu G,Zhang G,et al.External validation of the iScore for predicting ischemic stroke mortality in patients in China[J].Stroke, 2013,44:1924-1929.
[15]Saposnik G,Raptis S,Kapral MK,et al.The iScore predicts poor functional outcomes early after hospitalization for an acute ischemic stroke [J].Stroke,2011,42:3421-3428.
[16]Park TH,Saposnik G,Bae HJ,et al.The iS-core predicts functional outcome in Korean patients with ischemic stroke[J].Stroke,2013,44: 1440-1442.
[17]Liu G,Ntaios G,Zheng H,et al.External validation of the ASTRAL score to predict 3-and 12-month functional outcome in the China National Stroke Registry [J].Stroke,2013,44: 1443-1445.
External Validation of the iScore,PLAN Score and ASTRAL Score to Predict Functional Outcomes for Acute Ischemic Stroke
Objective:To validate the significance of iScore,PLAN score and ASTRAL score in predicting the outcome of Chinese patients at 3 month after acute ischemic cerebral stroke (AIS).Methods:From December 2012 to August 2013,221 AIS patients who hospitalized in neurology department of our hospital were collected prospectively.Related baseline data were recorded and calculated by iScore,PLAN score and ASTRAL score. The outcome events were defined as death and poor functional outcome,or modified Rankin Scale(≥3).Model discrimination was quantified by calculating the area under the Receiver Operating Characteristic curve(AUC), and calibration was assessed bygoodness of fit test andcorrelation coefficient. Results:Seventy-one cases(32.1%)had 3-month an unfavorable outcome.AUC for iScore,PLAN score and ASTRAL score were 0.816,0.830 and 0.841 respectively.x2ofwere 1.676,5.976 and 12.858 (all>0.05),andcorrelation coefficient were 0.899,0.857 and 0.939 (all<0.05),respectively.Conclusion:All the three scales can predict 3-month functional outcomes in Chinese stroke patients precisely and reliably.There was a high correlation between observed and expected probability of unfavorable outcome.
acute ischemic stroke;prognosis;score;Receiver Operating Characteristic curve
R741;R741.04
A DOI 10.3870/sjsscj.2014.03.011
北京大学航天临床医学院神经内科北京100049
2013-12-20
杜继臣djc189@tom.com杨旭xuyanghangtian@ 163.com
