微小RNA 前体区域基因多态与儿童特异性皮炎易感性的关联研究*
2014-01-11苏洁慧李群山刘丽芬包永芬
苏洁慧,李群山,刘丽芬,包永芬
(1.惠州市中医医院,广东 惠州 516001;2.湖北科技学院基础医学院)
特异性皮炎(atopic dermatitis,AD)是多发于婴幼儿的一种慢性、复发性、炎症性皮肤疾病,主要临床表现为皮肤广泛红斑、丘疹、脱屑、顽固瘙痒和皮肤干燥等。流行病学研究显示过去30 年中世界大多数工业化国家儿童AD 的患病率大幅度增加,不仅给患儿的生长发育和心理健康造成极大影响,也给家庭和社会带来了经济负担[1]。AD 的病因尚不完全清楚,有研究认为炎性免疫机制中T 细胞因子失衡在AD 的发生和发展中起着非常重要的作用[2]。微小RNA(micro-RNA,miRNA)是一类高度保守的非编码小分子单链RNA,其参与调控细胞生长、发育、分化和增殖等多个生命过程[3],包括参与了免疫细胞的分化和成熟、抗体的产生、炎性因子的释放等免疫过程,对机体免疫功能的正常发挥起着非常重要的作用[4],而miRNA 相关单核苷酸多态性(single nucleotide polymorphism,SNP)可以调控miRNA 的表达和功能[5]。目前研究较多的miRNA 前体区域基因多态SNPs 是hsa-mir-149 rs2292832、hsa-mir-146a rs2910164、has-mir-499 rs374644 和hsa-mir-196a2 rs11614913,已有多个研究显示这些SNPs 与肿瘤、哮喘和呼吸系统疾病的发病风险存在着关联[6],但其与儿童AD 易感性的相关研究未见报道。本研究拟采用病例-对照研究,探讨此4 个SNPs 与儿童AD 易感性的关系,为进一步阐明儿童AD 的发病机制奠定基础。
1 对象与方法
1.1 研究对象
2004 年9 月至2012 年3 月,在惠州市某三甲医院收集本研究所需的研究对象。病例是在该医院儿科就诊的符合Hanifin 和Rajka 诊断标准的AD 患儿,且2 周内未使用糖皮质激素和3d 内停用抗组胺类药物。对照组为同期在该医院体检合格的健康儿童400例,无荨麻疹、湿疹和哮喘等过敏性疾病史且血液学分析、生化和免疫等检测结果均正常,并与病例组按年龄(相差不超过1 个月)进行1∶1 匹配,搜集符合条件的病例和对照各400例。所有研究对象均签署知情同意书,并在调查员指导下,由研究对象的监护人填写统一的调查表,调查内容包括基本人口学信息、香烟暴露史和过敏性疾病家族史等资料。研究对象均空腹抽取外周血2~3ml,肝素抗凝,于-80℃冰箱保存。
1.2 基因型分析
共选取hsa-mir-149 rs2292832、hsa-mir-146a rs2910164、has-mir-499 rs374644 和hsa-mir-196a2 rs11614913,4 个SNPs 进行分析。探针和引物均从ABI 公司订购,并按照说明配制PCR 反应体系,采用ABI 公司的7900HT 型高通量实时荧光定量PCR 系统(兼容96 孔、384 孔和Tagman 低密度表达谱芯片)进行PCR 反应和终点读板分析。利用SDS2.2.1 软件分析基因分型结果。每一个384 孔板均设置3 个阳性对照,采用质量好的DNA 样本;3 个阴性对照采用DNA 稀释液代替基因组DNA 加入PCR 反应体系中。每板均采用质量控制样本重复检测,检测结果一致性为100%。
1.3 统计学方法
以χ2检验和t 检验比较病例组和对照组之间的人口学特征和基因型的分布差异。对照组的基因型分布进行Hardy-Weinberg 平衡检验采用拟合优度χ2检验;单因素和多因素logistic 回归计算OR 值及其95%CI。所有的统计学检验均为双侧概率检验,检验水准为α=0.05。所有统计分析均使用SPSS18.0 软件包进行。
2 结果
2.1 一般情况
两组一般情况比较见表1,可见病例组男性比例显著高于对照组(P <0.01),病例组有过敏性疾病家庭史患者比例也显著高于对照组(P <0.01)。
表1 AD 患儿和健康对照儿童的一般情况()
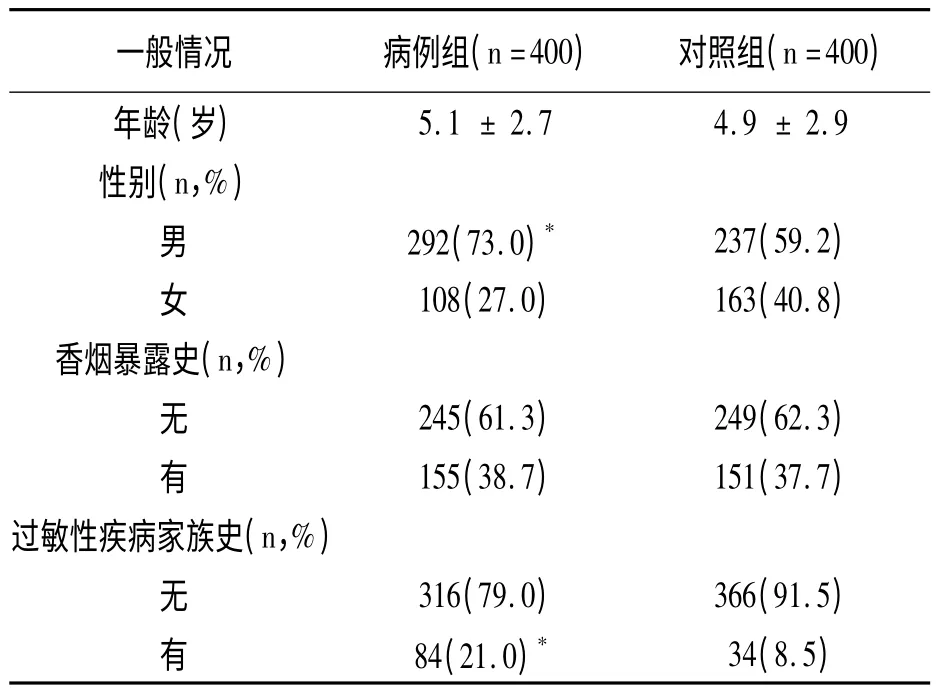
表1 AD 患儿和健康对照儿童的一般情况()
与对照组比较,* P <0.01
2.2 微小RNA 前体区域SNPs 和儿童AD 的关联性
拟合优 度 χ2检验显 示 hsa-mir-149 rs2292832、hsa-mir-146a rs2910164、has-mir-499 rs374644 和hsa-mir-196a2 rs11614913,4 个SNP 在对照组中的基因型的分布均符合Hardy-Weinberg平衡规律(P >0.05)。表2 为各SNPs 基因型在病例组和对照组中的频率分布。调整性别、年龄、家庭环境香烟暴露史和过敏性疾病家族史等变量后,多因素Logistic 回归分析显示:与hsa-mir-146a rs2910164 基因型为GG+CG 者相比,基因型为CC 者患AD 的危险性增加(OR=1.49,95%CI:1.21-1.85,P <0.001);未发现 hsa-mir-196a2 rs11614913、hsa-mir-149 rs2292832 和has-mir-499 rs374644,3 个位点的基因型在病例组和对照组的频率分布的统计学差异(P >0.05)。
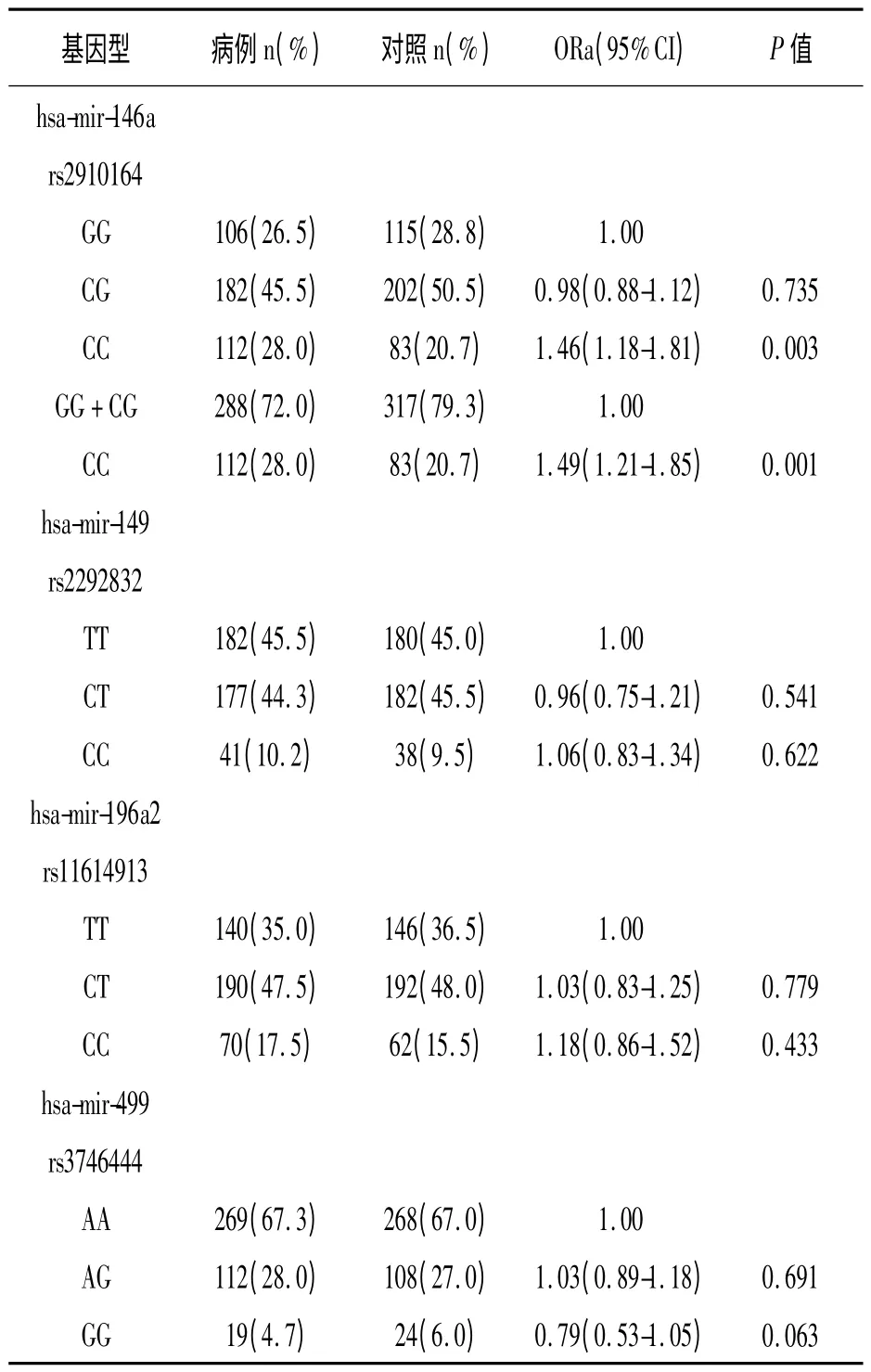
表2 微小RNA 前体区域基因型频率分布以及与儿童AD 危险度的关系
2.3 hsa-mir-146a rs2910164 位点基因频率与儿童AD 发病风险的分层分析
按性别、家庭环境香烟暴露史和过敏性疾病家族史进行分层,采用多因素Logistic 回归分析,校正混杂因素后发现,携带CC 基因型增加AD 发病风险在男性(OR=1.60,95%CI:1.24-2.02,P<0.001)、有家庭环境香烟暴露史(OR=2.00,95%CI:1.75-2.34,P <0.001)和无过敏性疾病家族史(OR=1.45,95%CI:1.11-1.85,P=0.011)的儿童中更加显著,结果见表3。
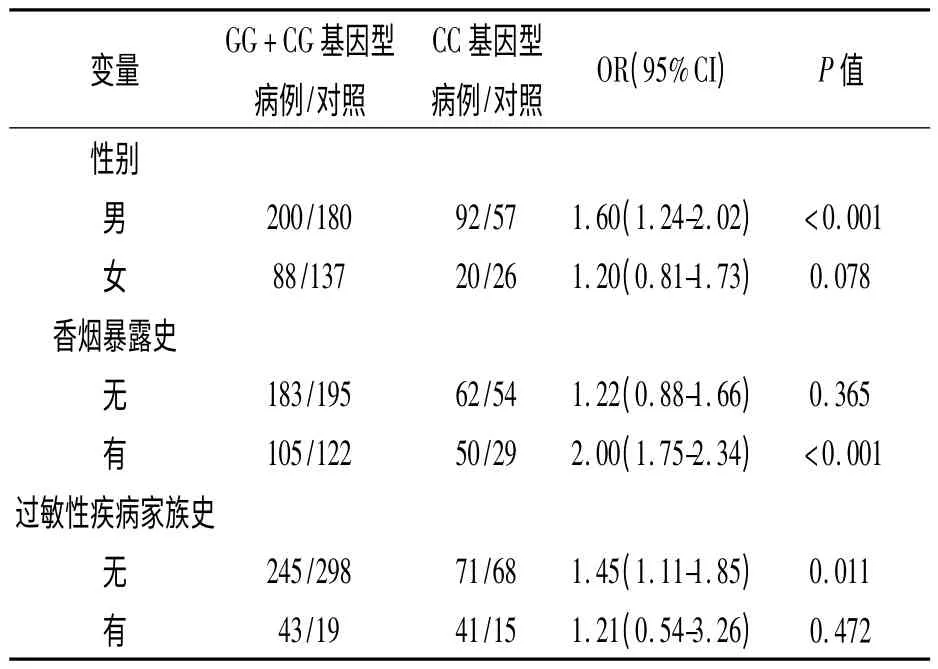
表3 rs11614913 位点基因频率与儿童AD 发病风险的分层分析
3 讨论
miRNA 是一类长21~24 个核苷酸的高度保守的非编码小分子单链RNA,通过降解mRNA 或者抑制蛋白质的翻译过程,从转录后水平实现对靶基因的调控,从而参与细胞生长、发育、分化和增殖等多个生命过程[3]。近年来,有多个研究显示miRNA 功能与肿瘤、神经系统疾病哮喘有着密切的关系[7]。miRNA 前体区域的SNPs 可能影响其表达、成熟以及与靶mRNA 的结合,如研究表明hsa-mir-146a rs2910164 C 等位基因可显著增加成熟 miRNA-146a 的形成[8];hsa-mir-196a2 rs11614913 C 等位基因则会影响miRNA-196a2 的成熟过程以及与靶mRNA 的结合能力[9]。Xu Zhibin 等用NCBI dbSNP 数据库对miRBase 中注册的miRNAs 进行了序列比对,发现中国人群中miRNA 前体区域高度保守,有潜在功能的SNPs仅有4 个,分别为hsa-mir-149 rs2292832、hsa-mir-146a rs2910164、has-mir-499 rs374644 和hsa-mir-196a2 rs11614913[9],他们还报道hsa-mir-196a2 rs11614913 C 等位基因可显著增加肺癌的发病风险,且与非小细胞肺癌的不良预后显著相关[10]。目前在中国人群中主要是研究此4 个miRNA 前体区域SNPs 与肿瘤的关系,其与其它疾病的关系鲜有报道。
本病例-对照研究首次探讨了miRNA 前体区域4 个常见潜在功能位点与中国儿童AD 易感性的关系。结果显示hsa-mir-146a 基因多态性位点rs2910164 与儿童AD 易感性有关;未发现其它3个SNPs 与AD 易感性有关。以往研究发现hsamir-146a rs2910164 C 等位基因可显著增加成熟miRNA-146 水平,另外功能学实验表明成熟的miRNA-146 通过TNF-α 途径影响IL-8 和CCL5/RANTES 等炎性因子的释放参与机体炎性免疫反应[11],提示rs2910164 CC 基因可能通过影响成熟miRNA-146 水平,从而调节机体炎性免疫反应而使儿童AD 的发病风险增加。分层分析显示,rs2910164 CC 基因型增加儿童AD 发病风险。在男性、有家庭环境香烟暴露史和无过敏性疾病家族史的儿童中更加显著。有家庭环境香烟暴露史的儿童rs2910164 CC 基因型增加AD 发病风险更加显著,提示rs2910164 CC 基因型与香烟暴露在促进儿童皮肤炎性免疫反应中存在协同作用。在有过敏性疾病家族史的患儿中rs2910164 CC 基因型效应不明显,可能是由于过敏性疾病家族史是儿童AD 较强的危险因素,掩盖了rs2910164 CC基因型的效应。
综上,miRNA 前体区域hsa-mir-146a 基因多态性位点rs2910164 CC 基因型可显著增加儿童AD 发病风险,但该结果还需在其他地区人群中扩大样本量进行重复、验证,rs2910164 CC 基因型增加儿童AD 发病风险的机制尚有待进一步功能学探索。
[1]Leung DY,Boguniewicz M,Howell MD,et al.New insights into atopic dermatitis[J].J Clin Invest,2004,113(5):651
[2]Chan LS,Robinson N,Xu L.Expression of interleukin-4 in the epidermis of transgenic mice results in a pruritic inflammatory skin disease:an experimental animal model to study atopic dermatitis[J].J Invest Dermatol,2001,117(4):977
[3]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281
[4]Tomankova T,Petrek M,Gallo J,et al.MicroRNAs:emerging regulators of immune-mediated diseases[J].Scand J Immunol,2011,187(96):75
[5]Wu M,Jolicoeur N,Li Z,et al.Genetic variations of microRNAs in human cancer and their effects on the expression of miRNAs[J].Carcinogenesis,2008,29(9):1710
[6]Alshatwi AA,Shafi G,Hasan TN,et al.Differential expression profile and genetic variants of microRNAs sequences in breast cancer patients[J].PLoS One,2012,7(2):e30049
[7]Tchatchou S,Jung A,Hemminki K,et al.A variant affecting a putative miRNA target site in estrogen receptor(ESR)1 is associated with breast cancer risk in premenopausal women[J].Carcinogenesis,2009,30(1):59
[8]Abelson JF,Kwan KY,O'Roak BJ,et al.Sequence variants in SLITRK1 are associated with Tourette's syndrome[J].Science,2005,310(5746):317
[9]Xu B,Feng NH,Li PC,et al.A functional polymorphism in Pre-miR-146a gene is associated with prostate cancer risk and mature miR-146a expression in vivo[J].Prostate,2010,70(5):467
[10]Hoffman AE,Zheng T,Yi C,et al.microRNA miR-196a-2 and breast cancer:a genetic and epigenetic association study and functional analysis[J].Cancer Res,2009,69(14):5970
[11]Zhou T,Garcia JG,Zhang W.Integrating microRNAs into a system biology approach to acute lung injury[J].Transl Res,2011,157(4):180
