太行菊和野菊不同器官醇提液抗氧化活性比较研究
2014-01-10张晓雯魏东伟孙武勇叶永忠
张晓雯,魏东伟*,孙武勇,叶永忠
1河南农业大学生命科学学院,郑州 450002;2 河南出入境检验检疫局检验检疫技术中心,郑州 450003
随着对自由基与疾病关系认知的深入,从天然植物中寻找可清除机体过量自由基的植物源抗氧化剂成为现代保健、医药等行业的热点。菊花为我国传统药食同源中药,菊花酒可明目、降血压,有减肥、补肝气、安肠胃等功效。酒自身具活血功效,较传统水煎与沸水冲饮,菊花泡酒可更大程度提高药效,具有深入研究的价值。太行菊[Opisthopappus taihangensis (Ling)Shih]为太行菊属(Opisthopappus Shih)多年生宿根草本植物,隶属菊科菊蒿亚族。该属有长裂太行菊和太行菊两个我国特有种,主要分布在河南新乡、焦作、林州和山西陵川、晋城等太行山区。其花色洁白,株型低矮整齐,花期较长,植物通体富含芳香油,干后香味持久[1,2]。在其产地,太行菊常作野菊入药,其香气浓郁,当地群众反映泡茶饮用或药用价值远优于其近缘属的传统药食兼用野菊。
本研究组前期工作表明,太行菊花和野菊花水提液具有较高的抗氧化活性[3],太行菊花叶茎各器官绿原酸、芦丁、槲皮素、木犀草素和芹菜素五种酚类物质的总含量高于野菊对应器官[4]。现有大量研究认为,黄酮多酚类物质是多种植物抗氧化活性的重要贡献因素[5,6]。因此,本文主要集中研究太行菊和野菊不同器官醇提液的抗氧化活性、紫外-可见吸收光谱特性以及抗氧化活性与总黄酮和多酚含量的相关性,为我国特有植物太行菊的深入研究与合理开发利用提供一定依据。
1 材料与仪器
1.1 材料与试剂
材料:太行菊与野菊于2011 年10 月采集于河南省新乡卫辉太行山区,经叶永忠教授鉴定。取叶、花、茎三部位为供试材料,其中茎为幼茎部分。试样经分开,阴干,粉碎,过40 目筛后于干燥器中备用。
试剂:ABTS[2,2-连氮-双(3-乙基苯并噻唑-6-磺酸)],DPPH(2,2-二苯基-1-古肼基自由基),芦丁(≥98%),福林酚试剂,没食子酸(≥98%)购自Sigma-Aldrich 公司;Trolox(奎诺二甲基丙烯酸酯C14H18O4)购自上海浩然生物科技有限公司;K2S2O3、NaOH、NaNO2、Al(NO3)3、Na2CO3、无水乙醇均为分析纯。所有试剂使用前未经处理,溶液未经特殊说明均用蒸馏水配制。
1.2 仪器与设备
2 实验方法
2.1 样品的制备
精密称取0.03 g(ABTS 体系)或0.15 g(DPPH体系)菊试样,加入10 mL 无水乙醇,不同温度(40、55、65 ℃)水浴加热反应4 h,提取后冷却至室温,5000 rpm 离心15 min,取上清液,稀释至不同浓度备用。
2.2 抗氧化活性测定
2.2.1 清除ABTS 自由基的能力
精密称取0.0033 g 高硫酸钾和0.0189 g ABTS,用去离子水溶解混合定容于2 mL 棕色容量瓶,避光静置12~16 h,得ABTS 储备液。使用前用无水乙醇稀释至ABTS 的吸光值414 nm 处为1.0左右,储备液当天配置使用。将不同质量浓度的样品醇提液按表1 加样,各组溶液充分混匀,30 ℃恒温水浴反应6 min。用分光光度法测定反应体系414 nm 处的吸光值。根据吸光值变化判断试样对ABTS 自由基清除能力。
2.2.2 清除DPPH 自由基的能力
精密称取0.0132 g DPPH,无水乙醇溶解并定容于250 mL,即得DPPH 储备液,于4 ℃保存备用。将不同质量浓度的样品醇提液按表1 加样,各组溶液充分混匀,37 ℃恒温水浴反应20 min。用分光光度法测定反应体系在最大吸收波长521 nm 处的吸光值,根据吸光值变化判断试样对DPPH 自由基清除能力。
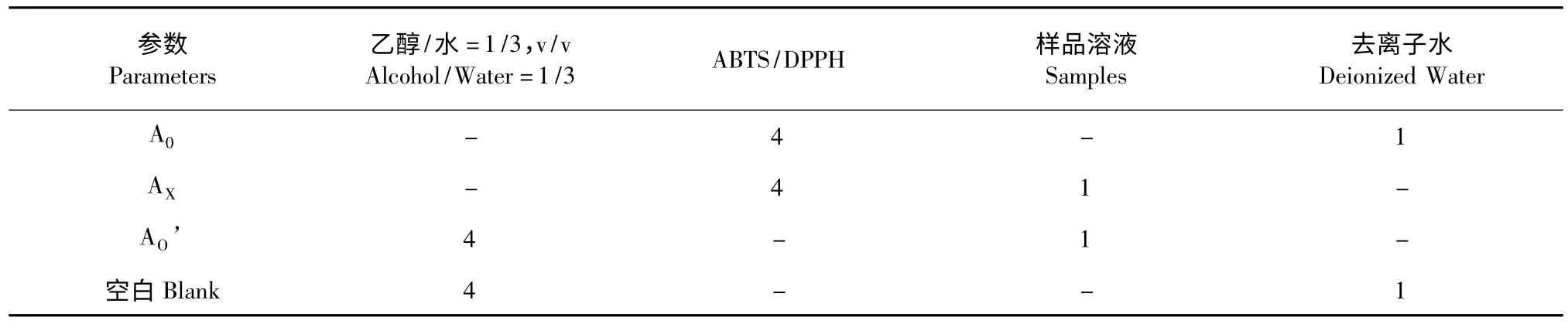
表1 ABTS/DPPH 自由基反应体系(1 单位=0.7 mL 总体积:3.5 mL)Table 1 Reaction systems of ABTS/DPPH scavenging assay (1 unit=0.7 mL Total bulk:3.5 mL)
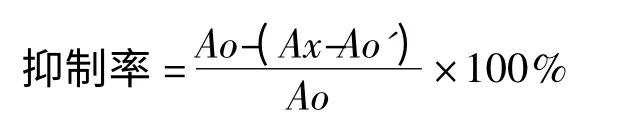
其中:A0为样品空白时吸光值;AX为含有样品提取物时吸光值;A0'为样品提取物本底吸光值。
2.2.3 Trolox 等效抗氧化能力(Trolox equivalent antioxidant capacity,TEAC)计算
准精密称取0.0125 g Trolox 粉末,无水乙醇溶解转移并定容于50 mL 容量瓶,得Trolox 标准溶液。将上述Trolox 样液用无水乙醇按需要稀释为不同浓度,分别于ABTS 和DPPH 体系测定其吸光值,计算抑制率。以Trolox 浓度为横坐标,抑制率为纵坐标绘制标准曲线,分别得ABTS 体系的曲线方程y=-5.1801 +1.1849x,R=0.9968;DPPH 体系的曲线方程y=0.52088x-5.054,R=0.9996。通过上述方程计算Trolox 在两个体系的IC50(清除率为50%时所需抗氧化剂的浓度)值,Trolox 的IC50值与样品IC50的比值即为样品的RACT50。
测量位置应做统一规定,确保上次检修与本次检修在同一位置上测量,以减少误差。齿高的降低值与上次修后汽封间隙之和,即为本次修前汽封间隙。
2.3 紫外-可见光谱特性的测定
精密称取0.3 g 样品同1.3.1 提取步骤,得样品不同提取条件浓度为3 g/L 的提取原液,依需要稀释至0.5 g/L 保持菊样品吸光值低于2.0,以提取溶剂无水乙醇为对照,在200~800 nm 范围间进行紫外-可见吸收光谱扫描。
2.4 总多酚含量测定
采用Folin-Ciocalteu 比色法[4],结果以相当没食子酸(GAE)的毫克数表示(mg GAE/g)。
2.5 总黄酮的含量测定
采用硝酸铝络合分光光度法[4],结果以相当芦丁(Rutin)的毫克数表示(mg Rutin/g)。
2.6 数据分析
采用origin 6.1 进行数据处理和相关性分析。
3 结果与分析
3.1 太行菊和野菊不同器官醇提液的抗氧化活性

图1 太行菊和野菊不同器官不同提取温度醇提液ABTS(A 40 ℃,C 65 ℃)和DPPH(B 40 ℃,D65 ℃)自由基清除效果Fig.1 ABTS (A 40 ℃,C 65 ℃)and DPPH (B 40 ℃,D65 ℃)radical scavenging capacity of alcoholic extracts of different organs of O.taihangensis and D.indicum
ABTS+·是一种较稳定的自由基,其无水乙醇或磷酸缓冲液呈蓝绿色,抗氧化活性物质可抑制其产生并使反应体系褪色,表现出吸光度降低,通过测定加入活性物质前后414 nm 或731 nm 处吸光值的减弱程度,评价试样清除ABTS 自由基能力。颜色变得越浅,表明活性物质清除ABTS 自由基的能力越强。DPPH·是一种在有机溶剂中稳定的以氮为中心的自由基,其乙醇溶液呈紫色,在517 nm 附近有强吸收,抗氧化活性物质存在时,其所含的孤对电子被配对使反应体系褪色,吸光值减弱或消失,通过测定最大吸收波长处吸光值的减弱程度评价试样对DPPH 自由基能力。太行菊和野菊不同器官醇提液的抗氧化活性见图1.图1 表明,太行菊和野菊不同器官醇提液对ABTS 和DPPH 自由基均有一定清除能力,且其清除率随提取液添加量的增加而增高,呈现一定的剂量效应关系。在同一添加量时,太行菊叶较其他样品清除能力更强,其次为野菊叶,太行菊花和太行菊茎(幼茎)清除能力较接近,接着为野菊花,而野菊茎则最弱,两种方法的活性测定结果大体趋势一致。
评价一种物质的抗氧化活性,通常以抑制率Inhibition(I)或半抑制浓度IC50(清除率为50%时所需抗氧化剂的浓度)作为衡量指标。国际上多用Trolox 等同抗氧化活性值(TEAC)评价抗氧化能力,即相当于同等清除能力的Trolox 浓度的浓度数。以Trolox 的浓度为横坐标,抑制率为纵坐标分别绘制ABTS 和DPPH 自由基清除能力测定体系的曲线方程,根据曲线方程计算Trolox 的IC50,详见1.3.2 实验部分。Trolox 在两个评价体系的IC50分别为ABTS 体系46.57 μmol/L,DPPH 体系105.69 μmol/L。同理,分别计算菊试样ABTS 和DPPH 体系的IC50,Trolox 的IC50与试样的IC50比值即为试样的RACT50。IC50和RACT50值可表征试样抗氧化活性,IC50值越小,RACT50则越大,表示此试样的抗氧化活性越强,反之则相对较弱。各试样的IC50和RACT50值见表2。由表2 可看出,相同提取温度时两种菊试样不同评价体系抗氧化活性均有如下顺序:太行菊叶>野菊叶>太行菊花≈太行菊茎>野菊花>野菊茎。例65 ℃时,DPPH 和ABTS 体系菊试样醇提液的RACT50(μmol/g)值趋势一致,分别为ABTS 体系,太行菊叶287.29 >野菊叶197.33 >太行菊花122.61 >太行菊茎89.23 >野菊花86.51 >野菊茎33.69;DPPH 体系,太行菊叶98.58 >野菊叶52.85>太行菊茎51.95 >太行菊花32.84 >野菊花28.61>野菊茎13.35。因此,太行菊不同器官的醇提液对ABTS 和DPPH 自由基清除能力均高于野菊对应器官,较于近缘属的野菊,太行菊可能具有更好的保健和药用功效,值得深入研究。

表2 太行菊和野菊不同器官的IC50(g/L)与RACT50(μmol/g)及总多酚(mg GAE/g)和总黄酮(mg Rutin/g)含量Table 2 IC50(g/L),RACT50(μmol/g)and contents of total flavonoids (mg Rutin/g)and phenolics (mg GAE/g)of O.taihangensis and D.indicum
3.2 紫外-可见吸收光谱特性
为探明太行菊和野菊醇提液的抗氧化活性成分,对菊试样各器官醇提液进行紫外-可见吸收光谱特性研究,见图2。由图2 中可看出,太行菊和野菊不同器官醇提液均在220~280 nm,300~400 nm 间有两个明显吸收带,该吸收特征符合黄酮多酚类化合物的光谱特性,表明提取液中富含黄酮多酚类物质[7]。此外可知,两种菊花醇提液在同一质量浓度(0.5 g/L)的吸收峰值为:太行菊叶>野菊叶>太行菊花≈太行菊茎>野菊花>野菊茎,与图1 和表2所示两种菊花醇提液清除ABTS 和DPPH 自由基效能结果一致。由此可推断,太行菊和野菊各器官醇提液自由基清除能力与浸出的黄酮多酚成分密切相关。
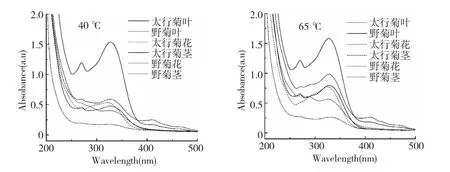
图2 太行菊和野菊不同器官醇提液紫外-可见光谱特性(0.5 g/L)Fig.2 UV-Vis spectra of alcoholic extracts from different organs of O.taihangensis and D.indicum (0.5 g/L)

图3 太行菊和野菊不同器官不同提取温度醇提液的紫外-可见光谱吸收值Fig.3 UV-Vis absorbance values of alcoholic extracts from different organs of O.taihangensis and D.indicum under 3 testing temperatures
与图2 相对应的两种菊不同提取温度醇提液的紫外-可见吸收峰值变化趋势见图3。由图3 可知,太行菊和野菊不同器官除太行菊叶紫外-可见吸收峰值(a.u.)基本接近,分别为1.539、1.541、1.583外,其他器官均表现出随温度的升高紫外-可见吸收峰值逐渐增大,例40、55、65 ℃,太行菊花依次为0.479、0.534、0.796;野菊花0.403、0.503、0.564;野菊叶0.591、0.789、0.981;太行菊茎0.536、0.566、0.770;野菊茎0.174、0.241、0.262。由此可推断,高温提取液黄酮多酚类物质浸出量增高。但对应器官的吸收峰值与抗氧化活性趋势没有表现完全一致性,可能是提取温度影响菊试样中其他活性成分的浸出或影响一些成分间的协同作用而导致该结果。
3.3 太行菊和野菊不同器官总多酚与总黄酮含量
为研究黄酮多酚类化合物与抗氧化活性的关系,分别采用硝酸铝络合分光光度法和Folin-Ciocalteu 比色法研究两种菊花不同器官中总黄酮与多酚的含量,见表2。由表2 可知,太行菊和野菊不同器官总黄酮和多酚含量顺序与其醇提液清除ABTS 和DPPH 自由基的效能顺序基本一致,即总黄酮含量(mg Rutin/g),太行菊叶115.95 >野菊叶76.99 >太行菊花69.90 >野菊花55.19 >太行菊茎44.83 >野菊茎;总多酚含量(mg GAE/g),太行菊叶153.44>野菊叶136.93 太行菊花114.83 >野菊花100.18>太行菊茎85.65 >野菊茎39.78。其中,太行菊不同器官总黄酮与总多酚含量均高于野菊对应器官,且同一器官中总多酚含量高于总黄酮。Xavier.vitrac[8]研究组通过评价30 种工业用植物提取液酚类物质和其抗氧化活性实验证实,植物抗氧化活性与其酚类物质含量密切相关,酚类物质是其抗氧化活性的重要贡献因素。本研究结果支持前人的研究。
3.4 相关性分析
为进一步了解提取物组分对其抗氧化能力的贡献,对太行菊和野菊不同器官醇提液的总黄酮与多酚含量及抗氧化能力测定结果间进行相关性分析,见表3 和图4。
以40 ℃提取的菊试样醇提液抗氧化活性为例说明,如图4A 所示,以供试菊不同器官ABTS 体系RACT50值(x)为自变量,总多酚、总黄酮含量(y)为因变量进行相关性分析,得回归方程的相关系数。同样的方法可获得供试菊DPPH 体系的RACT50与总多酚、总黄酮含量的相关系数(图4B),总多酚与总黄酮含量间(图4C),ABTS 与DPPH 两种抗氧化活性方法间的相关性(图4D)。因此,由表3 和图4可知,太行菊和野菊不同器官不同温度的醇提液自由基清除能力与总多酚和总黄酮的含量均呈显著正相关,其中ABTS 体系与总黄酮多酚含量间相关系数R >0.891,DPPH 体系与总黄酮多酚总含量间相关系数R >0.794,进一步表明总多酚与总黄酮是自由基清除能力的主要贡献因素,总黄酮与多酚含量相关性较高为0.969,说明菊试样总黄酮与多酚化合物类别有较大相似性,ABTS 与DPPH 两种抗氧化活性测定方法间存在较高相关性,可能与其具有相似的反应机理有关[9]。
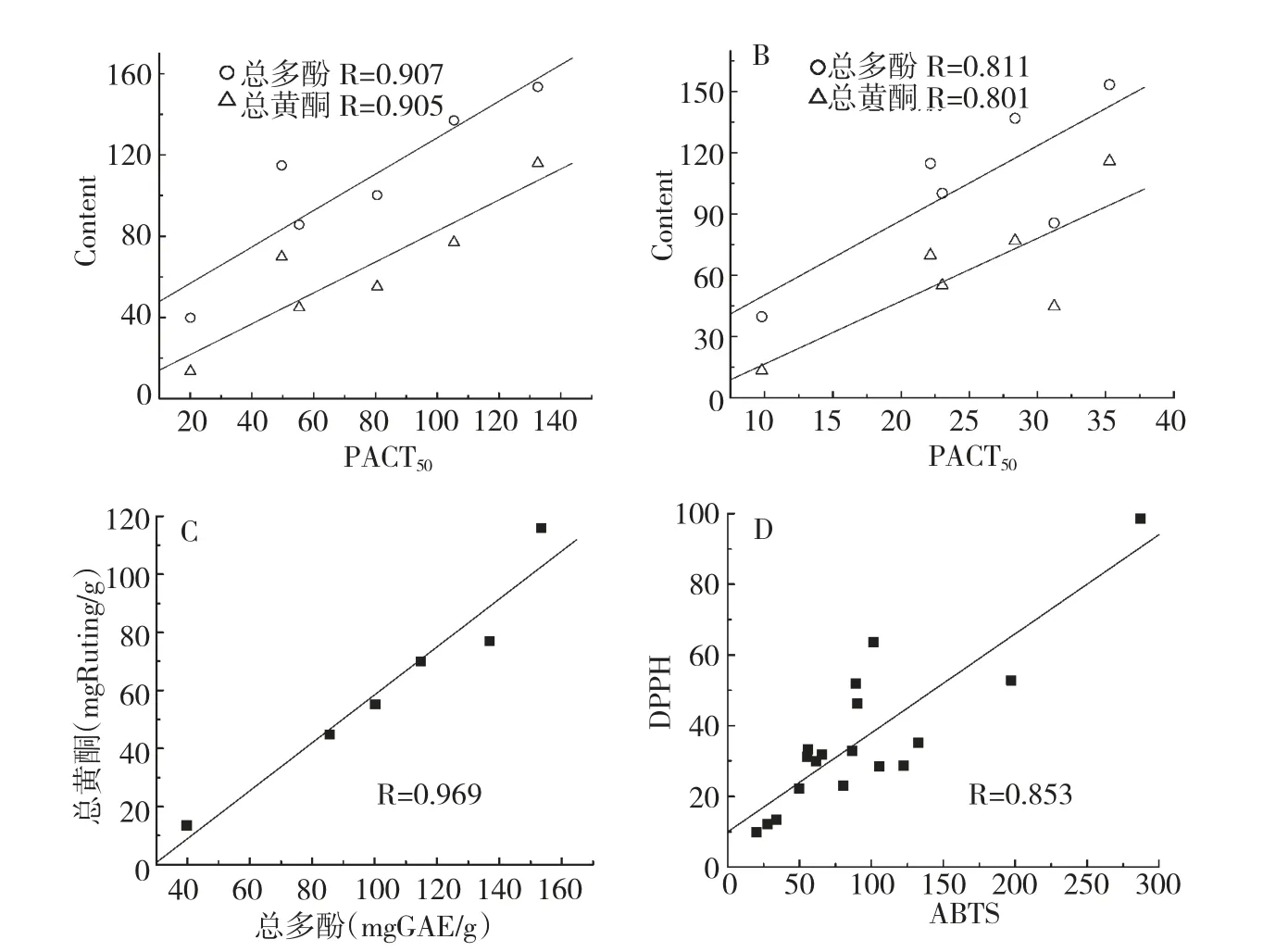
图4 供试菊样醇提液自由基清除能力与总多酚和总黄酮含量相关性[(ABTS,A),(DPPH,B)],总多酚与总黄酮含量间(C),ABTS 与DPPH 两种检测方法间(D)相关性Fig.4 Correlations between radical scavenging capacities and total flavonoids/polyphenols contents [(ABTS,A)and (DPPH,B)],between total flavonoids and polyphenols content assays(C)and between DPPH and ABTS assays(D)
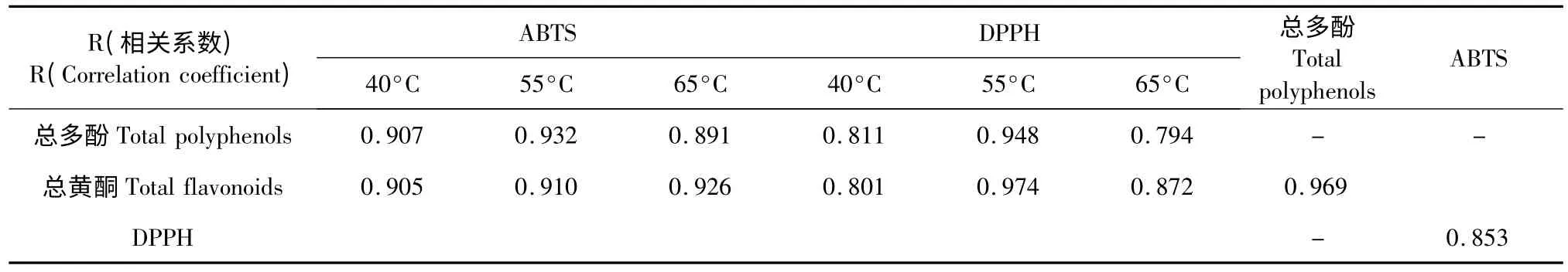
表3 活性物质与抗氧化方法间的相关性Table 3 Correlation coefficient (R)between active substances and radical scavenging capacity assays
4 结论
本文采用国际常用的ABTS 和DPPH 方法评价太行菊和野菊不同器官醇提液的抗氧化活性,研究其相应的紫外-可见光谱特性,总多酚与总黄酮含量与抗氧化活性的相关性。结果表明,太行菊和野菊不同器官醇提液均有一定的抗氧化能力,其不同温度醇提液的紫外-可见吸收峰峰形符合黄酮多酚类物质的吸收特性。不同提取温度的醇提液在两种抗氧化评价体系活性顺序趋势一致,即太行菊叶>野菊叶>太行菊花>太行菊茎≈野菊花>野菊茎,且这一顺序与总黄酮与多酚含量测定结果及紫外-可见吸收光谱峰值大小顺序基本一致。相关性分析结果表明,总多酚与总黄酮含量与抗氧化活性呈显著正相关,进一步说明总多酚与总黄酮为菊试样醇提液清除自由基能力的主要贡献因素。上述研究结果初步佐证太行山区当地群众反映的实用效果,较其近缘属的传统药用野菊,太行菊可能具有更好的保健与药用功效,其整个植株的开发利用潜力显著。此外,黄酮多酚类化合物不是菊试样仅有的抗氧化活性物质,且其种类和结构存在多样性,为实现合理开发利用,太行菊活性成分的深入研究有待继续开展。
1 Flora of China.http://frps.plantphoto.cn/list.aspx(accessed July 11,2012),中国植物志,1983.76,73-74.
2 Gao YH(高亚卉),Dai PF(戴攀峰),Ji ZF(姬志峰),et al.Studies on pollen morphology of Opisthopappus Shih.Acta Bot Boreal-Occident Sin (西北植物学报),2011,31:2464-2472.
3 Liu QJ,Liu HF,Yuan ZL,et al.Evaluation of antioxidant activity of chrysanthemum extracts and tea beverages by gold nanoparticles-based assay.Colloids Surf B,2012,92:348-352.
4 Liu HF(刘海芳),Wei DW(魏东伟),Liu QJ(刘全军),et al.Determination of chlorogenic acid and four flavonoids in different organs of Opisthopappus taihangensis (Ling)Shih.Nat Prod Res Dev (天然产物研究与开发),2013,25:646-651.
5 Gong Y,Liu X,He WH,et al.Investigation into the antioxidant activity and chemical composition of alcoholic extracts from defatted marigold (Tagetes erecta L.)residue.Fitoterapia,2012,83:481-489.
6 Zhang JY(张靖媛),Wu H(吴昊),Wang FW(王凤舞),et al.Correlation between antioxidant activity and contents of VC,polyphenols and polysaccharides in pumpkin wine.Food Science (食品科学),2013,34:78-82.
7 Shi XP(石雪萍),Wu LL(吴亮亮),Gao P(高鹏),et al.Ethanol extracts from twenty edible spices:antioxidant activity and its correlations with total flavonoids and total phenols contents.Food Sci(食品科学),2011,3(5):83-86.
8 Dudonné S,Vitrac X,Coutiére P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays.J Agric Food Chem,2009,57:1768-1774.
9 Floegel A,Kim DO,Chung SJ,et al.Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods.J Food Comp Analy,2011,24:1043-1048.
