富硒灵芝调控大鼠乙酰辅酶A 羧化酶α 表达治疗非酒精性脂肪肝病的研究
2014-01-10武俊紫贾亚敏沈平瑞胡跃高全胜麟李树德
武俊紫,贾亚敏,沈平瑞,胡跃高,全胜麟,李 燕*,李树德
1昆明理工大学昆华医学院,昆明 650504;2 云南省第一人民医院干部保健科,昆明 650031;3太原理工大学现代科技学院,太原 030021;4 沈阳康硒生物工程研究所,沈阳 110015;5中国农业大学农学与生物技术学院,北京 100094;6 昆明医科大学基础医学院,昆明 650504
硒(Selenium,Se)是人体必需的微量元素之一[1],其在肝脏内是构成谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)的重要成分之一。人体内硒的主要来源为食物,但富硒食品相对较少。灵芝(Ganoderma)是药食两用菌,属于珍贵的药用真菌之一,具有养心安神、补气益血、补肺平喘、滋补强壮、扶正固本等功效,同时灵芝对某些微量元素特别是硒具有高度的富集作用,可以将水中添加无机硒转化为有机硒,利于人体摄入[2]。本实验采用富硒灵芝治疗非酒精性脂肪肝病(Non-Alcoholic Fatty Liver Disease,NAFLD)大鼠,现对治疗前后大鼠SREBF1、ACCα 及其相关因子做统计分析。
1 材料与方法
1.1 材料
1.1.1 动物
60 只雄性清洁级SD 大鼠[合格证号:SYXK(滇)2011-0004],体重160~180 g,动物、基础饲料以及饲养用垫料均由昆明医科大学动物实验部提供。
1.1.2 高脂溶液配制与灌胃量
97%猪油、2%胆固醇与1%胆酸钠配置100%高脂溶液,大鼠灌胃时采用16 mm 灌胃针头,大鼠灌胃量为每100 g 大鼠体重灌1 mL 高脂溶液,每天早上灌胃一次,另模型对照组和富硒灵芝治疗组在造模全程内日常饮水均为10%的红糖水。
1.1.3 药品与试剂
富硒灵芝(含硒量为3.162 mg/kg),由沈阳康硒生物工程研究所提供。胆固醇购自北京鼎国生物技术公司,胆酸钠购自上海金穗生物公司,猪油和红糖市场自购;血糖、GSH、MDA、SOD 试剂盒购自南京建成生物工程研究所;ALT、AKP、r-GT、胰岛素以及AST 等相关ELISA 试剂盒购自Bio-Swamp 公司,LDH 试剂盒购自上海谷研实业有限公司,鼠抗兔多克隆抗体SERBF-1、ACCα 和ECL 发光试剂盒购自美国Santa Cruz 公司,相应二抗购于中杉金桥公司。
1.2 方法
1.2.1 非酒精性脂肪肝模型的建立及给药方法
60 只SD 大鼠随机分为正常对照组、模型对照组、富硒灵芝组,造模成功后富硒灵芝组每只大鼠每次给予富硒灵芝水5 mL(1 g 富硒灵芝+10 mL 水煮沸0.5 h,冷却过夜浸泡),每天灌胃二次,模型对照组给予相应生理盐水灌胃参照,空白对照组则不加以任何干涉,分别与6 周和12 周处死大鼠各半,测定其相应指标。
1.2.2 标本的采集
用3%水合氯醛腹腔内注射麻醉,麻醉后无菌操作暴露腹腔,10 mL 注射器心脏迅速取血;血液离心,取上清液,-86 ℃保存;肝脏称取100 mg 用于匀浆提取上清液,其余-86 ℃保存。
1.2.3 病理学检查方法
取肝左叶,10%中性福尔马林溶液固定,肝脏组织酒精脱水,石蜡包埋、切片,HE 染色,光镜下观察肝脏病理学改变,并采取不同视野,每个切片照四张像。
1.2.4 相关指标检测方法
GSH 以及血糖的测定方法为酶法,MDA 测定方法为TBA 法,SOD 的测定方法为WST-1 法,LDH、ALT、AKP、r-GT、胰岛素以及AST 测试方法为双抗体夹心法。
1.2.5 RT-PCR 检测SERBP-1、ACCαmRNA 的表达
取肝脏组织15 mg,用天根总RNA 提取试剂盒提取总RNA,定量后每组各取2 μg 逆转录cDNA,然后用逆转的cDNA 2 μL 为模板,采用PCR Master-Mix 试剂进行PCR 反应扩增SERBP-1 和ACCα 目的片段。PCR 扩增反应条件如下:98 ℃预变性2 min,98 ℃变性10 s、SERBP-1 为46.6 ℃退火(ACCα 为47.8 ℃退火)30 s、72 ℃延伸35 s,循环次数34 次;最后再延伸5 min。PCR 反应产物在含核酸染料(1 μL 核酸染料配比100 mL 琼脂糖溶液)的1.6%琼脂糖凝胶中电泳30 min,电压110 V,电泳完成后用凝胶成像仪拍照采集图像,Image J 软件计算各条带的荧光强度值,以β-actin 作为内参进行标准对照。每组实验重复3 次。
SERBP-1 引物设计为:PrimerA:5' CGTTCGCCATAACCAAGTAGAG 3',PrimerB:5' GGCGATGCTGTACACTGTTGA 3',产物长度为126bps。ACCα 引物设计为:PrimerA:5' AGCGCTACCGTTCCTCTATCAA 3',PrimerB:5' GCTGTAAGAAGCGGATGTAGTCG 3',产物长度为118bps。β-actin 引物设计为:PrimerA:5'GTGACGAGGCCCAGAGCAAGAG-3',PrimerB:5'ACGCAGCTCATTGTAGAAGGTGTGG-3',产物长度为123bps。
1.2.6 Western Blot 检测SERBP-1、ACCα 蛋白的表达
取肝脏组织100 mg 用组织细胞裂解液制作匀浆,BCA 法测定蛋白质含量,取样本SERBP-1 为100 μg(ACCα 为60 μg)进行SDS-PAGE 电泳,半干转法将蛋白转移至PVDF 膜,5%的脱脂牛奶封闭2 h 后加入相应多克隆一抗,摇床剧烈摇半小时后4 ℃过夜,洗膜3 次,每次15 min,加入相应的HRP 标记的二抗孵育,洗涤后与ECL 发光试剂反应,曝光洗片,扫描图像后用Image J 软件计算各条带的灰度值,以βactin 作为内参进行标准对照。每组实验重复3 次。
1.3 统计学处理
所有的数据均用SPSS19.0 统计软件进行处理分析。计量资料均以均数± 标准差()表示。多组间两两比较采用单因素方差分析(one-way ANOVA),方差齐时采用LSD 法,方差不齐时采用Tamhane's T2 法。检验水准=0.05。
2 实验结果
2.1 大鼠肝脏HE 染色比较图
HE 染色可明显看出,模型对照6 周组出现不同程度的脂肪变性及空泡样变,肝细胞极度肿胀呈圆形,体积较空白对照6 周组明显增大;富硒灵芝6周组脂肪变性程度及细胞肿胀明显减轻,炎性细胞浸润及坏死灶较模型对照组明显减少,空白对照6周组看不到任何脂滴及坏死特征;12 周组大鼠肝脏三个组HE 染色图片基本情况与6 周组相似,但富硒灵芝12 周组组比较富硒灵芝6 周组进一步好转,详见图1。

图1 大鼠肝脏HE 染色Fig.1 HE staining of rat liver
2.2 大鼠肝功能比较
2.2.1 治疗6 周后大鼠肝功能比较
治疗6 周后大鼠LDH、AST 以及ALT 富硒灵芝6 周组与模型对照6 周组相比,P<0.05;碱性磷酸酶(AKP)、r-谷氨酰转移酶(r-GT)富硒灵芝组与模型组相比,虽然没有统计学意义,但仍可以看出明显的变化,详见表1。
表1 各组大鼠肝功能治疗6 周指标比较(n=10,)Table 1 Comparison of liver function indicators of different groups with 6 weeks’treatment (n=10,)
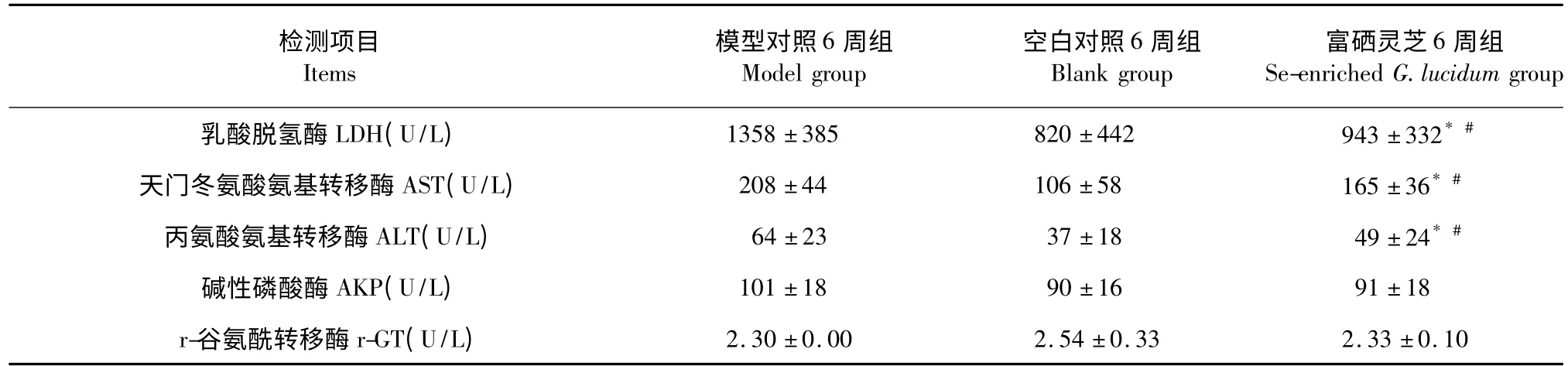
表1 各组大鼠肝功能治疗6 周指标比较(n=10,)Table 1 Comparison of liver function indicators of different groups with 6 weeks’treatment (n=10,)
注:与模型对照组比较,* P<0.05。Note:Compare with model control group,* P<0.05.
2.2.2 治疗12 周后大鼠肝功能比较
治疗12 周后大鼠LDH 与AST、ALT 富硒灵芝12 周组与模型对照12 周组相比,P<0.05,AKP 与r-GT 富硒灵芝12 周组与模型对照12 周组相比,无统计学意义,详见表2。
表2 各组大鼠肝功能治疗12 周指标比较(n=10,)Table 2 Comparison of liver function indicators of different groups with 12 weeks’treatment (n=10,)

表2 各组大鼠肝功能治疗12 周指标比较(n=10,)Table 2 Comparison of liver function indicators of different groups with 12 weeks’treatment (n=10,)
注:与模型对照组比较,* P<0.05。Note:Compare with model control group,* P<0.05.
2.3 大鼠氧化和抗氧化能力比较
2.3.1 治疗6 周后大鼠氧化和抗氧化能力比较
富硒灵芝6 周组血清GSH、血清MDA、肝脏SOD、肝脏MDA 以及肝脏GSH 与模型对照组比较有明显的统计学意义,P<0.05,详见表3。
表3 治疗6 周后大鼠氧化和抗氧化能力比较(n=10,)Table 3 Comparison of oxidation and antioxidant capacity of different groups with 6 weeks’treatment (n=10,)

表3 治疗6 周后大鼠氧化和抗氧化能力比较(n=10,)Table 3 Comparison of oxidation and antioxidant capacity of different groups with 6 weeks’treatment (n=10,)
注:与模型对照组比较,* P<0.05。Note:Compare with model control group,* P<0.05.
2.3.2 治疗12 周后大鼠氧化和抗氧化能力比较
富硒灵芝血清GSH、血清MDA、肝脏SOD、肝脏MDA、肝脏GSH 与模型组相比P<0.05,详见表4。
表4 治疗12 周后大鼠氧化和抗氧化能力比较(n=10,)Table 4 Comparison of oxidation and antioxidant capacity of different groups with 12 weeks’treatment (n=10,)
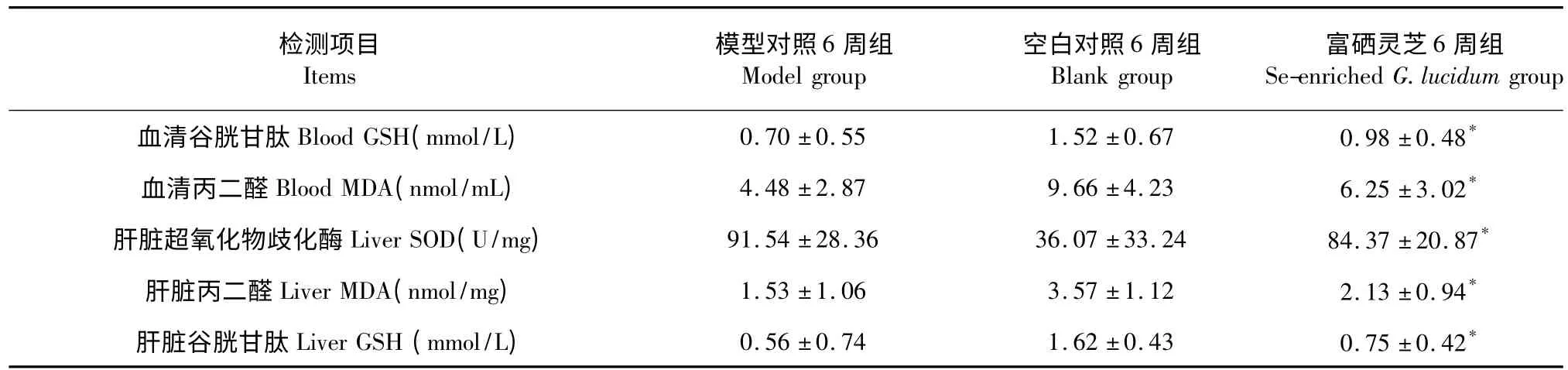
表4 治疗12 周后大鼠氧化和抗氧化能力比较(n=10,)Table 4 Comparison of oxidation and antioxidant capacity of different groups with 12 weeks’treatment (n=10,)
注:与模型对照组比较,* P<0.05。Note:Compare with model control group,* P<0.05.
2.4 SREBF-1 与ACCα mRNA 表达
2.4.1 大鼠SERBF-1 mRNA 表达
与模型对照组相比,富硒灵芝6 周组大鼠肝脏SERBF-1 的mRNA 表达稍有改善,但差别无统计学意义(P >0.05)。12 周SERBF-1 的mRNA 表达与模型对照组相比有明显的统计学意义,经检验P<0.05(图2)。

图2 肝脏组织中SREBF-1 mRNA 的表达Fig.2 Liver SREBF-1 mRNA expression
2.4.2 大鼠ACCα mRNA 表达
与模型对照组相比,富硒灵芝6 周组大鼠肝脏ACCα 的mRNA 表达即具有统计学意义(P<0.05)。12 周ACCα 的mRNA 表达几乎恢复到正常的水平,详见图3。
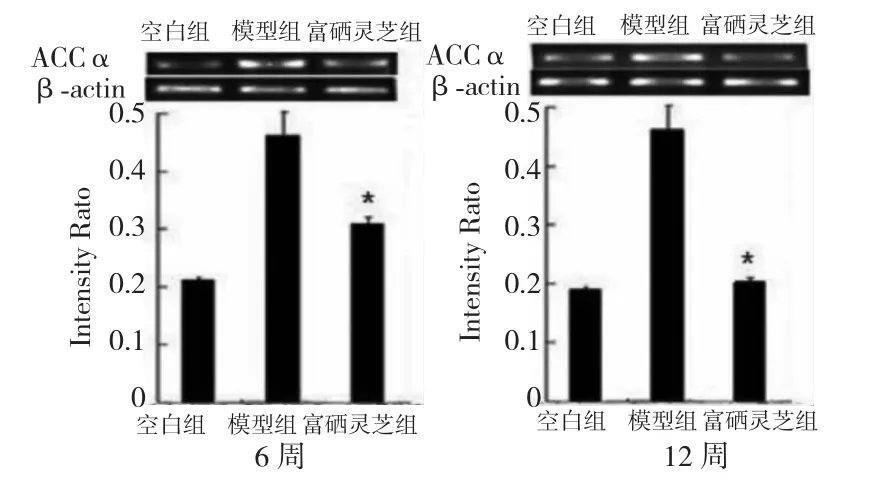
图3 肝脏组织中ACCα mRNA 的表达Fig.3 Liver ACCα mRNA expression
2.5 SREBF-1 与ACCα 酶蛋白表达
2.5.1 大鼠SERBF-1 蛋白表达
富硒灵芝6 周组与模型对照6 周组相比,差别具无统计学意义(P >0.05);12 周富硒灵芝组与模型对照组相比,差距具有统计学意义P<0.05(图4)。
2.5.2 大鼠ACCα 蛋白表达
富硒灵芝6 周组与模型对照6 周组相比,差别具有统计学意义(P<0.05);12 周富硒灵芝组与模型对照组相比,差距也具有统计学意义,同时富硒灵芝12 周组要明显的好于富硒灵芝6 周组,几乎达到了空白对照组的水平(图5)。

图4 肝脏组织中SREBF-1 蛋白的表达Fig.4 Liver SREBF-1 protein expression

图5 肝脏组织中ACCα 蛋白的表达Fig.5 Liver ACCα protein expression

图6 空腹胰岛素抵抗指数Fig.6 Fasting insulin resistance index
2.6 空腹血糖胰岛素抵抗指数
空腹胰岛素抵抗指数比较,6 周时模型组大鼠明显要高于空白组,经富硒灵芝治疗后,只有略微的降低,12 周时富硒灵芝组胰岛素抵抗指数与模型组相比呈现出统计学意义(P<0.05),详见图6。
3 讨论
NAFLD 在临床上指病变主体为肝小叶,以肝实质细胞脂肪变性和脂肪贮积为特征,但却无过量饮酒史的一种病理综合征,其疾病谱包括单纯性脂肪肝(nonalcoholic simple fatty liver,NAFL)、脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、及其相关脂肪性肝纤维化和肝硬化等[3]。2012 年沈峰等[4]在上海国际消化系统疾病会议中报道显示在我国当前城市人口NAFLD 的发生率约31%,我国贫困地区NAFLD 的患病率也在12%左右。早期的研究认为,NAFLD 预后良好,进展缓慢甚者基本不进展。但近来研究显示,NAFLD 如果不加以治疗或预防,可导致约20%的NAFLD 患者进展为肝硬化,其中30%~40%患者死于肝相关疾病[3],因此当前NAFLD已成为威胁我国人民健康的疾病之一。
NAFLD 发病机理的研究,目前医学界普遍接受的是1998 年Day[5]提出的“二次打击学说”,“二次打击学说”分为“第1 次打击”和“第2 次打击”二个部分,“第1 次打击”即指脂肪在肝细胞内过量储积;有研究显示[6],IR 是NAFLD 第一次打击的始动及中心环节,可能贯穿于NAFLD 发病全过程。IR的高低与调节脂肪生成的转录因子SREBF-1 密切相关[7]。胰岛素的高表达是造成SREBF-1 升高的关键,SREBF-1 是调节肝脏脂肪合成有关的酶,其过度表达可使ACCα 的mRNA 表达水平升高,ACCα主要参与脂肪酸的合成[8],它是催化脂肪酸合成的第一步反应,即ACCα 合成丙二酰辅酶A,丙二酰辅酶A 在脂肪酸碳链延长酶系作用下合成长链脂肪酸,促进脂肪变性发生,造成脂肪颗粒在肝脏内聚集,从而导致非酒精性脂肪肝的发生。本文的研究结果提示:用富硒灵芝水给予高脂饮食造成的NAFLD 大鼠治疗,胰岛素抵抗指数在6 周时发生了微小改变,到12 周时呈现出统计学意义,大鼠SREBF-1mRNA 和蛋白变化趋势与胰岛素抵抗指数变化一致,而ACCα mRNA 和蛋白表达则相当明显,其不仅6 周即发生了明显的改变,12 周时ACCα 的表达几乎恢复到正常对照组的水平(P<0.05),分析原因可能是由于富硒灵芝在初始时不可以直接通过降低胰岛素抵抗来直接作用与大鼠SREBF-1 基因的表达,但却可以明显抑制SREBF-1 管控因子ACCα 的表达,通过抑制大鼠ACCα mRNA 和蛋白的表达,有效的保护了脂肪颗粒在肝脏内的积累,而在12 周时,其SREBF-1 的表达呈现出统计学意义(P<0.05),这可能是由于ACCα 的降低,促进了肝脏脂肪颗粒的代谢,从而进一步反作用于SREBF-1的表达,综合提示:富硒灵芝可有效降低大鼠肝脏SREBF-1 与ACCα 的表达,从而减缓了首次打击带来的危害,以达到改善肝功能,保护肝脏的功效。
氧化应激与脂质过氧化损伤是脂肪肝受到第二次打击进一步发展的重要因素[9]。当肝细胞内脂质过度堆积到一定程度时,就会出现以线粒体为中心的一条或多条途径促进氧化应激,导致脂质过氧化,最终加速肝细胞损伤,甚至导致肝细胞死亡及肝纤维化。超氧化物歧化酶(SOD)[10]是超氧离子自由基的专一特效金属歧化酶,通过清除自由基,起到保护机体的作用,它对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基,保护肝细胞免受损伤。脂质过氧化后产生MDA 增加,MDA 增加使细胞内抗氧化剂SOD 消耗增加,含量显著性下降[11]。本文的研究结果显示:富硒灵芝治疗6 周后,与模型对照组相比,血清GSH、血清MDA,肝脏SOD、肝脏GSH 以及肝脏MDA 相比,均发生了明显的改变,P<0.05。富硒灵芝治疗12 周后,血清GSH、血清MDA,肝脏SOD、肝脏GSH 以及肝脏MDA5个指标与模型对照组相比,变化更加明显(P<0.05),其中肝脏SOD 水平几乎回到了正常的水平,结合本次治疗后,肝功能水平的明显好转,综合提示:富硒灵芝可明显提高高脂饮食所诱导的非酒精性脂肪肝病抗氧化能力,降低肝脏二次打击的危害,有效的保护肝脏。
综上所述,本文研究结果显示:富硒灵芝可通过抑制非酒精性脂肪肝病大鼠的肝脏组织ACCα 蛋白的表达,同时减弱二次打击学说中第二次打击对肝脏的进一步伤害,以降低肝脏的氧化能力,提高抗氧化能力,从而达到降低肝异常指数,治疗非酒精性脂肪肝病,但本次治疗周期时间为12 周,提示。富硒灵芝治疗非酒精性脂肪肝可能药效疗程较长,需长期服用。
1 Xiang CG(向昌国),Li WF(李文芳),Ren H(任浩),et al.Selenium content determination in edible parts of crops in Zhangjiajie city.Nat Prod Res Dev(天然产物研究与开发),2012,24:1084-1088.
2 Yang Y(杨洋),Wu XY(吴小勇),Zhang Z(张湛),et al.Fermentation of Ganoderma lucidum for selenium enrichment and the antioxidant capability of the protein product.Mod Food Sci Technol(现代食品科技),2010,26:1349-1353.
3 Zhu LX,Baker SS,Gill C,et al.Characterization of gut microbiomes in nonalcoholic steatohepatitis(NASH)patients:A connection between endogenous alcohol and NASH.Hepatology,2013,57:601-609.
4 Tanwar S,Trembling PM,Thorburn D,et al.PWE-286 Direct serum markers are more accurate than simple marker panels for the detection of fibrosis in non-alcoholic fatty liver disease(NAFLD).Gut,2012,61:A414.
5 Shen F(沈峰),Wang YQ(汪余勤),Fan GJ(范建高).2012 Shanghai international meeting of digestive diseases.Chin J Frontiers Med Sci,Electr Ver(中国医学前沿杂志.电子版),2012,4:1-4.
6 Day CP.Steatohepatitis:a tale of two hits?Gastroenterol,1998,114:842.
7 Polyzos SA,Kountlouras J,Zavos C.Nonalcoholic fatty liver disease:the pathogenedc roles of insulin resistance and adipocytokines.Curr Mol Med,2009,9:299-314.
8 Capel F,Rolland-Valognes G,Dacquet C,et al.Analysis of sterol-regulatory element-binding protein 1c target genes in mouse liver during aging and high-fat diet.J Nutrigenet Nutrigenomics,2013,6:107-122.
9 Lim JS,Mietus-Snyder M,Valente A,et al.The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome.Nat Rev Gastroenterol Hepatol,2010,7:251-264.
10 Koeka GH,Liedorpa PR,Bast A.The role of oxidative stress in non-alcoholic steatohepatitis.Clin Chim Acta,2011,412:1297-1305.
11 Kathirvel E,Chen P,Morgan K,et al.Oxidative stress and regulation of anti-oxidant enzymes in cytochrome P4502E1 transgenic mouse model of non-alcoholic fatty liver.J Gastroenterol Hepatol,2010,25:1136-1143.
