复方蜥蜴散不同微粒组合剂对胃癌前病变模型大鼠Wnt 信号通路中Wnt2、β-catenin、Cyclin-D1 蛋白表达的影响
2014-01-10王延丽朱西杰蔡根深肖清燕李美丽
王延丽,朱西杰,蔡根深,肖清燕,王 儒,李美丽
宁夏医科大学中医学院,银川 750004
胃癌前病变(Gastric Precancerous Lesions,GPL)是一个病理性概念,包括肠上皮化生(Intestinal Metaplasia,IM)和异型增生(Dysplasia,Dys),目前认为主要是不完全性结肠型化生及中、重度异型增生,主要发生在慢性萎缩性胃炎(Chronic Atrophic Gastritis,CAG)演变过程中,是正常胃黏膜向胃癌演变的一个重要阶段。胃癌前病变的临床表现与慢性萎缩性胃炎相似,主要表现为胃痛、胃胀、心下痞满,满闷不舒,嗳气等症,其表现与“痞满”、“胃痛”相似。于1989 年10 月在江西庐山召开的全国中医内科学会第五届全国脾胃病学术会议上将胃癌前病变归属于“胃痞”范畴。
胃癌前病变其病因为物理、化学及生物性因素长期反复作用于人体所致,西医治疗效不明显。目前认为无论何种损伤因素通过何种方式作用于胃黏膜,最终结果都是造成细胞的功能破坏,使细胞的增殖和凋亡失衡造成黏膜损伤。Wnt2、β-catenin、Cyclin-D1 是增殖调节基因,因此Wnt2、β-catenin、Cyclin-D1 在细胞内的表达是决定细胞发生增殖凋亡的重要因素。我们临床应用宁夏密点麻蜥组成的验方复方蜥蜴散不同微粒组合剂(以下简称复方蜥蜴散)治疗胃癌前病变取得了良好的疗效。本研究旨在应用免疫组化法,观察该验方对胃癌前病变模型大鼠胃黏膜细胞增殖蛋白Wnt2、Cyclin-D1、β-catenin 表达的影响,探讨其对胃癌前病变的治疗机制,为临床治疗提供依据。
1 材料与仪器
1.1 动物
SPF 级雄性SD 大鼠120 只,4~6 周龄,体重150~180 g,SPF 大小鼠生长繁殖饲料,均由宁夏医科大学实验动物中心提供。
1.2 药物及试剂
药物:N-甲基-N'-硝基-N-亚硝基胍(MNNG):东京化成工业株式会社。维酶素(新乡恒久远药业有限公司)。复方蜥蜴散:由蜥蜴粉、鹿角霜粉、海螵蛸粉、炒白术粉、半枝莲粉等组成,由宁夏医科大学中医消化病研究所提供。0.9%氯化钠溶液:吉林省都邦药业股份有限公司。
试剂:兔抗大鼠多克隆Wnt2 抗体,购自santa cruz 生物技术公司。兔抗大鼠多克隆β-catenin 抗体、兔抗大鼠多克隆Cyclin-D1 抗体购自美国Immunoway 生物技术公司。通用型二步法免疫组化检测试剂盒,DAB 显色试剂盒,柠檬酸盐缓冲液,PBS 磷酸盐缓冲液,均购自北京中杉金桥生物技术有限公司。
1.3 主要仪器与设备
石蜡切片机(上海莱卡公司);超低温冰箱(广东科龙电器公司);隔水式恒温培养箱(上海精宏实验设备有限公司);高压蒸汽消毒锅(广东Galanz 公司);电热恒温培养箱(上海跃进医用光学仪器厂);漂烘片机(常州市雅博电子设备有限公司);孵育盒(湿盒)(福州迈新生物技术开发有限公司);病理组织包埋冷冻台(常州中威电子仪器厂);图像采集系统显微镜(日本OLYMPUS 公司)。
2 实验方法
2.1 动物分组
120 只SPF 级SD 雄性大鼠,随机分为6 组,即正常对照组、复方蜥蜴散80 目治疗组、100 目治疗组、80 目和100 目等量混合治疗组、胃癌前病变模型对照组、维酶素治疗组,编为A-F 组,每组20 只,相同条件下分笼饲养,SPF 大小鼠生长繁殖饲料喂养,自由饮水,室温(20 ±2)℃,湿度55%~60%。
2.2 药物配制
MNNG 溶液:按0.017 mol/L 浓度的MNNG 溶液。维酶素混悬液:维酶素片研末,用生理盐水配成0.1 g/mL 的混悬液。复方蜥蜴散不同微粒组合剂混悬液:复方蜥蜴散80 目、100 目、80 目和100 目等量混合物经过粉碎、高温灭菌、蒸2.5h,晾干后,用双蒸水分别配成0.14 g/mL 糊剂混悬液装瓶。均4℃冰箱保存备用。
2.3 造模方法及治疗方法
2.3.1 PLGC 模型的建立
参阅大量的文献资料[1,2],具体造模方法:以0.017 mol/L 的MNNG 溶液,按0.5 mL/100 g 体重对大鼠灌胃,每日一次,连续8 周,辅助采取2 日饱食、l 日饥饿的饥饱失常法,饱食日自由食用,饥饿日禁食不禁水,并不时给予情绪刺激因素,A 组大鼠充足供应标准颗粒饲料及清洁蒸馏水。
2.3.2 治疗措施
造模8 周后,证实符合胃癌前病变的病理诊断(见图4 中HE)。A 组大鼠仍然充足供食及水,B组、C 组、D 组大鼠分别给予复方蜥蜴散80 目、100目、80 目100 目等量混合糊剂混悬液10 mL/kg·d灌胃;E 组大鼠开始给予0.9%氯化钠溶液10 mL/kg·d 灌胃;F 组大鼠给予0.1 g/mL 维酶素混悬液10 mL/kg·d(1.0 g/kg·d)灌胃。各1 次/天,连续用药12 周。
2.4 标本采集和处理
2.4.1 标本采集
实验进行至预定阶段,大鼠禁食水24 h 后,全部用10%水合氯醛溶液腹腔内注射麻醉大鼠。剖腹,距贲门和幽门1.5 cm 离断取出全胃。沿胃大弯侧剖开,冰生理盐水冲洗后,滤纸吸干铺开。胃黏膜标本固定于10%的中性福尔马林溶液中,胃体部取2 cm ×5 mm 纵切条状组织,固定24 h 后,梯度脱水,石蜡包埋备用。常规HE 染色做病理组织学检验,邻近切片做免疫组化染色。
2.4.2 免疫组化染色
Wnt2 与β-catenin、Cyclin-D1 免疫组化染色步骤采用通用型二步法,步骤如下:①将实验用切片置于60 ℃恒温电烤箱中过夜(12~16 h)。切片按步骤依次脱蜡水化。②高压法抗原热修复:枸橼酸抗原修复液修复。③消除内源性过氧化物酶的影响:每张切片加入1 滴(50 μL)3% H2O2,室温或37 ℃孵育10 min。PBS 洗3 min ×3 次。④消除非特异性染色:每张切片加1 滴(50 μL)的正常山羊非免疫性血清封闭,室温或37 ℃孵育10 min。⑤加“一抗”:甩去血清,每张切片加1 滴(50 μL)新鲜配制的一抗,置于湿盒内放入4 ℃冰箱孵育过夜。⑥将湿盒从4 ℃冰箱中取出,放入37 ℃电热恒温箱中复温45 min。PBS 洗5 min ×3 次。⑦加二抗:甩去PBS 液,每张切片加1 滴(50 μL)二抗工作液,室温或37 ℃孵育30 min。PBS 冲洗,3 min×3 次。⑧显色:甩去PBS 液,每张切片加2 滴(100 μL)新鲜配制的DAB 染色液,2~10 min 后显微镜下观察,有阳性显色即用自来水冲洗中止显色。⑨复染:按步骤要求进行复染和脱水。⑩封片:二甲苯透明5 min后凉干,中性树胶封片。
Wnt2 抗体使用浓度为1:100;β-catenin 抗体使用浓度为1∶150;Cyclin-D1 抗体使用浓度为1∶100。
2.5 图像采集分析方法与统计方法
2.5.1 图像采集分析方法
采用数码显微镜捕捉免疫组化图片(jpg 格式):采用Image-Pro Plus 6.0 图像分析系统,每张切片随机选取5个高倍视野测定阳性区域图像的平均光密度(AOD)。图像分割与自动计算:选定分割范围后,点击“分割”按钮选择手动分割,根据IHC 阳性染色区域的不同,通过RGB 颜色直方图来调节分割的范围及阈值。点击“自动计算”,对已分割好的图像自动测定阳性区域的光学密度值。
2.5.2 统计结果处理
统计数据均应用SPSS18.0 统计软件进行分析。人工计数方法所得结果采用非参数秩和检验比较,图像采集分析方法所得结果用单因素方差分析处理,所有计量资料呈正态分布,结果用表示,组间比较经方差其同性检验后采用成组t 检验;多组间比较当各组方差齐时用LSD 法进行均数间的两两比较,当各组方差不齐时用Dunnett 法进行均数间的两两比较。以P<0.05 为有统计学意义。
3 实验结果
3.1 各组大鼠Wnt2 免疫组化染色统计结果
Wnt2 蛋白阳性信号呈棕黄色,主要出现在细胞胞质及胞膜。正常对照组大鼠胃黏膜有极少量阳性细胞即细胞质染色。维酶素组和复方蜥蜴散组大鼠胃黏膜部分细胞可见黄色、褐色程度不同的染色,与模型组比较染色较浅。模型组细胞染色最重。见图1(W-A~W-F)。统计结果:通过图像分析系统对免疫组化图像光密度的测算,B、C、D 各组细胞Wnt2蛋白的阳性表达率显著与E 组有显著差异(P<0.01),D 组细胞Wnt2 蛋白的阳性表达率显著与F组有显著差异(P<0.01)。见表1。

图1 正常组(W-A)、TCLP 80 目组(W-B)、TCLP 100 目组(W-C)、TCLP 80 +100 目组(W-D)、模型组(WE)及维酶素(W-F)Wnt2 蛋白阳性表达Fig.1 Expression of Wnt2 in control group (W-A),TCLP-80 group (W-B),TCLP-100 group (W-C),TCLP-80+100 group (W-D),model group (W-E)and vitacoenzyme group (W-F)
表1 各组大鼠Wnt2 蛋白表达的平均光密度比较()Table 1 Average optical density of Wnt2 protein expression in each group ()
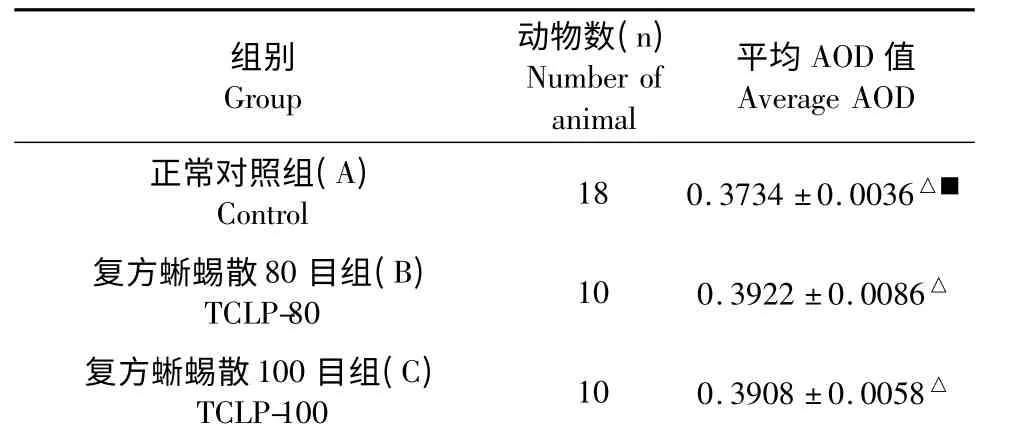
表1 各组大鼠Wnt2 蛋白表达的平均光密度比较()Table 1 Average optical density of Wnt2 protein expression in each group ()

注:各治疗组与模型E 组比较,▲P<0.05,△P<0.01;与维霉素F 组比较,◆P<0.05,■P<0.01。Note:Compared with model,▲P<0.01,△P<0.01;Compared with vitacoenzyme group,◆P<0.05,■P<0.01.
3.2 各组大鼠β-catenin 免疫组化染色统计结果
β-catenin 阳性信号主要定位于细胞-细胞接触侧的细胞膜,在胞质仅有很弱的表达,而在胃癌前病例中可见β-catenin 的异常表达,即在细胞质和细胞核中表达增强。免疫组化结果显示,维酶素组和复方蜥蜴散组大鼠胃黏膜部分细胞可见黄色、褐色程度不同的染色,与模型组比较染色较浅。模型组细胞染色最深。见图2(B-A~B-F)。统计结果:通过图像分析系统对免疫组化图像光密度的测算,B、C、D 各组细胞β-catenin 蛋白的阳性表达率与E 组有显著差异(P<0.01),D 组细胞β-catenin 的阳性表达率与F 组有显著差异(P<0.01)。见表2。
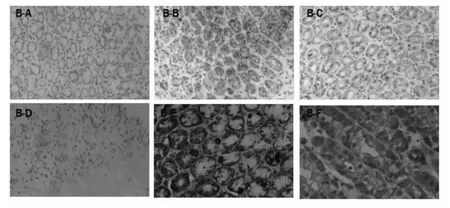
图1 正常组(B-A)、TCLP 80 目组(B-B)、TCLP 100 目组(B-C)、TCLP 80 +100 目组(B-D)、模型组(B-E)及维酶素(B-F)组β-catenin 蛋白阳性表达Fig.2 Expression of β-catenin in control group (B-A),TCLP-80 group (B-B),TCLP-100 group(B-C),TCLP-80 +100 group (B-D),model group (B-E)and vitacoenzyme group (B-F)
表2 各组大鼠β-catenin 蛋白表达的平均光密度比较()Table 2 Average optical density of β-catenin protein expression in each group ()

表2 各组大鼠β-catenin 蛋白表达的平均光密度比较()Table 2 Average optical density of β-catenin protein expression in each group ()
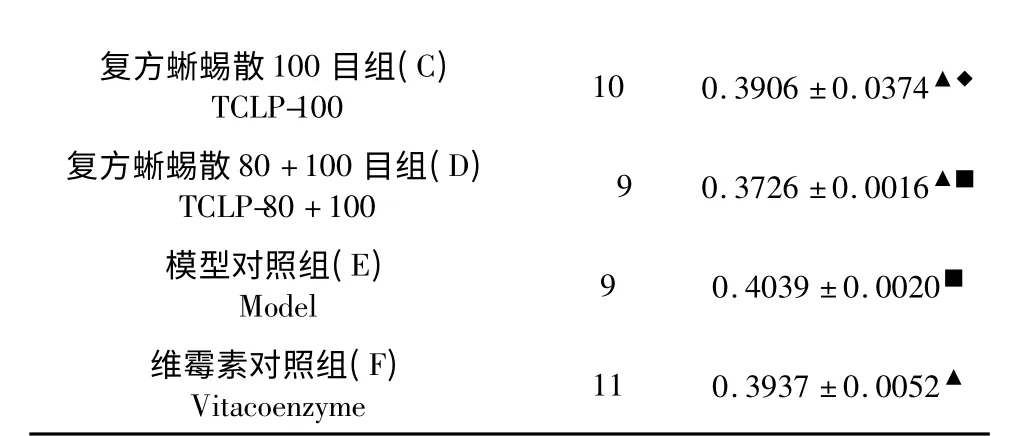
注:各治疗组与模型E 组比较,▲P<0.01;与维霉素F 组比较,◆P<0.05,■P<0.01。Note:Compared with model,▲P<0.01;Compared with vitacoenzyme group,◆P<0.05,■P<0.01.
3.3 各组大鼠Cyclin-D1 免疫组化染色统计结果
Cyclin-D 1 蛋白阳性着色位于细胞浆和细胞核,细胞核呈棕黄色细小颗粒着色为阳性细胞,免疫组化结果显示,维酶素组和复方蜥蜴散组大鼠胃黏膜部分细胞可见黄色、褐色程度不同的染色,与模型组比较染色较浅。模型组细胞染色最深。见图3(C-A~C-F)。阴性对照片无表达。见图4 中Y-1。统计结果:通过图像分析系统对免疫组化图像光密度的测算,B、C、D 各组细胞Cyclin-D1 蛋白的阳性表达率与E 组有显著差异(P<0.01),D 组细胞Cyclin-D1 蛋白的阳性表达率与F 组有显著差异(P<0.05)。见表3。

图3 正常组(C-A)、TCLP 80 目组(C-B)、TCLP 100 目组(C-C)、TCLP 80 +100 目组(C-D)、模型组(C-E)及维酶素(C-F)Cyclin-D1 蛋白阳性表达Fig.3 Expression of Cyclin-D1 in control group (C-A),TCLP-80 group(C-B),TCLP-100 group (C-C),TCLP-80 +100 group (C-D),model group (C-E)and vitacoenzyme group (C-F)
表3 各组大鼠Cyclin-D1 蛋白表达的平均光密度比较()Table 3 Average optical density of Cyclin-D1 protein expression in each group ()

表3 各组大鼠Cyclin-D1 蛋白表达的平均光密度比较()Table 3 Average optical density of Cyclin-D1 protein expression in each group ()

注:各治疗组与模型E 组比较,▲P<0.01;与维霉素F 组比较,◆P<0.05,■P<0.01。Note:Compared with model,▲P<0.01;Compared with vitacoenzyme,◆P<0.05,■P<0.01.
3.4 染色图片
各个蛋白因子均表现为:正常对照A 组大鼠胃黏膜有少量阳性细胞染色,且染色最浅,维酶素F组和复方蜥蜴散B、C、D 各组大鼠胃黏膜部分细胞可见黄色、褐色程度不同的染色,与模型组比较染色较浅。模型E 组细胞染色最重。图4 中HE 图片显示细胞不规则,核大深染,核浆比例失调,核分裂象增多,出现高级别异型增生的异常细胞。图4 中Y-1 示正常细胞表现。

图4 造膜后HE 染色图片和阴性对照图片Fig.4 HE staining images of model and negative control
4 讨论
细胞增殖和凋亡是中医阴阳学说在细胞分子水平上的体现。人体正常胃黏膜上皮组织更新较快,以细胞凋亡和增殖维持着细胞总数的平衡,若这一平衡失调,就有可能导致疾病的发生。从正常胃黏膜、轻度不典型增生、重度不典型增生、癌前病变、早期胃癌到进展期胃癌的发展过程中,细胞凋亡逐渐受抑制,细胞恶性增生逐渐显现,胃黏膜病变细胞凋亡减少,生存期延长,细胞大量堆积。细胞增殖指数逐渐增大,凋亡指数逐渐减小,增殖指数/凋亡指数比值增大是衡量胃癌发生、浸润及转移的可靠指标。同时也显现出抑制凋亡的基因表达增加,促进凋亡的基因表达受到抑制[3]。肿瘤是细胞增殖相对超过其凋亡造成的,凋亡发生及调控是细胞中多种分子之间相互作用的结果。
Wnt 信号通路由一系列癌基因和抑癌基因编码的蛋白质组成,各种蛋白质之间彼此联系、相互制约。经典的Wnt 通路贯穿于细胞生长、增殖、分化、凋亡及转移的关键途径,Wnt2、β-catenin、Cyclin-D1为Wnt/β-catenin 信号通路中重要的组成成分,它们在调节细胞增殖,抑制细胞分化及调控细胞周期中起重要作用[4]。Wnt 基因编码的Wnt2 蛋白是启动这一传导通路的信号蛋白,它与细胞增殖分化关系最为密切,其异常启动可产生致癌作用。β-catenin被认为是经典Wnt 通路中的关键蛋白及其在胞浆内主要的效应分子,对细胞增殖分化的调控作用在胚胎发育和肿瘤发生中已受到广泛关注,在Wnt 信号通路中是正向调节因素。正常情况下,β-catenin通过与E-cadherin 形成复合物定位于细胞膜的胞浆面而介导细胞间的黏附;当细胞被Wnt 蛋白配体激活后,Wnt2 的表达上调能够使胞浆内β-catenin 免受降解,稳定化,在胞浆内积聚,移位到核内,与T细胞因子结合,增强一些在正常细胞增殖中起重要作用的基因的转录,诱发癌变。β-catenin 是Wnt 信号传导途径中最为关键的调控子,其除了介导细胞粘附外还参与基因表达,当β-catenin 在细胞核内异常蓄积并活化基因时β-catenin 基因就成了癌基因。Wnt/β-catenin 信号通路的异常激活是人类肿瘤发生的重要机制之一,β-catenin 异常蓄积正是此通路激活的主要表现。β-catenin 介导的Wnt 信号转导通路异常激活导致肿瘤发生是肿瘤早期事件。Cyclin-D1 是Wnt 通路下游的关键靶基因,是细胞周期蛋白家族中调控细胞周期G1 期的关键蛋白,生命个体细胞周期的关键是G1 期的启动,而细胞周期调控异常与细胞癌变密切相关。Cyclin-D1 的主要功能是促进细胞增殖,其过度表达可致细胞增殖失控而恶性化,在多种肿瘤发生发展及浸润转移中扮演重要角色[5],并且已被公认为是一种原癌基因。Wnt 通路致癌的关键是β-catenin 降解障碍致使胞浆内游离的β-catenin 聚集并与Tcf/Lef 结合进入细胞核,启动下游靶基因Cyclin-D1 的转录,导致肿瘤的发生。
本研究显示在胃癌前病变模型大鼠中,Wnt2、βcatenin、Cyclin-D1 存在着高表达,经过复方蜥蜴散治疗后,能显著降低Wnt2、β-catenin、Cyclin-D1 蛋白的阳性表达率,并且80 目与100 目不同微粒等量组合在各治疗组中效果最好(P<0.05)。Wnt2、βcatenin、Cyclin-D1 表达下降提示复方蜥蜴散可能通过抑制增殖基因的激活,控制和维持细胞的正常生长,阻断胃癌前病变病变细胞的增殖,促进胃癌前病变病变细胞的凋亡,从而逆转胃黏膜损伤的病理生化指标,修复胃黏膜损伤,防止胃癌前病变的发生及发展。
胃癌前病变的形成是一个长期慢性病变过程,脾胃虚弱是其病理演变的关键,脾胃本弱,加之调养失当,外邪侵袭等因素,导致中气更虚,气虚不足以行血,则血行迟缓,逐渐形成壅滞成瘀。因瘀血阻络使得胃黏膜腺体血运障碍、营养匮乏,致各种毒素产物的聚集,因此导师立法益气养阴、化瘀解毒,并根据胃癌前病变病程、疗程均较长,中药煎剂费时费力很不方便又不经济,患者往往依从性差,《临证指南医案》中“慢性疾患,以汤剂荡涤,速而不达,乃胃气不受药之故”,“积滞宜温下者,以散剂徐攻,免伤胃气”,“丸剂、膏剂缓图,以保胃气”。因此在胃癌前病变胃黏膜损伤的修复中,散剂的治疗作用优于汤剂、丸剂,基于此种认识,导师组成复方蜥蜴散,而散剂中颗粒的大小是影响其作用关键因素,经临床及实验证实过80 目筛和过100 目筛的粗细不同颗粒的结合才是较好的治疗药物剂型。通过药物颗粒大小的不同使中药制剂口服后可以延长其药效及作用于胃肠道的时间,加上采用糊剂给药形式,使药物能够很好的粘附在胃黏膜上,形成保护膜,发挥修复及逆转黏膜增生、肠化的作用。
本实验研究结果表明,复方蜥蜴散中君药蜥蜴具养精血、破结散瘀、行气活血、清热解毒,有抗癌作用,能明显增强人体免疫功能,消除胃肠道症状,对胃肠道有特殊的亲和力和靶向治疗作用[6];臣以黄芪补气生血、托毒生肌、利水消肿;白术益气健脾、燥湿利水,白芍补血敛阴、平肝止痛;三者合用益气养阴,健脾利湿,既扶助正气,又提高胃肠动力,促进胃排空,加速水湿瘀血等“毒性”物质的排出,减少刺激性物质损伤胃黏膜,邪祛而正不伤;丹参活血祛瘀生新,消痈排脓止痛,三七活血定痛、化瘀止血、消肿生肌,两者合用可改善胃黏膜微循环,促进胃黏膜损伤的再生修复。佐以半枝莲清热解毒,利湿杀“虫”;乌梅养阴柔肝止痛,健胃生酸助运化;鹿角霜补中益血、通利血脉;海螵蛸制酸止痛、收湿敛疮。使以甘草调和诸药的同时,既可增强半枝莲清热解毒之效,又助黄芪、白术补中益气,还可增强白芍缓急止痛的功效。现代药理学研究结果发现:从黄芪中提取的黄芪多糖可通过调节细胞免疫功能来增强IL-2/LAK 抗肿瘤作用,通过促进抗癌素的分泌、IL-2R 受体的表达、LAK 前体细胞的增生而达到抗肿瘤作用;白术对免疫系统的作用主要是抗炎、抗肿瘤、抗氧化,白术甲醇提取物能够诱导人T 淋巴瘤Jurkat 细胞、U937 和HL-60 白血病细胞凋亡,而达到抗肿瘤的作用;从丹参中提取出的脂溶性有效成分丹参酮òA 具有抑制多种肿瘤细胞(白血病细胞、实体瘤细胞等)增殖,诱导细胞凋亡和/或分化的作用[7];三七皂苷可通过直接抑制肿瘤细胞生长与转移、诱导肿瘤细胞凋亡与分化、增强和刺激机体免疫功能等多重机制抗肿瘤。半枝莲主要在增强机体免疫力、抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡等方面发挥抗肿瘤作用[8]。诸药合用益气养血扶正,化瘀解毒祛邪,黏膜得养,毒瘀得散,肠化、增生得消,有效干预甚至逆转癌前病变,避免癌症的发生。且临床疗效确切、安全性好、毒副作用小、长期服用总有效率在90%以上,也证实了我们对其修复作用的判断[9,10]。
1 Yuan HX(袁红霞),Liu CM(刘彩梅),Liu QJ(刘清君),et al.Discuss the construction method of gastric precancerous lesions in rat models.J China Modern Medicine(中国当代医药),2009,16(19):9-10.
2 Xie JR(谢晶日),Sun F(孙芳),Liang GY(梁国英).Research progress of gastric precancerous lesions in animal models.J Chin Arch of TCM(中华中医药学刊),2012,30:2377-2378.
3 Liu G(刘钢),Yuan YN(袁又能).Apoptosis relationship with the occurrence and development of gastric cancer.J of Chin Prac Diag and Ther(中华实用诊断与治疗杂志),2010,24:629-631
4 Deng YZ,Chen PP,WangY,et al.Connective tissue growth factor is overexpressed in esophageal squamous cell carcinoma and promotes tumorigenicity through B-catenin-T-cell factor/Lef signaling.J Biol Chem,2007,282:36571-36581.
5 Yasuyoshi Miyata,Takahisa Iwata,Kojiro Ohba,et al.Expression of matrix metalloproteinase-7 on cancer cells and tissue endothelial cells in renal cell carcinoma:prognostic implications and clinical significance for invasion and metastasis.J Clin Cancer Res,2006,12:6998-7003.
6 Zhu XJ(朱西杰),Yang LX(杨利侠),Liang Y(梁岩),et al.Application of lizard to the treatment for pathological changes of gastric mucosa.Shanxi J TCM(山西中医),2003,19(2):48.
7 Li L(李力),Yang YM(羊裔明),Deng CQ(邓承祺),et al.The vitro studies of tanshinone IIA induced MR2 cell differentiation and apoptosis.Chin J Hematol(中华血液学杂志),2003,24:45-46.
8 Niu GX(牛国晓),Li J(李洁).Research progress on anticancer effect of scuteiiaria barbata and its mechanism.J Cancer Rese on Pre and Trea(肿瘤防治研究),2012,39:231.
9 Liang Y(梁岩),Yang LX(杨利侠),Zhu XJ(朱西杰).The clinical observation of the repair function that the protect the stomach membrane medicine paste to the damaged gastric mucosa.Ningxia Med J(宁夏医学杂志),2003,25:106.
10 Li WQ(李卫强),Wei XH(魏雪红),Zhu XJ(朱西杰).The different combination of compound lizards powder treatment precancerous lesions of gastric carcinoma combination with Yin collaterals and Winding stasis in 120 cases.Liaoning J TCM(辽宁中医杂志),2011,38:2224.
