青蒿素及其衍生物抗肿瘤作用研究进展
2014-01-10周洁芸
周洁芸,朱 焰
上海市计划生育科学研究所生殖药理组国家卫生与计划生育委员会计划生育药具重点实验室 上海生殖健康药具工程技术研究中心,上海 200032
恶性肿瘤是严重威胁人类健康的常见病和多发病。根据世界卫生组织报告,全世界每年有1000 万新增癌症病例,因肿瘤而死亡者达700 多万人,到2020 年,全世界癌症发病率将是现在的两倍。目前对恶性肿瘤的药物治疗以化学合成药物为主,但其开发费用昂贵、毒副作用大,病人常难以承受。近年来,植物来源的药物引起人们关注,它们不仅具有独特的生理活性,较好的疗效和较低的毒性,更为化学合成,化学修饰提供了新颖独特的化学结构。
青蒿素(artemisinin)又名黄蒿素,是从菊科植物黄花蒿(Artemisia annua L.)中提取分离得到的一种具有过氧桥结构的倍半萜内酯类化合物[1]。常见青蒿素衍生物(图1)如二氢青蒿素(dihydroartemisinin)、青蒿琥酯(artesunate)、蒿甲醚(artemether),均是治疗疟疾的有效单体,目前已成为治疗疟疾的一线药物[1,2]。随着对青蒿素及其衍生物药理作用研究的不断深入,发现其还具有抗肿瘤活性方面的巨大价值。近年来,一些结构新颖的新型青蒿素衍生物被合成,它们多具有更高的抗肿瘤活性并逐渐引起人们的关注。本文就青蒿素衍生物最新合成状况、抗肿瘤作用的基础与临床研究予以综述。
1 新型青蒿素衍生物的合成状况
1973 年,我国科学家屠呦呦为主首创的第一个青蒿素衍生物——二氢青蒿素成功问世,随后研究发现,在保留过氧的条件下,内酯环的羰基还原成羟基可以增效,再在羟基上引进乙酰基,抗疟活性可进一步提高,提示在保留过氧基团的情况下,修饰部分结构可提高生物活性,这为青蒿素衍生物的创制提供了新思路。目前,对青蒿素的结构改造都是在保留过氧基团的基础上进行的,主要集中在9 位、10位,其中,以10 位的修饰最为常见。这些青蒿素衍生物主要分为:酯类、醚类、肽类、二聚体及多聚体等。任彦荣[3]将溴代乙酰化糖与二氢青蒿素醚在四丁基硫酸氢铵催化下合成了5 种糖基化青蒿素衍生物3a~3e(图1),这些衍生物具有水溶性具有水溶性高,毒性低的优点。蒿甲醚、蒿乙醚存在半衰期短、生物利用度差、毒副作用较高的缺点,但青蒿素10 位取代基以碳原子代氧原子,可增强水解稳定性,并可延长半衰期并降低毒副作用。O'Neill PM[4]合成了一系列10 位碳取代含氟青蒿素衍生物(图2),这些化合物除具有以上优点外,还显示出很好的抗疟活性。另外,增加过氧桥结构的数量能增强其抗疟和抗肿瘤活性,Wang SS[5]合成了6 种青蒿素二聚体衍生物6a~6f(图3),其中6h 的抗肿瘤活性比青蒿琥酯高出600 倍。
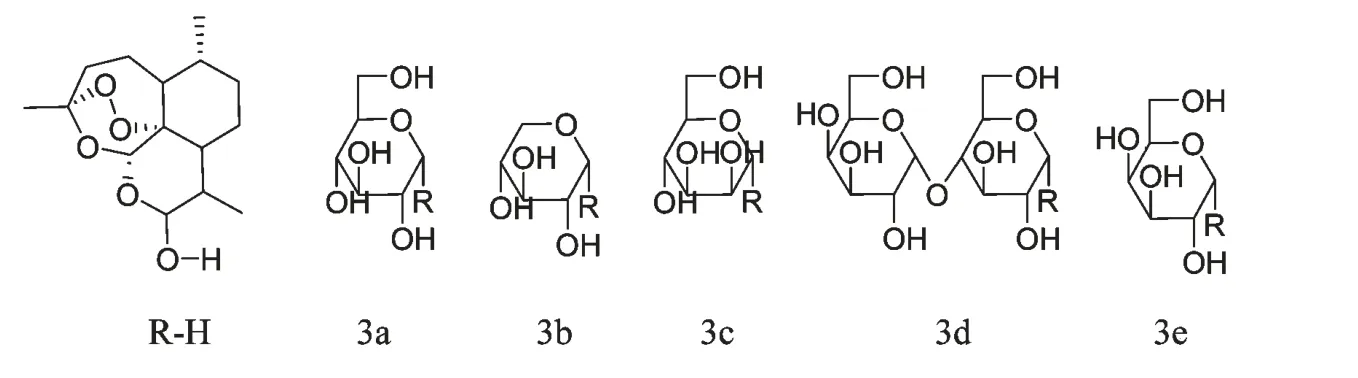
图1 糖基化青蒿素衍生物3a~3eFig.1 Glycosylated Artemisinin Derivatives
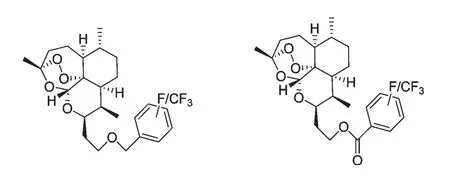
图2 含氟青蒿素衍生物Fig.2 Fluorinated Artemisinin Derivatives
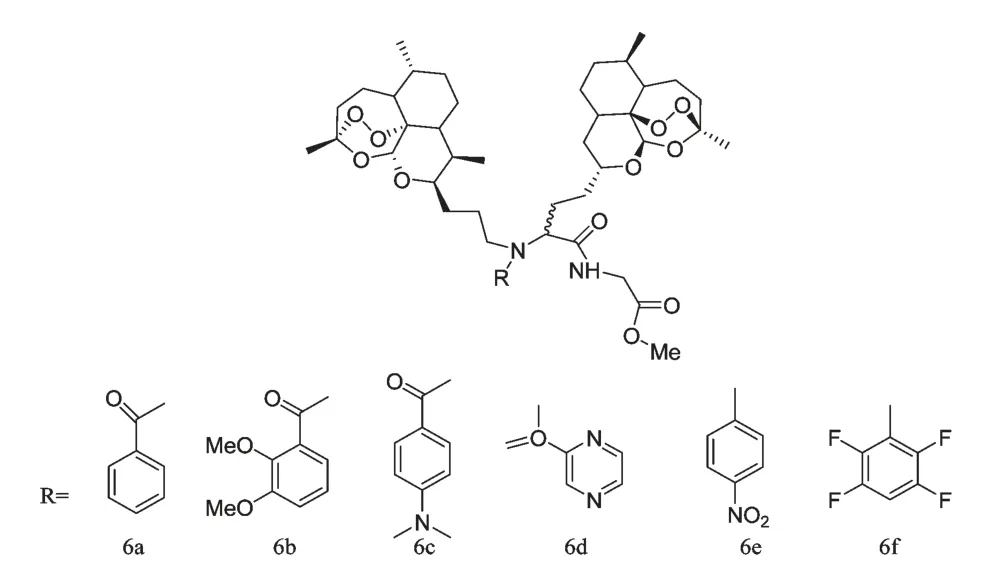
图3 青蒿素二聚体衍生物6a~6fFig.3 Artemisinin Dimmer Derivatives 6a~6f
2 青蒿素衍生物抗肿瘤生物活性研究现状
2.1 体外研究
国内外大量研究表明,新型青蒿素衍生物对体外培养的多种肿瘤细胞均具有较强的抑制作用。这些新型青蒿素衍生物与常见的青蒿素衍生物相比,抗肿瘤活性大大增强,有些甚至优于目前常用的化疗药物。Galal AM 等[6]合成了12 种双氢青蒿素缩醛二聚体6~17(图4),并由美国国立癌症研究所(National Cancer Institute,NCI)对60 种人肿瘤细胞株进行体外抗肿瘤活性测定,显示对白血病、非小细胞肺癌、结肠癌、中枢神经系统肿瘤、黑素瘤、卵巢癌、肾癌、前列腺癌、乳腺癌敏感,细胞生长半数抑制浓度(GI50)在0.019~8.7 μM 范围内。Goswami A[7]以10 位脱氧青蒿素醛为先导化合物,通过Baylis–Hillman 反应合成了7 种青蒿素衍生物6、7a、7b、8、9a、9b、10(图5),在50 μM 浓度下,化合物10 对结肠癌(colo-205)生长抑制率(GI)达100%,对非小细胞肺癌(A-549)GI 达85%;化合物7b 对前列腺癌(PC-3)GI 达78%;化合物9a、9b 对前列腺癌(PC-3)GI 达71%,抗肿瘤活性高于紫杉醇、阿霉素等抗肿瘤药物。Blazquez AG[8]在双氢青蒿素结构基础上对C10 位进行结构修饰,合成了8 种新型青蒿素衍生物AD1~AD8(图6),并对其进行体外抗肿瘤和抗病毒实验,研究结果发现AD5 不但具有毒性较低的优点,而且对肝癌细胞(HepG2、SK-HEP-1)和结肠癌细胞(LS174T)有很强的抑制增殖的作用,IC50在1~5 μM 范围内。另有5 种衍生物(AD1>AD2 >AD7 >AD3 >AD8)能抑制BVDV 病毒RNA 释放;AD1 和AD4 在无毒性浓度下能抑制HBV 病毒DNA 释放。
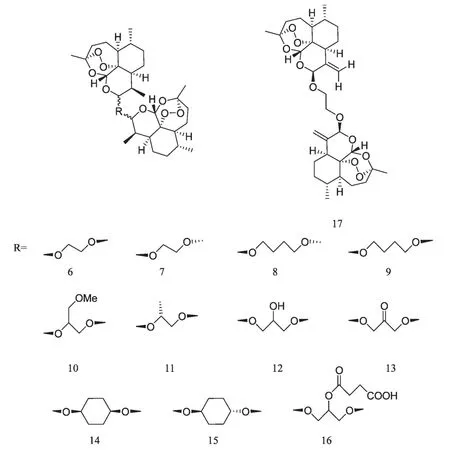
图4 青蒿素缩醛二聚体6~17Fig.4 Artemisinin Acetal Dimer Derivatives 6-17
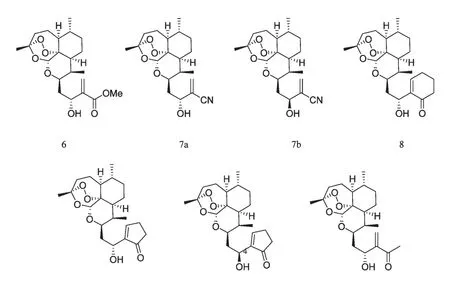
图5 青蒿素衍生物6、7a、7b、8、9a、9b、10Fig.5 Artemisinin Derivatives 6、7a、7b、8、9a、9b、10

图6 青蒿素衍生物AD1~AD8Fig.6 Artemisinin Derivatives AD1-AD8
2.2 体内研究
目前针对动物体内试验多集中于某些常见的青蒿素衍生物,如二氢青蒿素、青蒿琥酯等。人们发现,这些衍生物不但在动物体内具有较好的抗肿瘤活性,效果与化疗药物相当,而且动物对其耐受性高于化疗药物[9]。青蒿素衍生物还能增强化疗药物的疗效,且对某些耐药株的增效效果更强[10]。一些新型青蒿素衍生物在体外研究的基础上,动物体内研究也逐步开展起来。Galal AM[6]根据体外研究结果,选择了四种新型青蒿素二聚体12、14、15、16(图4),由美国NCI 对12 种人肿瘤细胞株进行动物体内抗肿瘤活性评价,通过中空纤维测定法(hollow fiber assay)初步评价其药效,结果显示化合物14 的抗肿瘤活性最强,疗效同紫杉醇相当,且化合物12、14、16 对白血病动物移植瘤模型的最大相对肿瘤增值率T/C%均低于40%。李英[11]最新合成的一种新型青蒿素二聚体SM1052(图7),以10 mg/ kg,每周腹腔注射给予3 次,用于治疗子宫内膜癌(RL95-2)移植瘤裸鼠,连续给药4 周后,抑瘤率达63.5%。Ren YR[12]通过糖基化作用合成出一种青蒿素糖苷,发现这种新型衍生物对宫颈癌U14 裸鼠移植瘤有较好的抑制作用,且抑瘤效果呈现出时间-剂量依赖效应。
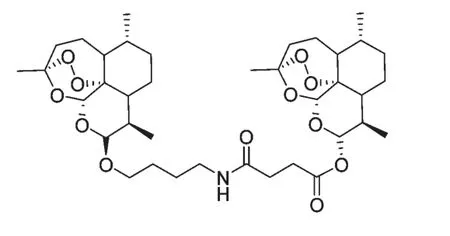
图7 青蒿素二聚体衍生物SM1052Fig.7 Artemisinin Dimmer Derivatives SM1052
2.3 临床研究现状
青蒿素及其衍生物进入生物体内,具有吸收快、分布广、排泄快的特点。目前在临床上主要应用于恶性疟、多药抗性疟、脑性疟的治疗。近年来在大量实验室研究基础上已经初步开展了一些常见青蒿素衍生物抗肿瘤的临床应用研究。新型青蒿素衍生物由于还需进一步进行动物体内药效及安全性评估研究,目前临床报道鲜见。Singh NP[13]最先报道青蒿琥酯治疗1 例Ⅱ期喉鳞状上皮癌病人,治疗前15 d每天肌内注射60 mg 青蒿琥酯,并在第1 d 口服硫酸亚铁150 mg 和叶酸0.5 mg,其后每天口服青蒿琥酯片50 mg,治疗2 周后吞咽困难和发音障碍明显减轻,颈部淋巴结节减小,2个月后肿瘤体积缩小70%。随后,他又报道用蒿甲醚治疗1 例垂体大腺瘤患者,每日1 次口服蒿甲醚40 mg,治疗12个月后,肿瘤密度明显降低(由治疗前72~77 HU 降至51~59 HU),患者视觉、听觉、行动明显改善[14]。Berger TG[15]以青蒿琥酯辅助标准化疗法治疗1 例Ⅳ黑色素瘤患者,在应用达卡巴嗪(Dacarbazine)联合青蒿琥酯后,脾脏和肺部转移灶逐渐消退,治疗生存期长达47个月,远远超过Ⅳ期黑色素瘤患者2~5个月的中位生存期。在国内,一项对120 例中晚期非小细胞肺癌的随机对照研究显示[16]:青蒿琥酯(120 mg,静注,1 次/天,第1~8 d)联合NP 化疗方案治疗至少2个周期后的1 年生存率比单纯NP 化疗方案提高13%,同时联合化疗组可显著提高患者疾病控制率并延长疾病进展时间。胡莉文[17]用青蒿鳖甲汤煎剂联合常规化疗方案(VDP 或VDLP)治疗11 例急性B 淋巴细胞白血病,治疗4 周后,患者骨髓细胞CD34、幼稚细胞表达率及CD22、CD19 表达显著下降,且降幅较常规化疗组更明显。张妮[18]最新研究也发现青蒿鳖甲汤联合抗肿瘤药和唑来膦酸治疗30 例肺癌骨转移患者可明显缓解疼痛,提高活动能力,改善生活质量,减轻放化疗等治疗引起的不良反应。青蒿素衍生物虽然在临床抗肿瘤治疗上已初见疗效,但是仍缺乏新药临床药理评价,今后还有待进一步进行Ⅰ~Ⅳ期临床试验研究,为青蒿素类抗肿瘤药物上市做前期准备。
3 青蒿素衍生物抗肿瘤机理研究进展
近年来对青蒿素类化合物抗肿瘤机制的研究众多,但其确切的作用机制仍未知。目前研究表明,其抗肿瘤机制主要包括氧化损伤、诱导肿瘤细胞周期阻滞、引发细胞凋、抑制新生血管生成、抑制细胞侵袭和转移、阻断细胞信号转导通路等多个方面。
3.1 氧化损伤反应
青蒿素是一种带过氧基团的新型倍半萜内酯类化合物,“过氧基团”是其发挥抗疟作用的有效部位。青蒿素及其衍生物能在二价铁离子存在下诱导青蒿素过氧键断裂,产生大量活性氧簇(reactive oxygen species,ROS)和以青蒿素碳原子为中心的自由基,这些自由基引起细胞氧化性损伤,最终导致细胞死亡[19]。Moore JC[20]最先报道了口服联合应用二氢青蒿素和硫酸亚铁,能显著抑制大鼠移植性纤维肉瘤的生长,而单用二氢青蒿素的抑制效果不明显。Lu JJ 等[21]发现去铁敏预处理人白血病细胞(HL-60)6 h,可有效拮抗二氢青蒿素引起的细胞凋亡。恶性肿瘤细胞对铁的需求量比正常细胞大得多,细胞对铁的吸收与细胞表面转铁蛋白受体(TfR)有关,增殖旺盛的肿瘤细胞通过高表达TfR 获得大量铁用于自身增殖。利用转铁蛋白(Tf)和TfR 特异性结合原理,Xie WL[22]制备出一种新的青蒿素衍生物与Tf 偶联的靶向药物DBAH-Tf,并用MTT 分析DBAH-Tf 对人乳腺癌细胞(MCF-7)和正常乳腺细胞的杀伤作用,结果表明DBAH-Tf 对MCF-7 的杀伤作用是正常乳腺细胞的286 倍,具有很好的靶向作用。
3.2 诱导肿瘤细胞周期阻滞、细胞凋亡
细胞周期调控异常与细胞癌变密切相关,有学者提出肿瘤是一类细胞周期疾病(cell cycle disease)。诱导细胞周期阻滞是抑制肿瘤细胞增殖的重要机制。大量研究表明[23-26],青蒿素能引起乳腺癌、皮肤癌A431、前列腺癌、胰腺癌(BxPC-3、PANC-1)细胞停滞于G0/G1期。Jiang Z[24]指出,这种调节机制是通过下调细胞周期蛋白A1、B、D1和蛋白激酶Cdk2、4、6,上调周期阻滞蛋白p21、p27 的表达,从而使细胞阻滞在G0/G1期。另外,NF-kappaB 失活导致下游蛋白如细胞周期蛋白D1和c-MYC 的减少也可能是其主要机制[26]。青蒿素也能诱导细胞发生G2/M 期阻滞。如青蒿琥酯能下调细胞周期蛋白B1的mRNA 表达,使肺癌细胞A549 引起G2/M 期细胞阻滞[27]。二氢青蒿素对肝癌细胞的体内和动物体外抑制实验表明,周期阻滞蛋白p21 表达增多、细胞周期蛋白B 和CDC25C 磷酸酶表达下降,使细胞发生G2/M 期阻滞抑制细胞增殖[28]。青蒿素能引起肿瘤细胞不同时期的细胞周期阻滞,这种差异可能与细胞来源、给药剂量的不同有关,但青蒿素能诱导肿瘤细胞周期阻滞已被多数学者认同,使人们对细胞增殖及其与癌症的关系有了更深刻的理解。
诱导肿瘤细胞凋亡是大多数抗肿瘤药物共同机制之一,是抑制细胞增殖的另一重要机制。研究表明,青蒿素类化合物可诱导多种不同来源的肿瘤细胞凋亡。Mao ZG[29]用青蒿琥酯作用于大鼠垂体腺瘤GH3 细胞,用DNA 荧光染料对细胞染色,可观察到凋亡小体,且凋亡率呈时间依赖效应。Zhang CZ[28]经体外试验证实二氢青蒿素能诱导肝癌细胞(HepG2、PLC/PRF/5、Hep3B)凋亡,通过线粒体膜去极化,从而释放细胞色素C、激活caspase3、caspase9,并导致DNA 断裂。另外,p53 和Bcl-2 家族蛋白也参与了诱导凋亡的过程。青蒿琥酯能通过Bak 介导caspase 非依赖性途径诱导人肺癌细胞(ASTC-a-1、A549)的凋亡[30]。He Q[31]报道了二氢青蒿素可激活死亡受体DR5 和线粒体介导的细胞凋亡通路,并可增强死亡配体TRAIL/Apo-2L 对前列腺癌细胞的杀伤作用。青蒿素类化合物诱导细胞凋亡是多环节、多途径的,它们之间的相互作用关系,确切作用的靶点,目前还不是很清楚,有待进一步研究。
3.3 抑制肿瘤新生血管生成
肿瘤的生长与转移依赖血管生成,建立丰富的血液循环,以供应肿瘤组织异常旺盛的生化代谢以及瘤细胞的繁殖与转移。因此,抑制血管生成能有效地抑制肿瘤的生长和转移,抗血管生成疗法成为了治疗肿瘤的新策略。Cheng R[32]等通过碱烧伤法建立大鼠角膜血管生成模型,在给予青蒿琥酯治疗11 天后发现能显著抑制角膜新生血管的生成,并指出可能通过诱导血管内皮细胞凋亡发挥作用。青蒿素类化合物也具有抗肿瘤新生血管生成的作用[10,33]。血管内皮生长因子(VEGF)是最强的促肿瘤血管生成因子,在人类多种肿瘤细胞中呈现高表达。VEGF 作为最重要的血管生长因子之一,成为近年来的研究热点。二氢青蒿素能呈浓度-时间依赖性抑制人神经胶质瘤细胞U87 增殖,同时还可抑制U87 迁移、管腔形成和VEGF mRNA 表达[33]。二氢青蒿素还可抑制VEGF 受体KDR/flk-1 mRNA 和蛋白表达水平[34]。TNF-α 和组织缺氧能激活VEGF mRNA 表达并促进VEGF 的合成。青蒿琥酯能抑制Akt 磷酸化,通过抑制激活PI3-K/Akt 从而抑制由TNF-α 和组织缺氧引起的缺氧诱导因子(HIF-1α)和VEGF 高表达[35]。
3.4 抑制肿瘤细胞侵袭、转移等
侵袭(invasion)、转移(metastasis)是恶性肿瘤最本质的特性,因此,有效控制侵袭和转移时治疗肿瘤的有效途径之一。Tan WF 证明[36],青蒿素能显著抑制肿瘤细胞侵袭和转移。划痕实验表明青蒿素能显著抑制肝癌细胞(HepG2、SMMC-7721)迁移进入受伤裸露区的数量。重组基底膜侵袭实验亦显示青蒿素显著抑制HepG2、SMMC-7721 的迁移。青蒿素通过抑制金属基质蛋白酶MMP2、诱导金属基质蛋白酶组织抑制剂TIMP2 蛋白表达、激活E-钙连接素发挥作用。多药耐药(multidrug resistance,MDR)是一种在许多恶性肿瘤中都有高表达的现象,在临床化疗中是难以克服的问题。Michaelis M[37]指出青蒿琥酯能有效抑制耐药神经母细胞瘤的生长。Reiter C[38]最新合成了一种新的青蒿素衍生物,在体外用于P-糖蛋白高表达的人白血病细胞,发现这种衍生物可逆转肿瘤细胞的多药耐药性,且不存在交叉耐药现象。另外,有研究报道青蒿琥酯还具有放射增敏作用[39],目前其作用机制还不是很清楚,有待进一步研究。
3.5 阻断肿瘤细胞信号转导通路
肿瘤发生与发展是一个多因素、多基因参与,经多个阶段才最终形成的,及其复杂的生物学现象。信号传导的异常能够引起细胞过度增殖、浸润与转移、血管形成以及凋亡的抑制。最新研究成果表明,二氢青蒿素在浓度为3 μM 时,能显著抑制横纹肌肉瘤细胞(Rh30、RD)的增殖,其作用机制主要是通过阻断mTORC1 介导的信号转导通路途径抑制肿瘤细胞生长,是一个新型mTORC1 抑制剂[40]。Thanaketpaisarn O[41]指出,青蒿琥酯能增强TRAIL诱导的人子宫颈癌细胞(Hela)凋亡,其作用机制可能与抑制NF-kB 和PI3K/Akt 信号转导通路途径相关。信号传导药物具有选择性强、不良反应小等优点,尤其对晚期或转移癌可能具有独特的疗效,正成为极具吸引力的研究热点。随着青蒿素类化合物对肿瘤细胞信号转导通路研究的不断深入,将其研制成新型信号传导抑制剂也是一个非常值得开发的领域。
4 青蒿素及其衍生物的毒性和不良反应
经过长期、大规模临床临床应用,青蒿素被认为是低毒安全的药物[42,43]。自1991~1995 年在泰国进行的一项研究显示,对3662 名患有恶性疟疾受试者口服给予青蒿琥酯或蒿甲醚12 mg/kg,连续服用超过7 天后,未发现任何与药物相关的毒副作用[43]。2001 年报道的两例口服青蒿琥酯出现严重变态反应的病例,是迄今最严重的毒副作用的报道[44]。在动物试验中,长期并大剂量使用青蒿素及其衍生物具有神经毒性。Akinlolu AA[45]对20 只成年Wistar 大鼠肌内注射25 mg/kg 蒿甲醚,连续7 d后,脑干斜方体损伤密度明显增多,动物平衡和协调能力差。White TE 指出,妊娠第10~14 d 是大鼠器官发生敏感期,此期间每天口服给予青蒿琥酯30 mg/kg 至妊娠第21 d,有明显的胚胎毒性,能导致心血管和骨骼发育畸形[46]。目前虽然在临床上没有致畸的报道,WHO 建议在妊娠前3个月的孕妇避免使用青蒿素类药物。Efferth T[47]认为,由于至今缺乏针对青蒿素罕见的,但可能存在显著毒性的临床大规模监测数据,所以还不能最终确定青蒿素类药物的安全性。另外,肌内注射油制剂由于释放缓慢,药物暴露时间长,毒性更大。口服给药消除迅速,血药浓度维持时间短,所以更安全。
青蒿素类药物抗肿瘤谱广,在体内、外对多种肿瘤细胞的生长均具有明显抑制作用,一些新型青蒿素衍生物治疗效果甚至优于目前常用的化疗药物;对部分多药耐药株亦具有杀伤作用,联合化疗时能使药效协同增强,同时还具有放疗增敏作用;并且其毒副作用小、成本较低,预示其极可能成为具有临床应用价值的抗癌新药。随着对肿瘤细胞恶性变化过程中新靶点和调控关键点的深入发现,开发具有靶向性青蒿素类药物将成为今后的研究热点。对青蒿素类药物抗肿瘤分子机制研究的不断深入,由于该类化合物存在一定的神经和胚胎毒性,通过结构修饰或剂型改变开发具有靶向性青蒿素类药物以期获得更好疗效和更低毒性,也应是未来努力的方向。此外,还应加强青蒿素类药物临床前安全性评价以及抗肿瘤临床研究,进一步明确青蒿素类药物抗肿瘤性质及不良反应,确定最佳给药方案、剂量。我们期待青蒿素类药物能为恶性肿瘤的治疗带来新的曙光,造福于人类。
1 Miller LH,Su X.Artemisinin:discovery from the Chinese herbal garden.Cell,2011,146:855-858.
2 Amin NC,et al.Determination of artemether and lumefantrine in anti-malarial fixed-dose combination tablets by microemulsion electrokinetic chromatography with short-end injection procedure.Malar J,2013,12:202.
3 Ren YR (任彦荣).Synthesis of the Glycosylated Artemisinin Derivatives.Chinese J Synth Chem (合成化学),2012,04:504-507.
4 O'Neill PM,et al.Novel,potent,semisynthetic antimalarial carba analogues of the first-generation 1,2,4-trioxane artemether.J Med Chem,1999,42:5487-5493.
5 Wang SS,Sasaki T.Synthesis of artemisinin dimers using the Ugi reaction and their in vitro efficacy on breast cancer cells.Bioorg Med Chem Lett,2013,23:4424-4427.
6 Galal AM,et al.Synthesis and evaluation of dihydroartemisinin and dihydroartemisitene acetal dimers showing anticancer and antiprotozoal activity.Bioorg Med Chem,2009,17:741-751.
7 Goswami A,et al.Synthesis of a novel series of highly functionalized Baylis-Hillman adducts of artemisinin with potent anticancer activity.Tetrahedron Lett,2013,54:4221-4224.
8 Blazquez AG,et al.Novel artemisinin derivatives with potential usefulness against liver/colon cancer and viral hepatitis.Bioorg Med Chem,2013,21:4432-4441.
9 Xu Q,et al.Artesunate inhibits growth and induces apoptosis in human osteosarcoma HOS cell line in vitro and in vivo.J Zhejiang Univ Sci B,2011,12:247-255.
10 Zhang JL,et al.DHA regulates angiogenesis and improves the efficiency of CDDP for the treatment of lung carcinoma.Microvasc Res,2013,87:14-24.
11 Li Y (李英),et al.Artemisinin dimmer nitrogen atoms,their preparation and use ZL,201110034154.9,2013-7-24.
12 Ren YR,Chen GP.Synthesis and Study of Antitumor Activity of Artimisinin Glucoside.Lett Drug Des Discov,2012,9:749-754.
13 Singh NP,Verma KB.Case report of a laryngeal squamous cell carcinoma treated with artesunate.Arch Oncol,2002,10:279-280.
14 Singh NP,Panwar VK.Case report of a pituitary macroadenoma treated with artemether.Integr Cancer Ther,2006,5:391-394.
15 Berger TG,et al.Artesunate in the treatment of metastatic uveal melanoma--first experiences.Oncol Rep,2005,14:1599-1603.
16 Zhang ZY,et al.Artesunate combined with vinorelbine plus cisplatin in treatment of advanced non-small cell lung cancer:a randomized controlled trial.Zhong Xi Yi Jie He Xue Bao,2008,6:134-138.
17 Hu LW (胡莉文),et al.Effect of Therapy of Nourishing Yin and Expelling Pathogens on CD Antigen Expression in Bone Marrow of Acute Type B Lymphocytic Leukemia Patients at Remission Stage.J Guangzhou Univ Tradit Chin Mde(广州中医药大学学报),2011,04:366-368.
18 Zhang N (张妮),et al.Qinghao Biejia Decoction in the treatment of lung cancer with bone metastasis.Modern Journal of Integrated Traditional Chinese and Western Medicine(现代中西医结合杂志),2013,18:2019-2020.
19 Mercer AE,et al.Evidence for the involvement of carboncentered radicals in the induction of apoptotic cell death by artemisinin compounds.J Biol Chem,2007,282:9372-9382.
20 Moore JC,et al.Oral administration of dihydroartemisinin and ferrous sulfate retarded implanted fibrosarcoma growth in the rat.Cancer Lett,1995,98:83-87.
21 Lu JJ,et al.Dihydroartemisinin induces apoptosis in HL-60 leukemia cells dependent of iron and p38 mitogen-activated protein kinase activation but independent of reactive oxygen species.Cancer Biol Ther,2008,7:1017-1023.
22 Xie WL,et al.Visual characterization of targeted effect of holo-transferrin-tagged dihydroartemisinin on human breast cancer cells.Chinese Sci Bull,2010,55:2390-2395.
23 Mao H,et al.Involvement of the mitochondrial pathway and Bim/Bcl-2 balance in dihydroartemisinin-induced apoptosis in human breast cancer in vitro.Int J Mol Med,2013,31:213-218.
24 Jiang Z,et al.Artesunate induces G0/G1 cell cycle arrest and iron-mediated mitochondrial apoptosis in A431 human epidermoid carcinoma cells.Anticancer Drugs,2012,23:606-613.
25 Morrissey C,et al.Effect of artemisinin derivatives on apoptosis and cell cycle in prostate cancer cells.Anticancer Drugs,2010,21:423-432.
26 Wang SJ,et al.Dihydroartemisinin inactivates NF-kappaB and potentiates the anti-tumor effect of gemcitabine on pancreatic cancer both in vitro and in vivo.Cancer Lett,2010,293:99-108.
27 Zhao Y,et al.Artesunate enhances radiosensitivity of human non-small cell lung cancer A549 cells via increasing NO production to induce cell cycle arrest at G2/M phase.Int Immunopharmacol,2011,11:2039-2046.
28 Zhang CZ,et al.Dihydroartemisinin exhibits antitumor activity toward hepatocellular carcinoma in vitro and in vivo.Biochem Pharmacol,2012,83:1278-1289.
29 Mao ZG,et al.Artesunate inhibits cell proliferation and decreases growth hormone synthesis and secretion in GH3 cells.Mol Biol Rep,2012,39:6227-6234.
30 Zhou C,et al.Artesunate induces apoptosis via a Bak-mediated caspase-independent intrinsic pathway in human lung adenocarcinoma cells.J Cell Physiol,2012,227:3778-3786.
31 He Q,et al.Dihydroartemisinin upregulates death receptor 5 expression and cooperates with TRAIL to induce apoptosis in human prostate cancer cells.Cancer Biol Ther,2010,9:819-824.
32 Cheng R,et al.The artemisinin derivative artesunate inhibits corneal neovascularization by inducing ROS-dependent apoptosis in vascular endothelial cells.Invest Ophthalmol Vis Sci,2013,54:3400-3409.
33 Chen XR,et al.Dihydroartemisinin suppresses cell proliferation,invasion,and angiogenesis in human glioma U87 cells.Afr J Pharm Pharmaco,2012,6:2433-2440.
34 Zhou HJ,et al.Dihydroartemisinin improves the efficiency of chemotherapeutics in lung carcinomas in vivo and inhibits murine Lewis lung carcinoma cell line growth in vitro.Cancer Chemother Pharmacol,2010,66:21-29.
35 He Y,et al.The anti-malaria agent artesunate inhibits expression of vascular endothelial growth factor and hypoxia-inducible factor-1 alpha in human rheumatoid arthritis fibroblastlike synoviocyte.Rheumatol Int,2011,31:53-60.
36 Tan WF,et al.Artemisinin inhibits in vitro and in vivo invasion and metastasis of human hepatocellular carcinoma cells.Phytomedicine,2011,18:158-162.
37 Michaelis M,et al.Anti-cancer effects of artesunate in a panel of chemoresistant neuroblastoma cell lines.Biochem Pharmacol,2010,79:130-136.
38 Reiter C,et al.New artesunic acid homodimers:Potent reversal agents of multidrug resistance in leukemia cells.Bioorg Med Chem,2012,20:5637-5641.
39 Reichert S,et al.A radiosensitizing effect of artesunate in glioblastoma cells is associated with a diminished expression of the inhibitor of apoptosis protein survivin.Radiother Oncol,2012,103:394-401.
40 Odaka Y,et al.Dihydroartemisinin inhibits the mammalian target of rapamycin-mediated signaling pathways in tumor cells.Carcinogenesis,2014,35:192-200.
41 Thanaketpaisarn O,et al.Artesunate enhances TRAIL-induced apoptosis in human cervical carcinoma cells through inhibition of the NF-κB and PI3K/Akt signaling pathways.Int J Oncol,2011,39:279-285.
42 Ogbonna A,Uneke CJ.Artemisinin-based combination therapy for uncomplicated malaria in sub-Saharan Africa:the efficacy,safety,resistance and policy implementation since Abuja 2000.Trans R Soc Trop Med Hyg,2008,102:621-627.
43 Price R,et al.Adverse effects in patients with acute falciparum malaria treated with artemisinin derivatives.Am J Trop Med Hyg,1999,60:547-555.
44 Leonardi E,et al.Severe allergic reactions to oral artesunate:a report of two cases.Trans R Soc Trop Med Hyg,2001,95:182-183.
45 Akinlolu AA,Shokunbi MT.Neurotoxic effects of 25mg/kg/bodyweight of artemether on the histology of the trapezoid nuclei and behavioural functions in adult male Wistar rats.Acta Histochem,2010,112:193-198.
46 White TE,Clark RL.Sensitive periods for developmental toxicity of orally administered artesunate in the rat.Birth Defects Res B Dev Reprod Toxicol,2008,83:407-417.
47 Efferth T,Kaina B.Toxicity of the antimalarial artemisinin and its dervatives.Crit Rev Toxicol,2010,40:405-421.
