放线菌Snea253 代谢产物及寡糖对南方根结线虫活性的影响
2014-01-09李玲玉刘晓宇陈井生段玉玺陈立杰
李玲玉,赵 迪,刘晓宇,陈井生,3,段玉玺,陈立杰*
1沈阳农业大学植物保护学院 北方线虫研究所;2沈阳农业大学理学院,沈阳 110866;3 黑龙江农科院大庆分院,大庆 163316
根结线虫(Meloidogyne spp.)广泛分布于世界各地,寄主植物有3000 余种,黄瓜番茄等各类蔬菜、烟草、果树和观赏植物等都是其良好寄主[1]。根结线虫病是世界农业生产上危害最严重的一类线虫病害,对我国的蔬菜、经济作物等种植已造成严重威胁。但是针对根结线虫病的有效化学农药如涕灭威、溴甲烷等陆续被禁用或限制使用,因此寻找替代的高效低度低残留的有效药剂成为当今世界研究热点。目前生产中推广使用的阿维菌素—链霉菌产生的抗生素是较为理想的防治药剂,但是阿维菌素对根结线虫卵无效。因此,寻找新的生物杀线剂,尤其是从放线菌的代谢产物中筛选高效低毒的生物杀线剂成为防治植物线虫病的重要发展方向[2]。
放线菌中以链霉菌属(Streptomyces)产生的生物活性物质最多。如阿维菌素是由灰色链霉菌(Streptomyces avermitilis)发酵产生的大环内酯类抗生素[3]。目前已陆续发现几种对线虫有活性的放线菌代谢产物。放线菌Snea253 菌株(委内瑞拉链霉菌Streptomyces venezuelae)是本实验室前期从土壤中分离得到的具毒杀植物线虫活性的高效菌株,其代谢物对大豆胞囊线虫(Heterodera glycines)、南方根结线虫(Meloidogyne incognita)和北方根结线虫(M.hapla)的J2 均具有较高的生物活性,并且能够抑制大豆胞囊线虫卵的孵化[4,5]。经初步对其杀线虫活性物质进行分离纯化、结构解析,认为其可能含有氨基寡酸的糖类活性物质(待发表),因此本文重点研究其代谢产物中杀线虫活性物质及已知寡糖类物质对南方根结线虫的活性。
寡糖素(Oligosaccharins)是Alberhseim 教授于1985 年首次提出的概念,活性寡糖具有调控植物生长、发育、繁殖、防病和抗病等多方面的功能[6]。各种活性寡糖可发出调节特定功能的信息,激活防御反应、诱导植物抗病性,调控植物生长,产生具有抗病害的活性物质,抑制病虫害的形成和侵染,寡糖在农业生产上显示出广阔的应用前景[7]。鉴于本研究中Snea253 菌株发酵液中活性物质可能含有寡糖类物质,因此将此活性物质与已知寡糖共同测试对南方根结线虫卵孵化和J2 活性的影响,以明确寡糖类物质对植物线虫的毒力作用,为植物线虫病害生物防治研究中生物杀线剂的研制提供新的理论支持。
1 材料与方法
1.1 供试菌株
放线菌Snea253 菌株,菌株及其制备方法已获得国家发明专利授权(ZL200810010465.X)。
1.2 放线菌Snea253 菌株发酵产物中活性物质的粗提取
用50 L~100 L 发酵罐GUGS-50 进行发酵,在28 ℃下培养,初始pH 为6,转速150 r/min,发酵5~7 d。将放线菌Snea253 菌株发酵液浓缩10 倍,浓缩液和无水乙醇置于4 ℃冰箱中预冷12 h,再将两者按1:5 混合充分摇匀静置于4 ℃冰箱中12 h。取出混合液除去沉淀并用RE-52AA 旋转蒸发仪将乙醇蒸掉,将所得的预处理液用CoolSafe55-4 冷冻干燥仪冷冻干燥成粉末。用HC-ADS-7 大孔吸附树脂吸附样品中的色素,去离子水洗脱,收集液体并冷冻干燥即得粗提物,备用。
1.3 放线菌Snea253 杀线虫活性物质的成分分析
1.3.1 试管法分析活性物质[8]
取Snea253 粗提物样品溶液1 mL 于试管中,加入显色剂,不同化合物发生不同的显色反应,从而鉴别其中化合物成分。用α-萘酚试剂和斐林试剂检查糖及苷;茚三酮试剂和双缩脲试剂检查氨基酸、多肽和蛋白质;碘化铋钾试剂检查生物碱;三氯化铁试剂检查酚类;盐酸-镁粉试剂和醋酸铅试剂检查黄酮及甙;Borntrager 试剂和醋酸镁试剂检查蒽醌及甙;碱性3,5-二硝基苯甲酸试剂和碱性苦味酸试剂检查强心苷;异羟肟酸铁试剂检查内酯、香豆素及甙;氯化钠-明胶试剂和新鲜石灰水试剂检查鞣质;泡沫试剂和氯仿-浓硫酸试剂检查皂甙;冰醋酸-硫酸试剂和氯仿-浓硫酸试剂检查甾体萜类;挥发油试剂和油脂试剂检查挥发油和油脂。
1.3.2 薄层层析法预试[8]
将Snea253 粗提物样品点样到硅胶薄层层析板上,用乙酸乙酯:甲醇:水:冰乙酸(V:V:V:V)=12:5:1:1 作展层剂,在层析缸内充分展开。硅胶板干燥后,喷显色剂,各种化合物遇特异显色剂显示出特有的颜色,方法如上,从而判断化合物的类型。
1.4 已知寡糖的选择
所选用寡糖均为分析纯,分别为D(+)半乳糖、D-果糖、D(+)木糖、L-山梨糖、D(+)麦芽糖、D(+)葡萄糖、乳糖和蔗糖。所用寡糖溶液的浓度与Snea253 活性物质的浓度相同,均为5 mg/mL。
1.5 南方根结线虫卵囊和二龄幼虫的获得
在温室中用盆栽番茄繁殖南方根结线虫(番茄品种为L402)。第一代卵囊成熟后,将番茄根系取出,用水轻轻冲洗,小心挑取卵囊。卵囊在0.5%次氯酸钠中消毒3 min,无菌水反复冲洗3 次,将消毒的部分卵囊置于自制孵化池中备用。
另一部分卵囊放在自制的孵化池中,孵化池放在少量无菌水的灭菌培养皿里,25 ℃恒温箱中培养,每隔24 h 收集一次新孵化的南方根结线虫J2,置于灭菌的培养皿中制成J2 线虫悬液备用。
1.6 活性物质及寡糖溶液对南方根结线虫卵囊中卵孵化的影响
取新鲜饱满大小均一的消毒卵囊,每2 个消毒卵囊放入一个消毒孵化池中,再将孵化池放入盛有测试溶液的灭菌培养皿中,测试溶液包括5 mg/mL的Snea253 发酵液粗提取后的活性物质和5 mg/mL各类寡糖溶液各1 mL,以无菌水处理作为对照,为尽可能的减少皿中液体的蒸发,培养皿用封口膜密封,每个处理重复3 次。将放有卵囊的培养皿置于25 ℃恒温箱中,7 d 后计数线虫孵化总数,计算孵化相对抑制率。

1.7 活性物质及寡糖溶液对南方根结线虫J2 的影响
在经过高温灭菌的贝氏小皿中放入活泼的南方根结线虫J2,各加入1 mL 的活性物质和寡糖溶液,以无菌水作为空白对照,每个处理重复3 次。各处理的贝氏小皿放入25 ℃恒温培养箱中,24 h 后计数线虫的死亡率,计算线虫校正死亡率,采用毛针碰触和NaOCl 刺激法来判断线虫的死活。

2 结果与分析
2.1 放线菌Snea253 代谢产物中活性物质的成分分析结果
对放线菌Snea253 发酵液中活性物质的化学成分进行试管预试和薄层层析,结果见表1、表2。通过试管法(表1)可知:α-萘酚试验呈紫红色环,斐林试验呈砖红色沉淀,说明该物质中含有糖成分;茚三酮试验呈蓝色,双缩脲试验不变化,说明含有氨基酸,从而排除了生物碱、酚类和醌、酮等其他物质的可能性。
薄层层析法(表2)可知,苯胺-二苯胺显色剂呈蓝色斑点,苯胺-邻苯二甲酸试剂呈棕色斑点,α-萘酚试剂呈蓝色斑点,仍然说明该活性物质中含有糖成分。茚三酮显色剂呈粉红色斑点,说明活性物质中含有氨基酸。其他的生物碱、酚类、醌、酮和有机酸、油脂类均无变化。
因此,可以判断放线菌Snea253 发酵液的代谢产物中杀线虫活性物质含有糖和氨基酸。而后经过柱层析、液相色谱、质谱和核磁共振成像初步解析为寡糖类(待发表)。
微生物产生的抗生素等生物活性物质主要来自放线菌中的链霉菌属。阿维菌素是目前使用高效、低剂量的杀线虫剂,目前陆续有研究者从链霉菌中分离出对植物线虫有作用的抗生素、酸、黄酮等物质,但还没有发现从链霉菌中分离出对植物线虫有活性的寡糖类物质。

表1 放线菌Snea253 代谢产物中活性物质化学成分试管法分析结果Table 1 Snea253 metabolites identified by test tube method

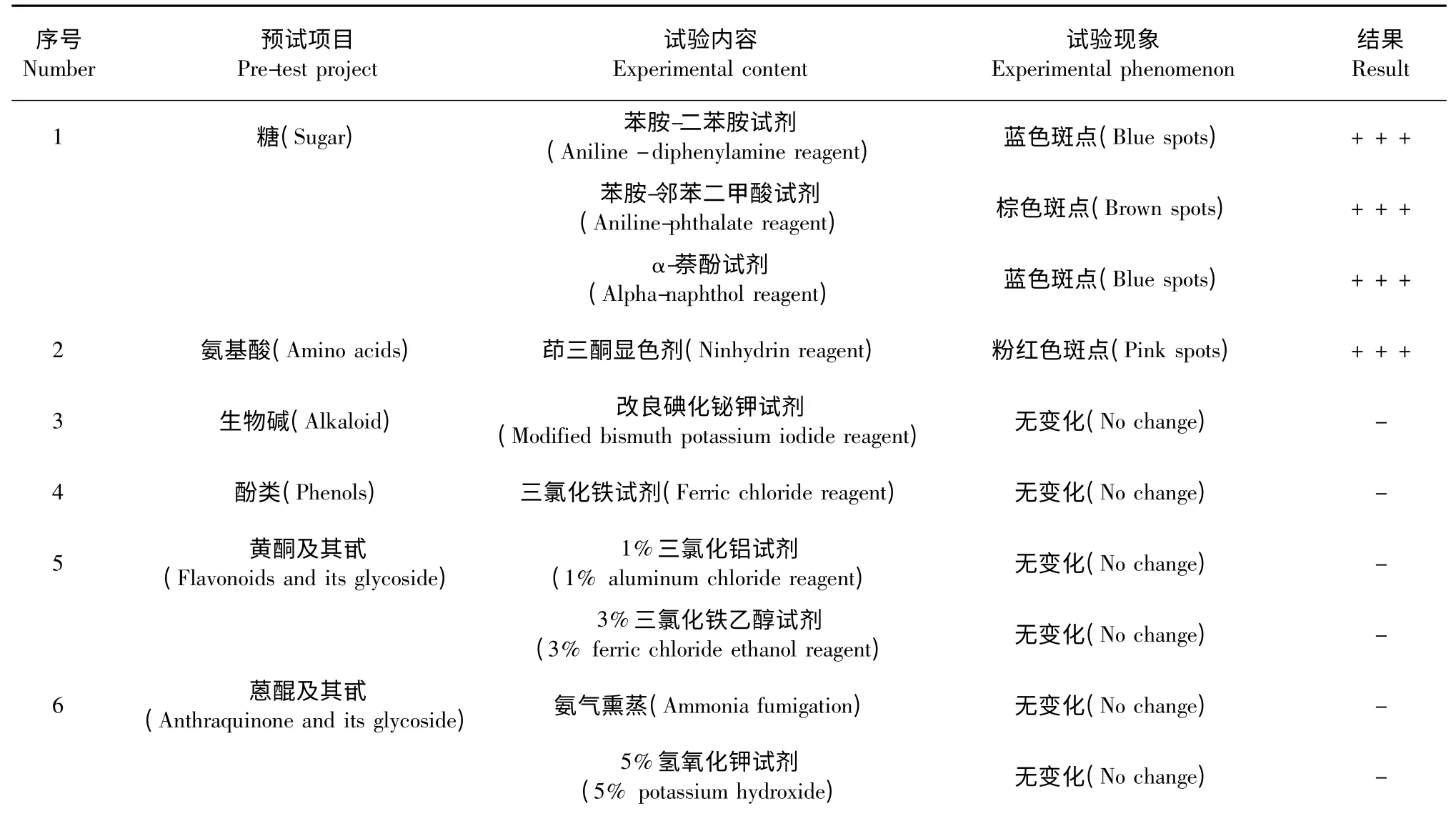
表2 放线菌Snea253 代谢产物中活性物质化学成分薄层层析法分析结果Table 2 Snea253 metabolites by identified thin layer chromatography

2.2 Snea253 代谢产物中活性物质与寡糖对南方根结线虫卵囊中卵孵化和J2 的影响
试验选择已知寡糖类物质8 种,比较与Snea253代谢产物中氨基寡糖对南方根结线虫的卵和J2 的毒性,研究结果显示,Snea253 代谢产物中的活性物质对南方根结线虫的毒性最高,而其他寡糖类物质对根结线虫毒性很低,甚至可以促进线虫的卵孵化和J2 存活。

图1 Snea253 活性物质和寡糖对南方根结线虫卵孵化的影响Fig.1 Effect of Snea253 active substance and oligosacharides on egg hatching of M.incognita.

图2 Snea253 活性物质和寡糖对南方根结线虫卵孵化的相对抑制率Fig.2 Relative suppression rate of egg hatching of M.incognita by Snea253 active substance and oligosacharides
D(+)半乳糖、D-果糖和D(+)木糖对南方根结线虫卵孵化具有显著的促进作用;其次是乳糖、D(+)葡萄糖和L-山梨糖有一定的促进作用,但与对照相比不显著;蔗糖和麦芽糖略有抑制,但也不显著;而Snea253 活性物质则能够显著抑制南方根结线虫的卵孵化(图1)。而且Snea253 对卵囊中卵孵化的相对抑制率最高,达到84.95%;麦芽糖和蔗糖相对抑制率不显著,但是半乳糖、果糖和木糖正相反,显著促进了南方根结线虫的卵孵化,乳糖、山梨糖和葡萄糖也有一定促进作用,但与对照相比不显著(图2)。
对南方根结线虫J2 的致死率试验中,Snea253活性物质对J2 的校正死亡率最高为98.21%,与寡糖和对照处理差异极其显著,寡糖中除D(+)半乳糖的致死率为4.176%相比对较显著外,其他寡糖对J2 致死效果均不显著,而且葡萄糖、乳糖和蔗糖溶液中的线虫没有死亡现象,与无菌水对照相比,反而有促进J2 更活跃生存的作用(图3)。
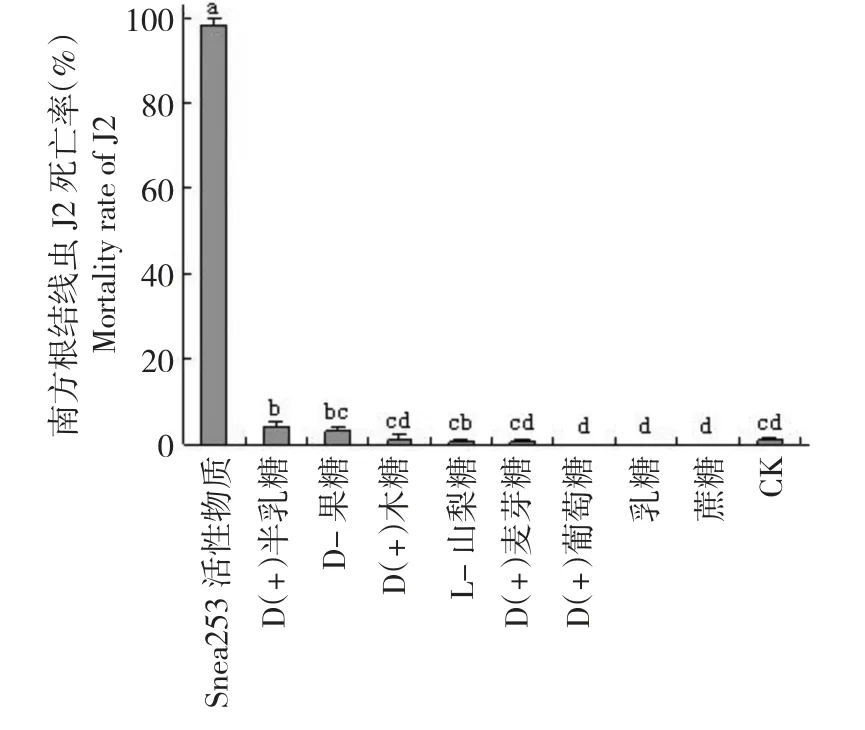
图3 Snea253 活性物质和寡糖对南方根结线虫J2 的致死率Fig.3 Mortality of M.incognita J2 by Snea253 active substance and oligosacharide
3 讨论
农业生产中所用的寡糖是一类对生物具有某种或某类特定功效作用的低聚糖类,即为功能性寡糖,如壳寡糖、甘露寡糖、胡萝卜寡糖等种类[9]。根据活性物质和已知寡糖对南方根结线虫的作用,可推断活性物质并不是简单的寡糖而是功能性寡糖。Hirano 等研究显示功能性寡糖可以作为抗菌剂直接杀死病原微生物[10],Ayers 等发现寡糖也可以激发植物自身防卫反应以达到防治植物病害目的[11]。壳寡糖对小麦纹枯病、黄瓜灰霉病、辣椒白粉病等真菌病害和某些病毒病害及细菌病害都有明显的防治效果[7]。也有研究发现壳聚糖处理可以诱导黄瓜对根结线虫的抗病性[12],因此,功能性寡糖对线虫病害的防治研究将具有深远意义。
关于微生物代谢产物中含氨基寡糖类物质对植物线虫的活性研究报道很少。本研究证明委内瑞拉链霉菌Snea253 产生的含氨基酸的寡糖类物质对植物线虫有活性。委内瑞拉链霉菌是研发较早的医用抗生素来源菌之一。Uchida 从委内瑞拉链霉菌Tü 1102 中分离出核酸霉素(Rinamycin),它能抑制真菌、酵母菌、革兰氏阳性和一些阴性细菌[13]。委内瑞拉链霉菌还能产生大环内酯类抗生素如酒霉素(Methymycin)、新酒霉素(Neomethymycin)和苦霉素(Picromycin)[14]。但未见其抗生素对植物线虫有活性的报道,因此需进一步进行系统的研究,以明确其杀线虫活性物质的结构与功能,为植物线虫病害的防治提供新的生防资源。
4 结论
本文经过薄层层析法和试管法测试了放线菌Snea253 发酵液中活性物质,显色反应包含有氨基酸和糖类物质。根据之后对活性物质的分离纯化及核磁、质谱结果,可以初步判定为寡糖类物质(待发表)。利用活性跟踪测试,Snea253 活性物质对南方根结线虫卵囊中卵孵化具有很强的抑制作用,对J2也有强烈的毒杀作用,24 h 校正死亡率即可达到98.21%,显著高于各寡糖处理和空白对照。不同寡糖对南方根结线虫的作用不同,相比Snea253 代谢产物的高活性而言,已知寡糖的作用非常微弱,有的甚至起到促进南方根结线虫卵孵化和J2 存活的作用。如半乳糖、果糖和木糖显著促进了南方根结线虫的卵孵化,而葡萄糖、乳糖和蔗糖还有促进J2 存活的作用,推测可能这些已知寡糖为线虫卵孵化和J2 存活提供了营养物质。
致谢:感谢沈阳农业大学植物保护学院于志国教授对本论文提供的建设性意见。
1 Duan YX(段玉玺).Plant Nematology(植物线虫学).Beijing:Science Press,2011.135.
2 Chubachi K,Furukawa M,Fukuda S,et al.Suppressive effects of antinematodal Streptomyces spp.on root-knot nematodes of cucumbers caused by Meloidogyne incognita.Biocontrol Sci,2002,7:25-29.
3 Mrozik H,Eskola P,Linn BO,et al.Discovery of novel avermectins with unprecedented insecticidal activity.Experientia,1989,45:315-316.
4 Chen LJ(陈立杰),Chen JS(陈井生),Zheng YN(郑雅楠),et al.Identification of actinomycetes strain Snea253 and its activity against Soybean Cyst Nematode.Chin J Biol Control (中国生物防治),2009,25:66-69.
5 Chen JS(陈井生),Chen LJ(陈立杰),Duan YX(段玉玺),et al.The nematicidal spectrum of actinomycetes Snea253 metabolic product.Acta Agric Shanghai(上海农业学报),2010,26(3):80-82.
6 Alberhseim P,Darvill AG.Oligosaccharins.Sci Am,1985,253:58-64.
7 Zhang SZ(张树政).Glycobiology and Glycoengineering(糖生物工程).Beijing:Chemical Industry Press,2012.191-196.
8 Wang JR(王俊儒).Extraction,separation and identification technology of natural products (天然产物提取分离与鉴定技术).Yangling:Northwest A & F University Press,2003.47-52.
9 Gao JL(高剑龙),Lan YY(蓝炎阳),Wang SF(王少峰).Application of oligosaccharides in agricultural production.Fujian Sci Technol Tropical Crops(福建热作科技),2012,3(37):70-72.
10 Hirano S,Nagao N.Effects of chitosan,pectic acid,lysozyme,and chitinase on the growth of several phytopathogens.Agric Biol Chem,1989,53:3065-3066.
11 Ayers AR,Ebel J,Valent B,et al.Host pathogen interactions:fractionation and biological activity of an elicitor isola-ted from mycelial walls of Phytophthora megasperma var.sojae.Plant Physiol,1976,57:760-765.
12 Liu QA(刘庆安),Xia K(夏凯),Ye MR(叶梅荣).Studies on resistance induced by oligosaccharides against Meloidogyne spp.in cucumber(Cucum is sativus L.).J Anhui Sci Technol Univ(安徽科技学院学报),2010,24(2):5-9.
13 Uchina K,Zahner H.Metabolic products of microorganisms 137 rinamycin,a new inhibitor of RNA synthesis.J Antibiot,1975,3:185-193.
14 Graziani E,Cane D,Betlach M,et al.Macrolide biosynth:A single cytochrome P450,Pick,is responsible for the hydroxylations that generate Methymycin,Neomethymycin,and Picromycin in Streptomyces venezuelae.Bioorg Med Chem Lett,1998,8:3117-3120.
