虫草发酵多糖的提取,结构分析及生物活性研究
2014-01-09付海田陈敬华
付海田,邓 超,王 敏,陈敬华
江南大学药学院,无锡 214122
虫草又称冬虫夏草,原为野生珍稀真菌,分布于我国青海、西藏、四川、甘肃、云南等地,在秘精益气、止血化痰、滋补强壮等方面有独特的疗效[1]。虫草潜在的生理活性与其多糖成分有着密切的关系。真菌多糖具有提高免疫力、抗肿瘤、延缓衰老、降血糖、降血压、降血脂等生理功效,并且对正常细胞不产生毒副作用[2],因此可作为潜在的机体保健成分、免疫增强剂和抗衰老药物加以开发。目前已有人工培植虫草子实体,但因其生长环境极其严格复杂,难以模拟,而且栽培时间长,收获量极少,因此不能被大规模的应用到医用事业中。而采用人工发酵技术,很大程度上降低了成本投入,可获得较多的成品,如菌丝体和发酵菌粉等。本文从虫草发酵菌粉中通过热水浸提法得到一种虫草发酵多糖,测定了其分子量、糖苷键构型及单糖组成,并对该多糖的抗氧化和免疫增强活性进行了研究,为虫草多糖的进一步开发利用提供了一定的理论基础。
1 材料与方法
1.1 材料、试剂与仪器
虫草发酵菌粉:由广州无限极(中国)有限公司惠赠。小鼠单核巨噬细胞RAW 264.7:由中国科学院细胞库提供。试剂:DPPH、MTT、二甲亚砜、胰酶、LPS 购自于Sigma 公司;进口胎牛血清、DMEM高糖培养基购自于Gibco 公司;Griess 试剂盒与细胞因子试剂盒购自于英潍捷基(上海)贸易有限公司;Sephadex G-75 购自上海鹏顺科学仪器有限公司;其余试剂均为国产分析纯。
主要仪器设备:NICOLET NEXUS 470 红外光谱仪、Multiskan Go 全波长读数仪(赛默飞世尔仪器有限公司);LC 1200 凝胶渗透层析液相色谱仪(安捷伦科技有限公司);GC-14A 气相色谱仪(日本岛津公司)。
1.2 实验方法
1.2.1 多糖的提取
将虫草发酵菌粉置于索氏提取器内,依次用乙酸乙酯和无水乙醇冷凝回流脱脂6 h 后,残渣用去离子水90 ℃下浸提24 h,离心后取上清液,无水乙醇沉淀(提取液∶乙醇=1∶4)获得的粗多糖后,采用Sevag 法脱蛋白。将脱蛋白后的多糖溶液pH 调至8.0 左右,55 ℃下滴加30%过氧化氢,保温2 h 至淡黄色后,透析去除盐类等小分子物质[3],获得虫草发酵多糖(CY)。
1.2.2 多糖的纯度检测
CY 用去离子水溶解至浓度为5 mg/mL,选取1 cm×30 cm 玻璃柱为层析柱,以Sephadex G-75 葡聚糖凝胶为固定相,0.1 mol/L 的NaCl 溶液为流动相,上样量1 mL,全自动部分收集器控制流动相速度为6.7 min/管,1.5 mL/管,收集流出液。收集过程中以苯酚-硫酸法跟踪监测收集液吸光值,结束后以收集管序号为横坐标,收集管吸光值为纵坐标绘制洗脱曲线。
1.2.3 总糖含量测定
采用苯酚硫酸法测定CY 中总糖含量,以葡萄糖做标准。
1.2.4 糖醛酸含量测定
采用咔唑硫酸法测定CY 的糖醛酸含量,以葡萄糖醛酸做标准。
1.2.5 蛋白质含量测定
采用考马斯亮蓝法测定CY 的蛋白质含量,以牛血清蛋白做标准。
1.2.6 多糖分子量测定
用安捷伦LC1200 液相色谱仪对多糖分子量进行测定。
样品处理:CY 用去离子水溶解至浓度为1 mg/mL 的多糖溶液,过0.45 μL 微孔滤膜后用凝胶渗透色谱法(GPC)测定多糖的重均分子量,以标准右旋糖酐做标准对照品。
液相条件:PL aquagel-OH 50 凝胶色谱柱(7.5 mm×300 mm,8 μm);示差检测器(G1362A);柱温:30 ℃;检测器温度:35 ℃;流动相:NaNO3溶液(0.1 mol/L);流速0.8 mL/min;进样量10 μL。
1.2.7 单糖组成分析
用岛津GC-14A 气相色谱仪对多糖的单糖组成进行检测分析。
样品处理:将多糖用1 mol/L 的硫酸溶液100℃水解4 h 获得游离单糖,水解液用碳酸钡中和去除多余硫酸,滤液经冷冻干燥后既得游离单糖。上述干燥单糖样品加入10 mg 盐酸羟胺、0.5 mL 吡啶及2 mg 肌醇内标于90 ℃水浴中反应30 min 生成糖肟,冷却后再加入0.5 mL 乙酸酐于90 ℃反应30 min 生成糖腈乙酸酯衍生物,待样品冷却后进行GC分析。以常见标准单糖做相同处理作为对照样品。
气相条件:OV1701 石英毛细管柱(30 m ×0.53 mm×1.0 μm);检测器:氢火焰离子鉴定器(FID);气化室温度260 ℃;检测器温度250 ℃;柱温升温程序:起始温度120 ℃,保持3 min,10 ℃/min 至195℃,保持0.1 min,3 ℃/min 至240 ℃,保持10 min;载气压力(N2):0.60 kg/cm2;燃气压力(H2):0.65 kg/cm2;助燃气压力(空气):0.50 kg/cm2;分流比:30∶1;进样量:2.0 μL。
1.2.8 红外分析
采用红外光谱法分析CY 的糖苷键构型。室温条件下,将1 mg 干燥样品与适量干燥溴化钾混合研磨压片后,在4000~400 cm-1范围内进行扫描分析。
1.2.9 抗氧化活性研究
1.2.9.1 还原力测定
在具塞试管中加入1 mL 不同浓度的多糖溶液、0.2 mL 的PBS 溶液(2.0 mol/L,pH6.6)和0.25 mL的1%(w/v)的铁氰化钾溶液,置50 ℃恒温水浴中反应20 min,迅速冷却,再加入10%(w/v)三氯乙酸溶液0.5 mL,3000 g 离心10 min,取上清液1.5 mL,加入0.1mL1%(w/v)三氯化铁溶液和3.0 mL 去离子水,振荡均匀,静置5 min,在700 nm 处以蒸馏水代替多糖溶液为空白测定吸光值[4],每个试样3 个平行样,取平均值。以抗坏血酸做阳性对照。
1.2.9.2 对羟基自由基的清除
在试管中加入1 mL 不同浓度的多糖溶液,0.9 mL 硫酸亚铁(0.15 mmol/L),0.5 mL 水杨酸(9 mmol/L),0.5 mL 双氧水(8.8 mmol/L),37 ℃反应60 min,于510 nm 处测定吸光值Ax,水杨酸替代双氧水时的吸光值Ax0,水杨酸代替多糖测得空白对照吸光值A[5]0。以等浓度抗坏血酸代替样品做阳性对照。对羟基自由基清除能力用下列公式:

1.2.9.3 对DPPH 自由基的清除
样品管中加入1 mL 不同浓度的多糖溶液与3.0 mL 的0.004%(v/v)溶于95%乙醇的DPPH 溶液,室温放置10 min 后,517 nm 处测定吸光值Ax,空白管用蒸馏水代替多糖溶液,测定值为A0,95%乙醇代替DPPH 测定值为Ax[6]0。对DPPH 自由基清除能力用下列公式:

1.2.10 体外免疫增强活性测定
细胞培养条件:RAW 264.7 细胞培养于DMEM培养基中,添加10%胎牛血清,培养条件为37 ℃,5% CO2,24 h 胰酶消化传代。
1.2.10.1 细胞增殖实验(MTT 法)
取对数期巨噬细胞用培养基调整细胞浓度为5×104/mL,以每孔100 μL 接种于96 孔板,培养6 h,待细胞贴壁后弃上清,PBS 清洗除去未贴壁细胞后,样品组分别加入100 μL 不同剂量(50、100、200 μg/mL)的药物,空白对照组(Blank control,BC 组)加入等体积培养基,阳性对照组加入等体积LPS(10 μg/mL)。培养24 h 后,加入20 μL MTT 溶液(5 mg/mL),继续培养4 h 后弃上清,加入100 μLDMSO 室温震荡溶解结晶,570 nm 处测定吸光值。
1.2.10.2 对巨噬细胞NO 释放量的影响
NO 在体内的半衰期极短,因此通过间接的测定NO 在体内水环境中氧化成NO-2 的含量来反映NO 的产生量。
取对数期巨噬细胞用培养基调整细胞浓度为7×105/mL,以每孔100 μL 接种于96 孔板,待细胞贴壁后,弃上清,样品组分别加入200 μL 不同剂量的药物,空白组加入等体积培养基,阳性对照组加入等体积LPS(10 μg/mL),继续培养24 h 后,收集上清培养液,加入300 g/L 的ZnSO4溶液10 μL 震荡去除蛋白,7000 rpm 离心10 min 后,吸取100 μL 上清液置酶标板中,加入等体积Griess 试剂,室温震荡反应10 min,以做同样处理的培养基为调零组,读取492nm 波长处吸光值,以标准曲线计算各组培养液中NO2-含量。
1.2.10.3 对巨噬细胞细胞因子释放量的影响
采用酶联免疫法,严格按照TNF-α、IL-1、IL-6、IL-12 试剂盒说明书进行操作。实验样品诱导培养条件同NO 释放水平测定方法。
1.2.11 数据分析
实验数据用SPSS 软件进行单因素方差分析统计处理。
2 结果与分析
2.1 虫草发酵多糖的提取及相关成分含量测定
CY 呈淡黄色絮状,易溶于水,纯度检测结果见图1,在收集管序号为56 管处出现一个单峰,该峰基本对称,且无其它峰出现,表明该多糖纯度较高。
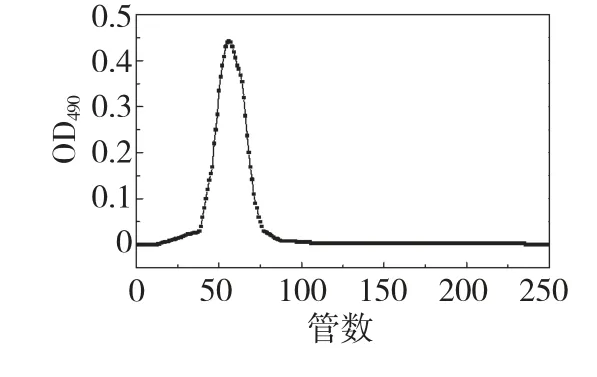
图1 CY 洗脱曲线Fig.1 Elution curve of CY
采用苯酚硫酸法测定多糖含量,回归方程为:Y=0.00X-0.0116(R=0.9984,Y 为吸光度,X 为质量浓度),计算可得CY 中总糖含量为90.53%。
采用考马斯亮蓝法测定蛋白质含量,回归方程为:Y=4.6957X-0.002(R=0.9999,Y 为吸光度,X为质量浓度),计算可得CY 中蛋白质含量为4.3%。
采用咔唑硫酸法测定糖醛酸含量,回归方程为:Y=0.009X-0.0025(R=0.9997,Y 为吸光度,X 为质量浓度),计算可得CY 中糖醛酸含量为12.42%。
由以上结果可知,所得CY 纯度较高,多糖含量较高(>90%),蛋白质杂质含量较少(<5%),且糖醛酸含量较低,说明该多糖以中性多糖为主要成分。
2.2 多糖分子量
经GPC 检测,CY 重均分子量为9.3 ×103g/mol。
2.3 单糖组成
标准单糖GC 色谱图见图2,CY 的GC 色谱图见图3,对比可知CY 由木糖、甘露糖、葡萄糖和半乳糖四种单糖组成。根据内标法计算各单糖含量比例,由结果可知(见表1)其中甘露糖含量最高,木糖含量最少。

图2 标准单糖GC 图Fig.2 GC spectrum of monosaccharide standards

图3 CY 的GC 图谱Fig.3 GC spectrum of CY

表1 各多糖单糖组成Table 1 Monosaccharide composition of polysaccharides
2.4 红外分析
CY 的红外光谱谱图(见图4)表现出一般多糖的特征吸收峰:由多糖羟基的伸缩振动引起的3600~3200 cm-1之间的吸收峰、由C-H 伸缩振动引起的2930 cm-1处的吸收峰等特征峰。此外在1100~1010 cm-1区域存在两个D-呋喃糖苷的特征吸收峰;840 cm-1处无吸收峰,890 cm-1有明显吸收峰,说明该多糖是以β 糖苷键相连的。

图4 虫草发酵多糖红外色谱图Fig.4 FTIR spectrum of CY
2.5 抗氧化活性
2.5.1 还原力测定
由图5 可看出,随着多糖浓度的增加,CY 的还原能力呈现出稳定的增长。质量浓度相同时,CY 的还原能力与抗坏血酸相比相差较大,说明其还原能力没有抗坏血酸强。

图5 还原力曲线Fig.5 Curve of reducing power
2.5.2 对羟基自由基清除能力测定
从图6 中可看出,随着质量浓度的增大,CY 对羟基自由基的清除能力也逐步增大,且在一定范围内具有一定的量效关系。但与抗坏血酸相比,CY 对羟基的清除能力较低。

图6 虫草发酵多糖对羟自由基的清除能力Fig.6 Effect of CY on scavenging ?OH
2.5.3 对DPPH 自由基清除能力测定
由图7 可看出,随着多糖浓度的增加,CY 对DPPH 自由基的清除能力逐渐增强,且呈现出一定的剂量关系,但与抗坏血酸相比较,CY 对DPPH 自由基清除能力相对较低。
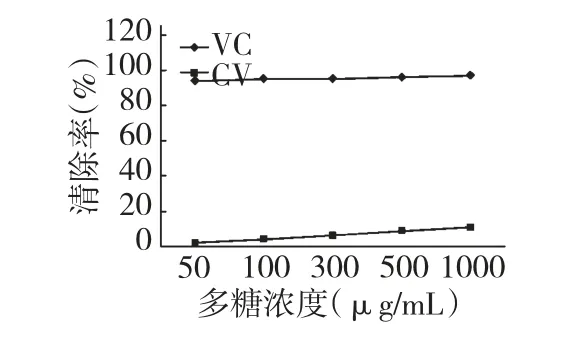
图7 虫草发酵多糖对DPPH 自由基的清除能力Fig.7 Effect of CY on scavenging DPPH·
2.6 免疫调节活性
2.6.1 细胞增殖实验
CY 对RAW 264.7 细胞增殖的作用见图8。与空白组相比,CY 浓度为50 μg/mL 时即可促进细胞的增殖(P <0.05),且促进作用随剂量的增加而增大,但较LPS 组的作用小。

图8 RAW 264.7 增殖实验结果Fig.8 Results of RAW 264.7 cell proliferation bioassay
2.6.2 对NO 释放量的影响
NO 是一种具有广泛生物功能的内源性可溶性气体信号分子,有杀伤肿瘤细胞、抑制血小板凝集、舒张血管等重要生理功能。
CY 对巨噬细胞NO 分泌的影响见图9,在CY低剂量(50 μg/mL)和中剂量(100 μg/mL)时,多糖对细胞NO 的分泌量无显著影响(P >0.05),在高剂量(200 μg/mL)时,可显著促进NO 的分泌(P <0.01)。与LPS 组相比较,多糖对NO 分泌的促进作用较小。

图9 CY 对巨噬细胞NO 释放量的影响Fig.9 Effect of CY on NO secretion of mice macrophages
2.6.3 对细胞因子的影响
2.6.3.1 对TNF-α 分泌量的影响
TNF-α 在体内外对多种肿瘤细胞有着明显的杀伤作用,还具有促进中性粒细胞吞噬、抗感染、促进细胞增殖分化等作用功能,在维持细胞内部自稳和抵御致病因子方面有重要作用。
由图10 可知,低剂量时,CY 对TNF-α 分泌无明显作用(P >0.05),在中剂量和高剂量时,可显著促进TNF-α 的分泌(P <0.01),且在高剂量时,对TNF-α 分泌的促进作用显著高于LPS 阳性对照组(P <0.05)。

图10 CY 对巨噬细胞TNF-α 释放量的影响Fig.10 Effect of CY on TNF-α secretion of mice macrophages
2.6.3.2 对IL-1 分泌量的影响
IL-1 在免疫反应中具有活化淋巴细胞、协同刺激胸腺细胞增殖和促进炎症反应的功能,并促进B淋巴细胞分泌抗体和IL-2、增强NK 细胞的杀伤功能[7]。
由图11 可知,低剂量时,CY 对IL-1 分泌无明显作用(P >0.05),在中剂量和高剂量时,可显著促进IL-1 的分泌(P <0.05),且在高剂量时,对IL-1分泌的促进作用与LPS 阳性对照组无明显差异(P>0.05)。

图11 CY 对巨噬细胞IL-1 释放量的影响Fig.11 Effect of CY on IL-1 secretion of mice macrophages
2.6.3.3 对IL-6 分泌量的影响
IL-6 主要作用是诱导B 细胞增殖分化,促进B细胞分泌抗体,且能够提高LAK 和GTL 对肿瘤细胞的杀伤能力[8]。
低剂量和中剂量时(图12),CY 对IL-6 分泌无明显作用(P >0.05),高剂量时,可显著促进IL-6 的分泌(P <0.01),且促进作用与LPS 阳性对照组无明显差异(P >0.05)。

图12 CY 对巨噬细胞IL-6 释放量的影响Fig.12 Effect of CY on IL-6 secretion of mice macrophages
2.6.3.4 对IL-12 分泌量的影响
IL-12 参与早期的非特异性免疫和进一步的特异性免疫中,在肿瘤、感染、自身免疫性疾病中起重要作用。
低剂量和中剂量时(图13),CY 对IL-12 分泌无明显作用(P >0.05),高剂量时,可显著促进IL-6的分泌(P <0.05),且促进作用与LPS 阳性对照组无明显差异(P >0.05)。

图13 CY 对巨噬细胞IL-12 释放量的影响Fig.13 Effect of CY on IL-12 secretion of mice macrophages
3 结论
本文从虫草发酵菌粉中提取得到的水溶性虫草发酵多糖CY 主要成分为中性糖,分子量为9.3 ×103g/mol,主链由β 糖苷键连接,单糖组成为木糖、甘露糖、葡萄糖和半乳糖。体外试验结果显示,CY有较强的还原力,对羟基自由基和DPPH 自由基有一定的清除作用,即CY 有一定的抗氧化活性;此外CY 能够促进巨噬细胞RAW 264.7 的增殖,并可促进NO 和细胞因子的分泌,表明CY 具有调节免疫的活性。发酵多糖的原料发酵菌粉来源丰富,价格低廉,具有抗氧化活性和免疫调节功能的虫草发酵多糖为进一步应用于功能性食品和医药领域提供了一定的参考依据。
1 You ML(游明乐).Fermentation Cordyceps fungal substance and the main natural Cordyceps activity ingredients comparative study.Biotechnol Bull (生物技术通报),2009,2:129-131.
2 Deng C,Hu Z,Fu HT,et al.Chemical analysis and antioxidant activity in vitro of a β-D-glucan isolated from Dictyophora indusiata.Int J Biol Macromol,2012,51:70-75.
3 Wang JT,Deng C,Chen JH,et al.Structural characterization,chain conformation,and morphology of a β-(1→3)-Dglucan isolated from the fruit body of Dictyophora indusiata.J Agric Food Chem,2009,57:5918-5924.
4 He YH,Fereidoon S.Antioxidant activity of green tea and its catechins in a fish meat model system.J Agric Food Chem,1997,45:4262-4266.
5 He ZS,Cao ZH.Photometric determination of hydroxyl free radical in fenton system by brilliant green.Am J Chin Med,2004,6:236-237.
6 Braca A,De-Tommasi N,Di-Bari L,et al.Antioxidant principles from Bauhinia terapotensis.J Nat Prod,2001,64:892-895.
7 Oppenheim JJ,Kovacs EJ,Matsushima K,et al.There is more than one interleukin-1.Immunol Today,1986,7:45.
8 Ishibashi T,Kimura H,Shikama Y,et al.Interleukin-6 is a potent thrombopoietic factor in vivo in mice.Blood,1989,71:1241-1244.
