耐氧突变株对中药射干中鸢尾黄素的生物转化
2014-01-09郭常亮王秀伶刘明月
郭常亮,王秀伶,刘明月,陈 静
河北农业大学生命科学学院,保定 071000
射干[Belamcanda chinensis (L.)DC]是鸢尾科射干属植物射干的干燥根茎,具有清热解毒、消痰、利咽等功效。中药射干含黄酮类、酚类、萜类、甾体类等多种化学成分,其中鸢尾苷、野鸢尾苷等异黄酮是中药射干的主要活性成分。马林等于1996 年利用高效液相色谱技术对不同产地射干中的鸢尾苷、野鸢尾苷、鸢尾苷元、野鸢尾黄素和次野鸢尾黄素进行了分离和定量分析[1];2006 年邱鹰昆等从射干的根茎中检测到异野鸢尾苷、鸢尾黄素、野鸢尾黄素、野鸢尾苷等异黄酮[2]。药理学研究结果表明,射干异黄酮类化合物具有明显的抗菌、抗炎、清除自由基、护肝、防治糖尿病、抗肿瘤以及类似雌激素[3,4]等作用。目前有关射干化学成分分析及药理作用的报道较多,而有关射干在体内代谢及其药代动力学研究报道则较少。已有研究表明,鸢尾苷(tectoridin)在动物肠道微生物菌群产生的葡萄糖苷酶作用下可被水解生成鸢尾黄素[5],而有关鸢尾黄素在肠道菌群作用下能否被进一步代谢为新的代谢产物则报道极少。从可查找的文献中目前仅发现一篇,即2008 年Chen 等报道在灌喂鸢尾苷的大鼠尿液中检测到鸢尾黄素(tectorigenin)和二氢鸢尾黄素(dihydrotectorigenin)等鸢尾苷的代谢产物[6]。鸢尾黄素在C-2 和C-3 位被加氢还原后即得二氢鸢尾黄素(图1)。迄今二氢鸢尾黄素在天然射干提取物中从未被检测报道,故推测是大鼠肠道微生物菌群将鸢尾苷转化为二氢鸢尾黄素。事实上,迄今尚未见从自然界中分离和人工合成二氢鸢尾黄素的报道,也未见将鸢尾黄素转化为二氢鸢尾黄素的单一微生物菌株的报道。由于二氢鸢尾黄素资源匮乏,有关其生理和药理活性方面迄今未见任何报道。

图1 鸢尾黄素及二氢鸢尾黄素的化学结构Fig.1 Chemical structures of tectorigenin and dihydrotectorigenin
菌株Niu-O16(AY263505)是我们从牛瘤胃胃液中分离的一株能将大豆异黄酮黄豆苷元和染料木素高效转化为二氢黄豆苷元(dihydrodaidzein)和二氢染料木素(dihydrogenistein)的革兰氏阳性严格厌氧细菌菌株[7]。为提高转化菌株的耐氧特性,我们对厌氧牛瘤胃细菌菌株Niu-O16 进行了耐氧驯化尝试,菌株Aeroto-Niu-O16 是我们对厌氧菌株Niu-O16进行长期耐氧驯化后成功获得的一株耐氧突变株。与野生菌株Niu-O16 相比,耐氧突变株Aeroto-Niu-O16 的16S rRNA 基因序列发生两个点突变,即G398A 和G438A[8]。需指出的是,我们于2005 年将菌株Niu-O16 从牛瘤胃胃液中分离并对其16S rRNA 基因序列进行测定,通过BLAST 比对,当时发现菌株Niu-O16 的16S rRNA 基因序列与未培养细菌Uncultured bacterium OTU-46 的相似性最高(98.1%),其次与乳杆菌属菌株Lactobacillus vitulinus(91.5%)和Lactobacillus catenaformis(91.4%)的相似性较高;然而,目前通过BLAST 比对则发现,野生菌株Niu-O16 及其耐氧突变株Aeroto-Niu-O16 与2008 年新命名的Sharpea 属菌株相似性极高,菌株Niu-O16 及其耐氧突变株Aeroto-Niu-O16 与菌株Sharpea azabuensis strain JCM 14210、Sharpea azabuensis strain HM250 和 Sharpea azabuensis strain HM244 的相似性均高达99%。因此,我们将菌株Niu-O16 及其耐氧突变株Aeroto-Niu-O16 重新归属为Sharpea 属菌株,即Sharpea sp.Niu-O16 和Sharpea sp.Aeroto-Niu-O16。
通过本研究发现,耐氧突变株Sharpea sp.Aeroto-Niu-O16 能将中药射干甲醇提取物的酸水解产物中的鸢尾黄素转化为二氢鸢尾黄素。以微生物菌株为生物酶源,将鸢尾黄素转化为二氢鸢尾黄素尚属国内外首次。
1 仪器与试剂
1.1 仪器
Waters 高效液相色谱系统(含Waters 1525 泵,Waters 2487 双通道紫外检测器,Breeze 色谱工作站,美国Waters 公司);Finnigan LCQ Advantage 离子阱质谱仪,ESI 离子源(美国Thermo Finnigan 公司);Bruker AVANCE 400 型超导核磁共振波谱仪(美国Bruker 公司);DU-650 可见-紫外分光光度计(美国Beckmen 公司);HH-S4 型电热恒温水浴锅(北京科伟永兴仪器有限公司);Centrifuge 5417R 型低温高速离心机(Eppendorf);AS10200BT 超声波清洗器(天津奥特赛恩仪器有限公司);DK-VC010-IR 真空离心浓缩仪(韩国DAIKI 公司);SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);RE-2000B 型旋转蒸发器(上海亚荣生化仪器厂);DHP-2000 型电热恒温培养箱(天津市华北实验仪器有限公司)。
1.2 试剂
乙腈、甲醇和乙酸乙酯均为色谱纯(美国Fisher公司)。实验药材射干(Belamcanda Chinensis)购于保定市华兴大药房,鸢尾黄素标准品购自南京森贝伽生物科技有限公司;脑心浸液(BHI)培养基(美国Difco 公司)。
2 实验方法
2.1 色谱条件
分析液相色谱条件:Kromasil C18色谱柱(250 mm × 4.6 mm,5 μm);流动相:A 为10% 乙腈-0.1%冰乙酸水溶液,B 为90%乙腈-0.1%冰乙酸水溶液。洗脱方法:A∶B=65∶35(v/v);流速:1 mL/min;进样量:20 μL。由于底物鸢尾黄素的最大紫外吸收波长为265 nm,经检测产物二氢鸢尾黄素的最大紫外吸收波长为292 nm,因而,本研究选取280 nm 作为同时检测底物鸢尾黄素和产物二氢鸢尾黄素的检测波长。
制备液相色谱条件:Kromasil C18制备柱(250 mm × 10 mm,5 μm);流速:2.0 mL/min;检测波长292 nm,其余同分析检测转化产物的液相色谱条件。
2.2 底物鸢尾黄素粗品的制备
鸢尾黄素粗品的制备方法:称取射干粉末10 g于250 mL 三角瓶中,加入纯甲醇100 mL 在室温下超声提取2 次,每次超声30 min,过滤,合并滤液,旋转蒸发仪浓缩蒸干,再按30 mL/g 加入6%盐酸,在80 ℃水浴锅中保温3 h 进行酸水解。水解结束后,待水解液冷却至室温,用8 mol/L NaOH 溶液中和。然后按体积比1∶1 加入乙酸乙酯进行萃取。乙酸乙酯蒸干,加入适量体积的100%甲醇溶液,得到40~60 mmol/L 的鸢尾黄素粗品溶液,4 ℃冰箱密闭保存备用。粗品中鸢尾黄素的浓度,根据粗品中鸢尾黄素的峰面积及鸢尾黄素标准品的标准曲线计算得到。
2.3 代谢产物的分离纯化
将10 mL 菌株Aeroto-Niu-O16 的培养液接种于盛有100 mL 新鲜BHI 液体培养基的250 mL 三角瓶中,并加入4 mL 浓度为20 mmol/L 底物鸢尾黄素母液,在37 ℃恒温培养箱培养48 h。用等量乙酸乙酯萃取发酵液,蒸干后溶于100%甲醇溶液,并过0.45 μm 有机膜,用制备色谱柱进行分离,收集代谢产物峰,并用旋转蒸发仪蒸干,4 ℃冰箱保存备用。
2.4 代谢产物的结构鉴定
对分离纯化后的代谢产物的紫外吸收图谱、质谱、核磁共振氢谱(1H NMR)和碳谱(13C NMR)等进行测定,根据图谱分析结果对代谢产物的化学结构进行鉴定。
2.5 菌株对底物鸢尾黄素的转化动态
制备新鲜BHI 培养基,以10%接种量将菌株Aeroto-Niu-O16 培养液接种到新鲜BHI 液体培养基中,同时加入终浓度为0.4 mmol/L 的底物鸢尾黄素,置于37 ℃恒温培养箱内进行培养,分别在加入底物后6、12、18、24、36、48 和72 h 取样进行高效液相色谱检测,每个样品三次重复,记录数据,绘制转化动态曲线。
2.6 菌株最大转化浓度测定
将菌株Aeroto-Niu-O16 培养液按10%接种量接种到新鲜BHI 液体培养基中,同时分别加入终浓度为0.4、0.6、0.8、1.0 和1.2 mmol/L 的底物鸢尾黄素,在37 ℃恒温培养箱培养48 h,用高效液相色谱检测底物被转化情况。
2.7 不同还原剂对转化活性的影响
将菌株Aeroto-Niu-O16 培养液按10%接种量接种到新鲜BHI 培养基中,加入终浓度为0.8 mmol/L的底物鸢尾黄素,再分别加入不同浓度[0.05%、0.1%和0.15%(m/v)]的抗坏血酸、L-半胱氨酸和硫代硫酸钠,培养和检测条件同上所述,用HPLC 检测不同还原剂对菌株转化活性的影响。
3 实验结果
3.1 底物鸢尾黄素的分离制备
底物鸢尾黄素是中药射干甲醇提取物经酸水解后制得。中药射干的甲醇提取物在保留时间3.4 min 处出现一主要物质峰(峰1,图2),推测其为中药射干主要活性成分鸢尾苷。中药射干甲醇提取物经酸水解后,原来出现在保留时间3.4 min 处的主要物质峰完全消失,而在保留时间13.1 min 处出现一主要物质峰(峰2,图2),该主要物质峰在265 nm有最大紫外吸收,这恰好与文献中报道的鸢尾黄素[9]的最大紫外吸收相吻合。通过负离子模式质谱分析(ESI-MS)发现其[M-H]-为299,因而,图2中峰2 的相对分子量应该为300,这恰好与鸢尾黄素(C16H12O6)的分子量吻合。根据酸水解出现的主要物质峰的最大紫外吸收图谱、相同条件下鸢尾黄素标准品在高效液相色谱上的保留时间(图2)以及质谱测定结果,将酸水解后出现的主要物质峰(即峰2)鉴定为鸢尾黄素。

图2 射干粗提物洗脱色谱图(实线)及射干粗提物水解后的洗脱色谱图(虚线)Fig.2 HPLC elution profiles of the crude extract of Belamcanda chinensis (regular line)and the hydrolyzate of the crude extract of Belamcanda chinensis (dashed line)
3.2 代谢产物的分离制备与结构鉴定
底物鸢尾黄素与耐氧菌株Sharpea sp.Aeroto-Niu-O16 共培养后,用高效液相色谱除检测到部分未被转化的底物鸢尾黄素(峰2,保留时间13.1 min)外,在保留时间11.2 min 处检测到一新物质峰(峰3),该新物质峰随底物鸢尾黄素的减少而成比例增加,因而确定峰3 为底物鸢尾黄素被菌株Aeroto-Niu-O16 转化后生成的代谢产物峰(图3),该代谢产物峰在292 nm 有最大紫外吸收。

图3 鸢尾黄素与耐氧突变株Sharpea sp.Aeroto-Niu-O16 共培养2 d 后的洗脱色谱图Fig.3 HPLC elution profiles of tectorigenin after 2 days incubation with the oxygen-tolerant mutant strain Sharpea sp.Aeroto-Niu-O16
为鉴定代谢产物的化学结构,我们将代谢产物分离纯化后进行负离子模式质谱分析(ESI-MS),测定结果为:ESI(-):m/z 301 ([M-H]-);MS/MS(rel.int.%):m/z 180 (15),195 (75),286 (100)。根据质谱测定结果可知,该代谢产物峰的分子量应该为302,这恰好与二氢鸢尾黄素(C16H14O6)的分子量吻合。为进一步准确鉴定代谢产物的化学结构,我们对纯化后产物又分别进行了核磁共振氢谱(1H NMR)和碳谱(13C NMR)分析,测定结果如下:1H NMR (400 MHz,DMSO-d6)δ:12.23 (1H,s,5-OH),10.70 (1H,s,7-OH),9.40 (1H,s,4'-OH),7.08 (2H,d,J=8.4 Hz,H-2',6'),6.72 (2H,d,J=8.4 Hz,H-3',5'),5.98 (1H,s,H-8),4.51 (2H,d,J=6.6 Hz,H-2),4.00 (1H,t,J=6.6 Hz,H-3),3.66(3H,s,6-OCH3);13C NMR (100 MHz,DMSO-d6)δ:198.1 (C-4),160.0 (C-4'),158.5 (C-7),157.2(C-9),156.0 (C-5),130.1 (C-2',6'),129.6 (C-6),126.1 (C-1'),115.8 (C-3',5'),102.3 (C-10),95.2 (C-8),71.4 (C-2),60.4 (6-OCH3),49.8 (C-3)。根据质谱、核磁共振氢谱和碳谱等分析结果,将菌株Aeroto-Niu-O16 代谢底物鸢尾黄素生成的代谢产物鉴定为二氢鸢尾黄素。
3.3 菌株Aeroto-Niu-O16 对底物鸢尾黄素的转化动态
为确定菌株Aeroto-Niu-O16 对底物鸢尾黄素的最佳转化时间,分别在不同时间对转化菌与底物的培养物进行取样测定。由图4 可以看出,菌株Aeroto-Niu-O16 在与底物鸢尾黄素共培养的前12 h 内,随底物浓度的急剧降低产物二氢鸢尾黄素浓度迅速增加;当培养时间延长至36 h 时,菌体对底物鸢尾黄素的转化率达到最大;此后,随培养时间延长,产物浓度稍有降低。因此确定菌株Aeroto-Niu-O16 对底物鸢尾黄素的最佳转化时间为36~48 h。
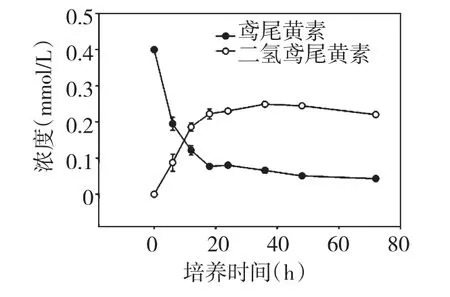
图4 耐氧突变株Sharpea sp.Aeroto-Niu-O16 在液体BHI培养基中对底物鸢尾黄素的转化动态图Fig.4 Biotransformation kinetics of tectorigenin by the oxygen-tolerant mutant strain Sharpea sp.Aeroto-Niu-O16 in BHI liquid medium
3.4 耐氧突变株Aeroto-Niu-O16 对不同浓度底物鸢尾黄素最大转化能力测定
当底物鸢尾黄素粗品中鸢尾黄素浓度为0.4、0.6 和0.8 mmol/L 时,菌株Aeroto-Niu-O16 对底物鸢尾黄素的平均转化率分别为42.7%、43.1% 和41.2%;当底物鸢尾黄素粗品中鸢尾黄素浓度增至1.0 和1.2 mmol/L 时,菌株Aeroto-Niu-O16 对底物鸢尾黄素的平均转化率急剧下降为28.7%和23.3%(图5)。此外,本研究还发现,菌株Aeroto-Niu-O16 对相同浓度鸢尾黄素纯品转化能力与粗品中的鸢尾黄素无显著差异,但无论是对鸢尾黄素纯品还是对粗品中的鸢尾黄素的转化率均较低。

图5 耐氧突变株Sharpea sp.Aeroto-Niu-O16 对不同浓度底物鸢尾黄素的转化能力图Fig.5 Bioconversion capacity of the strain Sharpea sp.Aeroto-Niu-O16 after being incubated with different concentrations of the substrate tectorigenin
3.5 不同还原剂对菌株Aeroto-Niu-O16 转化活性的影响
为提高菌株转化效率,实验以浓度为0.8 mmol/L 的鸢尾黄素粗品为底物,分别测定了不同还原剂对菌株Aeroto-Niu-O16 转化底物鸢尾黄素的影响。结果表明,向培养基中添加0.15%(m/v)的L-半胱氨酸能显著提高菌株对底物鸢尾黄素的转化率,而添加相同浓度的抗坏血酸和硫代硫酸钠则作用不显著。添加0.15%(m/v)的L-半胱氨酸可将平均转化率从40.1%提高到50.7%(P <0.05)。
4 讨论
本研究所用转化菌株Sharpia sp.Aeroto-Niu-O16 为牛瘤胃细菌菌株Sharpia sp.Niu-O16 的耐氧突变株,该耐氧突变株能在有空气氧条件下分别将底物大豆异黄酮黄豆苷元和染料木素进行加氢还原[8]。此前,我们曾以耐氧突变株Aeroto-Niu-O16为生物酶源对中药甘草主要活性成分甘草素进行转化尝试,结果发现,耐氧突变株Aeroto-Niu-O16 能在有氧条件下将底物甘草素开环转化为达维荚蒾苷元[10]。通过本研究发现,耐氧突变株Aeroto-Niu-O16 能将中药射干主要活性成分鸢尾黄素进行加氢还原。天然产物鸢尾黄素和黄豆苷元及染料木素均属异黄酮类化合物,而底物甘草素则为黄酮类化合物,因而,我们推测耐氧突变株Aeroto-Niu-O16 对异黄酮类化合物进行的是加氢还原转化,而对黄酮类化合物则进行开环转化。然而,值得一提的是,我们曾以耐氧突变株Aeroto-Niu-O16 为生物酶源,对包括银杏叶、黄芩、金莲花、密蒙花、芦丁、葛根、淫羊藿等在内的多种中药活性成分进行转化尝试,但结果均未能转化,这表明耐氧突变株Aeroto-Niu-O16 产生的转化酶具有较强的底物选择性。目前我国中药种类上万种,但从现有中药资源中挖掘结构新颖的有效成分难度越来越大。将微生物转化技术引入中药是增加天然化合物多样性的有效方法,对发掘具有自主知识产权的新高效活性先导化合物将具有开创性意义。对目前已确定生理和药理活性的中药主要活性成分进行微生物转化主要有两个途径:一是用菌种保藏机构、或其它机构或个人实验室分离保藏的菌种去尝试筛选能够被转化的中药种类及活性成分,这种筛选方法相对简单,但因微生物酶对底物具有专一性,通常不易找到可被转化的中药活性成分;途径二就是固定所要转化的中药活性成分,从环境微生物菌群(如动物肠道、植物内生菌等)中去筛选转化菌株。这种筛选方法工作量较大,但筛选目的性强,往往能分离得到具有转化某一中药活性成分的功能菌株,一旦应用于生产,更有利于实现传统中药的现代化和国际化。
但通过本研究发现,无论是以鸢尾黄素纯品为底物还是以射干甲醇提取物酸水解产物中的鸢尾黄素为底物,耐氧突变株Sharpea sp.Aeroto-Niu-O16对底物鸢尾黄素转化率均较低,在添加L-半胱氨酸、抗坏血酸和硫代硫酸钠等不同还原剂后,只有添加L-半胱氨酸能使转化率有明显提高,但在添加L-半胱氨酸后的转化率也只有50%左右。此外,我们还尝试使用未驯化的野生菌株Niu-O16 以及耐氧突变株Aeroto-Niu-O16 在严厌工作站内转化底物鸢尾黄素,但转化率均在60%~70%之间,因此,要实现二氢鸢尾黄素的高效微生物合成还需进一步提高耐氧突变株Aeroto-Niu-O16 的转化效率或重新从微生物菌群中分离能将鸢尾黄素高效转化为二氢鸢尾黄素的单一微生物菌株。总之,我国射干和鸢尾资源丰富,便于底物鸢尾黄素的分离提取,随着对代谢产物二氢鸢尾黄素的药理活性及作用机制研究的不断深入,二氢鸢尾黄素有望研发成一种可以治疗多种疾病的新型药物。
1 Ma L(马林),Song ZW(宋万志),Wu F(吴丰).Determination of five isoflavones in Belamcanda chinensis by RPHPLC.Acta Pharm Sin(药学学报),1996,31:945-949.
2 Qiu YK(邱鹰昆),Gao YB(高玉白),Xu BX(徐碧霞),et al.Studies on chemical constituents of Belamcanda chinensis.Chin Pharm J(中国药学杂志),2006,41:1113-1115.
3 Thelen P,Scharf JG,Burfeind P,et al.Tectorigenin and other phytochemieals extracted from leopard lily Belamcanda chinensis affect new and established targets for therapies in prostate cancer.Carcinogenesis,2005,26:1360-1367.
4 Shin JE,Bae EA,Lee YC,et al.Estrogenic effect of main components kakkalide and tectoridin of Puerariae Flos and their metabolites.Biol Pharm Bull,2006,29:1202-1206.
5 Qu J,Gao J,Sun J,et al.Pharmacokinetics of conjugated metabolites in rat plasma after oral administration of tectoridin.J Chromatogr B,2012,902:61-69.
6 Chen Y,Song W,Peng ZH,et al.Identification of metabolites of tectoridin in vivo and in vitro by liquid chromatographytandem mass spectrometry.J Pharm Pharmacol,2008,60:709-716.
7 Wang XL,Shin KH,Hur HG,et al.Enhanced biosynthesis of dihydrodaidzein and dihydrogenistein by a newly isolated bovine rumen anaerobic bacterium.J Biotechnol,2005,115:261-269.
8 Zhao H,Wang XL,Zhang HL,et al.Production of dihydrodaidzein and dihydrogenistein by a novel oxygen-tolerant bovine rumen bacterium in the presence of atmospheric oxygen.Appl Microbiol Biotechnol,2011,92:803-813.
9 Bai X,Xie YY,Liu J,et al.Isolation and identification of urinary metabolites of kakkalide in rats.Drug Metabol Dispo,2010,38:281-286.
10 Wang M(王铭),Zhao H(赵慧),Wang XL(王秀伶),et al.C-ring cleavage of liquiritigenin extracted from licorice roots by an oxygen-tolerant bovine rumen bacterium strain Aeroto-Niu-O16.Acta Pharm Sin(药学学报),2012,47:664-669.
