苦竹叶化学成分研究
2014-01-09岳永德王淑英
魏 琦,岳永德,汤 锋,孙 嘏,王淑英,喻 谨
国际竹藤中心,北京 100102
苦竹叶为禾本科苦竹属植物苦竹Pleioblastus amarus (keng)keng f.的嫩叶。苦竹资源丰富,广泛分布于我国长江流域以南地区。苦竹是常用的药用竹种,苦竹叶清心,利尿明目,解毒,主治热病烦渴,失眠,小便短赤,口疮,目痛,失音,烫火伤[1],为中医药书籍中收载的常用中草药。Hong Bing Wang等从苦竹叶中分离得到了五种黄酮pleiosides A-C,苜蓿素及苜蓿素-7-O-葡萄糖苷[2]。章晴等采用生物活性追踪法对苦竹叶提取物杀虫活性有效成分进行了初步分离,结果表明石油醚组分的第2 组分(F2)具有显著的杀虫活性[3]。王红兵等从苦竹叶中分离得到了8 种化合物甘草查尔酮A,伞形花内酯,松柏醇,木栓酮,胡萝卜苷,β-谷甾醇,邻羟基苯甲醛及香豆酸[4]。王学利等通过GC-M 联用技术对苦竹叶挥发性成分进行了研究,鉴定出包括醇类、酸类及醛类等42 种成分[5]。本文对苦竹叶的化学成分进行了分离与纯化,为了解苦竹叶的化学成分及阐明苦竹叶的药理活性奠定基础,对苦竹叶中天然产物的开发利用具有指导意义。
1 仪器与材料
GX-281 制备型HPLC 系统,美国Gilson 公司;Waters2695 高效液相色谱仪、Waters2996 检测器;Bruker AVANCE 300 型、Bruker AVANCEIII 400 型、Bruker AVANCEIII 500 型和Varian VNS 600 型核磁共振仪,TMS 为内标;Sephadex LH-20 凝胶,瑞典GE Healthcare Bio-Sciences AB 公司;柱层层析硅胶(200~300 目),GF254硅胶板,青岛海洋化工厂分厂。HPLC 及制备HPLC 所用甲醇和乙腈为色谱纯,其余试剂为分析纯。苦竹叶于2011 年8 月采自四川省长宁县。
2 提取与分离
苦竹叶7 kg,自然阴干后剪碎,用95%乙醇按料液比1∶10 浸泡,置于密封提取罐中在80 ℃下提取1.5 h,减压浓缩提取液,待近干时收集。重复提取2 次。合并2 次收集的近干液,减压浓缩后得浸膏312 g。将浸膏用水悬浮后,依次用石油醚、乙酸乙酯和正丁醇萃取,得乙酸乙酯浸膏(38.24 g)。将乙酸乙酯浸膏硅胶拌样后,上硅胶柱,以石油醚-丙酮梯度洗脱(石油醚:丙酮=100∶1,50∶1,30∶1,20∶1,15∶1,10∶1,5∶1,4∶1,3∶1,2∶1,1∶1),最后以甲醇洗脱,分得8 段组分(Fr.1-8)。经反复上Sephadex LH-20 凝胶柱层析(甲醇洗脱)、室温重结晶及高压制备HPLC,得到单体化合物。其中Fr.1 中分得化合物1(28.8 mg)和2(153 mg);Fr.2 中分得化合物3(3.3 mg)和4(6.8 mg);Fr.4 中分得化合物5(394.9 mg)、6(3.0 mg)及8(2.5 mg);Fr.5 中分得化合物7(58.8 mg)和9(14.7 mg);Fr.6 中分得化合物10(4.0 mg);Fr.7 中分得化合物11(339.2 mg)、12(12.2 mg)、13(2.5 mg)及14(32.6 mg);Fr.8 中分得化合物15(3.0 mg)和16(15.4 mg)。
3 结构鉴定
化合物1 白色粉末,难溶于甲醇,紫外光谱最大吸收为276.0 nm。1H NMR (500 MHz,DMSO-d6)δ:9.78 (1H,s,CHO),7.76 (2H,d,J=8.5 Hz,H-2,6),6.93 (2H,d,J=8.5 Hz,H-3,5),10.58 (1H,s,OH),3.16 (2H,s)示有1 个亚甲基,并可能与氧相连,鉴定其为4-羟甲基-苯甲醛,如图1 (1)。
化合物2 黄色无定形粉末,易溶于甲醇。紫外光谱最大吸收为221.7 nm,283.1 nm。1H NMR(300 MHz,DMSO-d6)δ:9.67 (1H,s,CHO),7.65(2H,d,J=7.8 Hz,H-2,6),6.82 (2H,d,J=7.8 Hz,H-3,5),鉴定其为对羟基苯甲醛,如图1 (2)。以上数据与文献[6]报道的对羟基苯甲醛基本一致。
化合物3 白色粉末,紫外光谱最大吸收为241.7 nm,可判断该化合物含双键。1H NMR (300 MHz,DMSO-d6)谱中示高场区有4 个甲基质子信号。δ1.68 (1H,d,J=18.6 Hz,H-2),δ1.13 (1H,d,J=18.6 Hz,H-2),δ5.02 (1H,s,H-4),δ6.09(1H,d,J=17.1 Hz,H-1'),δ5.52 (1H,d,J=17.1 Hz,H-2')。从13C NMR (300 MHz,DMSO-d6)谱中可以看出该化合物是典型的成环状单萜类化合物,环内有一个双键和一个酮基。δ40.8 (C-1),δ162.7(C-5),δ198.6 (C-3 or 3'),δ198.5 (C-3 or 3')。鉴定该化合物为去氢催吐萝芙木醇,如图1 (3)。
化合物4 白色粉末,溶于甲醇和水,不溶于乙酸乙酯和氯仿。紫外光谱最大吸收为227.6 nm,324.7 nm,可判断其为香豆素类化合物。从1H NMR(300 MHz,DMSO-d6)谱可以看出共有5 个质子信号,δ7.83 (1H,d,J=9.3 Hz,H-4),δ6.10 (1H,d,J=9.3 Hz,H-3),δ7.42 (1H,d,J=8.4 Hz,H-5),δ6.68 (1H,d,J=8.4 Hz,H-6),δ6.60 (1H,s,H-8)。从13C NMR (300 MHz,DMSO-d6)谱可以看出,该化合物有10 个碳,δ161.8 (C-7),δ160.9 (C-2),δ156.0 (C-9),δ145.0 (C-4),δ130.5 (C-5),δ113.6 (C-6),δ111.8 (C-3),δ111.7 (C-10),δ102.6 (C-8)。综合该化合物的碳氢相关关系HMBC 谱及HSQC 谱,可以确定每个碳和氢相连接的位置和关系,鉴定该化合物为7-羟基-香豆素,如图1(4)。以上数据与文献[7]报道的7-羟基-香豆素基本一致。
化合物5 深黄色粉末,微溶于甲醇和水,不溶于乙酸乙酯和氯仿。紫外光谱最大吸收为298.5 nm,说明该化合物含有一个苯环,且可能存在双键,是最大吸收峰红移。通过HPLC 与标准品比对,保留时间、紫外吸收值及紫外吸收峰型均一致,鉴定其为反式香豆酸,如图1 (5)。
化合物6 浅黄色粉末,微溶于甲醇和水。紫外光谱最大吸收为310.4 nm,推测该化合物存在一个苯环。1H NMR (300 MHz,CD3OD)δ:7.54 (2H,d,J=3 Hz,H-2,6),6.69 (2H,d,J=7.2 Hz,H-3,5)。从13C NMR (300 MHz,CD3OD)谱可以看出该化合物有7 个碳,δ126.7 (C-1),δ132.7 (C-2),115.3 (C-3),δ160.0 (C-4),115.3 (C-5),δ132.7(C-6),δ170.0 (C-7)。DEPT NMR (300 MHz,CD3OD)谱中可以推测该化合物有4 个叔碳和3 个季碳。鉴定该化合物为对羟基苯甲酸,如图1 (6)。以上数据与文献[8]报道的对羟基苯甲酸基本一致。
化合物7 黄色粉末,微溶于甲醇。紫外光谱最大吸收为268.9 nm,354.6 nm,推测该化合物为黄酮类化合物。1H NMR (400 MHz,DMSO-d6)δ12.95 (1H,s,5-OH),δ10.79 (1H,s,7-OH),δ9.31(1H,s,4'-OH),δ7.31 (2H,s,H-2',6' or 3',5')。δ6.96 (1H,s)的单峰,没有耦合裂分,推测黄酮母体3 位没有发生取代。δ6.54 (1H,d,J=2 Hz,H-8),δ6.19 (1H,d,J=2 Hz,H-6),δ3.87(6H,s,H-3',5' or 2',6')。从13C NMR (400 MHz,DMSO-d6)谱中可以看出该化合物含17 个碳。δ181.8 (C-4),δ148.2 (C-3',5'),δ139.8 (C-4')。鉴定该化合物为苜蓿素,即5,7,4'-三羟基-3',5'-二甲氧基黄酮,如图1 (7)。以上数据与文献[9]报道的苜蓿素基本一致。
化合物8 黄色粉末,紫外光谱最大吸收为270.1 nm,352.2 nm,推测该化合物为黄酮类化合物。1H NMR (600 MHz,DMSO-d6)谱与化合物7 氢谱类似,区别为δ12.95 (1H,s,5-OH),δ9.35 (1H,s,4'-OH)处有2 个羟基,δ3.88 (6H,s),δ3.87(3H,s)处有3 个甲氧基,δ6.83 (1H,d,J=1.8 Hz),δ6.20 (1H,d,J=1.8 Hz)与化合7 氢谱中δ6.54 (1H,d,J=2 Hz,H-8),δ6.19 (1H,d,J=2 Hz,H-6)比较,均向低场位移,推测该化合物为化合物7 的7 位羟基被甲氧基取代,故邻位质子向低场位移。13C NMR (600 MHz,DMSO-d6)谱中可看出该化合物有18 个碳,δ56.38 (2C),δ56.07 是三个甲氧基碳信号。因此鉴定该化合物为7-甲氧基-苜蓿素,如图1 (8)。
化合物9 黄色粉末,紫外光谱最大吸收为271.3 nm,348.9 nm,推测该化合物为黄酮类化合物。1H NMR (300 MHz,DMSO-d6)δ2.05 (3H,s,2''-CH3),δ7.29 (2H,H-2',6'),δ6.79 (1H,d,J=8.1 Hz,H-5'),δ6.62 (1H,s,H-3),δ6.55 (1H,s,H-8),δ5.16 (1H,d,J=6.3 Hz,H-5''),δ4.38 (1H,d,J=6.0 Hz,H-1'')。13C NMR (300 MHz,DMSO-d6)谱中可以看出该化合物共21 个碳,δ195.8 (C-4''),δ182.6 (C-4),δ166.3 (C-7),δ164.7 (C-2),δ158.0 (C-5),δ157.6 (C-9),δ150.4 (C-3''),δ150.0 (C-4'),δ147.5 (C-2''),δ146.2 (C-3'),δ121.7 (C-1'),δ119.6 (C-6'),δ116.5 (C-5'),δ114.0 (C-2'),δ109.8 (C-6),δ105.6 (C-10),δ103.4 (C-3),δ90.4 (C-8),δ82.7 (C-5''),δ44.2(C-1''),δ14.6 (2''-CH3)。DEPT NMR (300 MHz,DMSO-d6)谱中可以推测出该化合物有一个伯碳,7个叔碳和13 个季碳。综合该化合物的碳氢相关关系HMBC 谱及HSQC 谱,可以确定每个碳和氢相连接的位置和关系,鉴定该化合物为demethyltorosaflavone,如图1 (9)。以上数据与文献[10]报道的demethyltorosaflavone C (1)基本一致。
化合物10 黄色无定形粉末,紫外光谱最大吸收为295.0 nm,351.0 nm,推测该化合物为黄酮类化合物。1H NMR (400 MHz,DMSO-d6)δ1.13 (3H,d,J=10.4 Hz,5'''-CH3)。δ7.37 和δ7.39 处为单峰与双峰叠加的2 个质子信号,推测为2'、6'位质子。δ6.88 (1H,d,J=8.0 Hz,H-5'),δ6.63 (1H,s,H-3),δ6.48 (1H,s,H-8),δ6.20 (1H,d,J=12.8 Hz,H-1''),δ7.57 (1H,d,J=12.4 Hz,H-2''),δ4.97 (1H,s,H-1''')。δ3.25-3.68 间的质子信号为鼠李糖基2'''、3'''、4'''及5'''位的质子信号。HMBC 谱中,可以看到的相关关系包括H-3/C-2,4,10,1',H-8/C-4,6,7,9,10,H-2'/C-3',4',6',H-5'/C-1',3',4',H-6'/C-2,2',4'。H-1''/C-5,7,2''和H-2''/C-6,1'',1'''表示烯烃碳C-1''和C-6 相连,α-鼠李糖苷和烯烃碳C-2''相连。H-1'''/C-2'',2''',3''',5''',H-2'''/C-3''',4''',H-3'''/C-4''',H-4'''/C-2''',3''',5''',H-5'''/C-3''',4''',H-6'''/C-4''',5'''。综合该化合物的HMBC 谱、COSY 谱及HSQC 谱,确定每个碳和氢相连接的位置和关系,鉴定该化合物为6-反式-(2''-O-α-鼠李糖基)乙烯基-5,7,3',4'-四羟基黄酮,如图1 (10)。以上数据与文献[11]报道的6-反式-(2''-O-α-鼠李糖基)乙烯基-5,7,3',4'-四羟基黄酮基本一致。
化合物11 黄色无定形粉末,紫外光谱最大吸收为212.3 nm,272.4 nm,337.8 nm,推测该化合物为黄酮类化合物。1H NMR (300 MHz,DMSO-d6)δ6.74 (1H,s,H-3),6.45 (1H,s,H-8)为黄酮骨架A,C 环的典型质子信号。δ7.43,δ7.40 处为单峰与双峰叠加的2 个质子信号,推测为2'、6'位质子。δ7.14 (1H,d,J=7.8 Hz,H-5'),δ4.53 (1H,s,H-1''),δ4.77 (1H,s,H-1'''),δ1.05 (3H,d,J=5.4 Hz,H-6'''),δ2.10 (1H,t,H-2'''),δ1.39 (1H,d,J=12.9 Hz,H-2''')。δ3.05-3.99 之间的质子信号归属于2''、3''、4''、5''、6''、3'''、4'''及5'''位。由DEPT 谱推测该化合物有1 个伯碳,2 个仲碳,14 个叔碳和10 个季碳。HMBC 谱显示葡萄糖苷H-1''和黄酮骨架C-4'相关,且13C NMR (300 MHz,DMSOd6)谱中δ101.0 (C-1''),说明葡萄糖苷和黄酮骨架的C-4' 通过C-O-C 键相连。δ70.2 (C-1''')说明洋地黄毒糖苷与黄酮骨架是C-C 键结合,这是C-洋地黄毒糖苷的典型信号。HMBC 谱中显示洋地黄毒糖苷H-1'''与黄酮骨架C-5、C-6 和C-7 相关,说明洋地黄毒糖苷与黄酮骨架C-6 相连。综合该化合物的HMBC 谱及HSQC 谱,确定每个碳和氢相连接的位置和关系,鉴定该化合物为木犀草素-6-C-洋地黄毒糖苷-4'-O-葡萄糖苷,如图1 (11)。以上数据与文献[12]报道的木犀草素-6-C-洋地黄毒糖苷-4'-O-葡萄糖苷基本一致。
化合物12 黄色粉末,紫外光谱最大吸收为247.0 nm,353.4 nm,推测该化合物为黄酮类化合物。1H NMR (500 MHz,DMSO-d6)δ6.47~7.37 之间有5 个质子信号,δ7.37 (2H,s,H-2',6'),δ7.07(1H,s,H-3),δ6.94 (1H,d,J=2 Hz,H-8),δ6.47(1H,d,J=2 Hz,H-6)。δ5.40 (1H,d,H-1''),δ3.90 (6H,s)为2 个甲氧基质子信号,因此推测该化合物母核为苜蓿素。13C NMR (300 MHz,DMSOd6)δ100.7 (C-1''),δ77.9 (C-5'')、77.0 (C-3'')、73.6 (C-2'')、70.2 (C-4'')、61.2 (C-6'')。核磁数据与化合物7 对比,骨架数据基本一致,多出一组糖区信号,且7 位质子信号消失,因此鉴定该化合物为苜蓿素-7-O-葡萄糖苷,如图1 (12)。以上数据与文献[13]报道的苜蓿素-7-O-葡萄糖苷基本一致。
化合物13 黄色粉末,紫外光谱最大吸收为271.3 nm,337.8 nm,推测该化合物为黄酮类化合物。1H NMR (300 MHz,DMSO-d6)δ6.67 (1H,s,H-3),δ6.41 (1H,s,H-8),δ6.34 (1H,s,H-6),δ7.82(2H,d,J=8.1 Hz,H-2',6'),δ6.83 (2H,d,J=8.1 Hz,H-3',5')。推测该化合物母核结构为芹菜素。13C NMR (300 MHz,DMSO-d6)谱说明该化合物有20 个碳,δ103.2 (C-6),δ75.0 (C-1''),。碳谱高场区共有5 个碳信号,糖苷为5 碳糖,根据其化学位移推测其为阿拉伯糖。因此鉴定该化合物为芹菜素-6-C-阿拉伯糖苷,如图1 (13)。以上数据与文献[14]报道的芹菜素-6-C-阿拉伯糖苷基本一致。
化合物14 黄色粉末,紫外光谱最大吸收为270.1 nm,329.5 nm,推测该化合物为黄酮类化合物。1H NMR (500 MHz,DMSO-d6)δ6.47-7.37 区域有5 个质子信号。δ7.07 (1H,s,H-3),δ6.47 (1H,d,J=2 Hz,H-6),δ6.94 (1H,d,J=2 Hz,H-8),δ7.37 (2H,s,H-2',6')。δ5.40 (1H,d,H-1''),δ3.90 (6H,s)为2 个甲氧基的质子信号,因此推断其母核为苜蓿素。13C NMR (300 MHz,DMSO-d6)δ138.04 (C-4'),δ102.4 (C-1''),δ74.6(C-2''),δ77.1 (C-3''),δ70.3 (C-4''),δ77.9 (C-5''),δ61.2 (C-6'')。鉴定该化合物为苜蓿素-4'-O-葡萄糖苷,如图1 (14)。以上数据与文献[14]报道的苜蓿素-4'-O-葡萄糖苷基本一致。
化合物15 黄色粉末,溶于甲醇和水,不溶于氯仿和乙酸乙酯。其紫外光谱最大吸收为272.2 nm,336.6 nm,推测该化合物为黄酮类化合物。通过HPLC 与标准品比对,保留时间、紫外吸收值及紫外吸收峰型均一致,鉴定其为牡荆苷,如图1 (15)。于氯仿和乙酸乙酯。其紫外光谱最大吸收为272.4 nm,336.6 nm,推测该化合物为黄酮类化合物。通过HPLC 与标准品比对,保留时间、紫外吸收值及紫
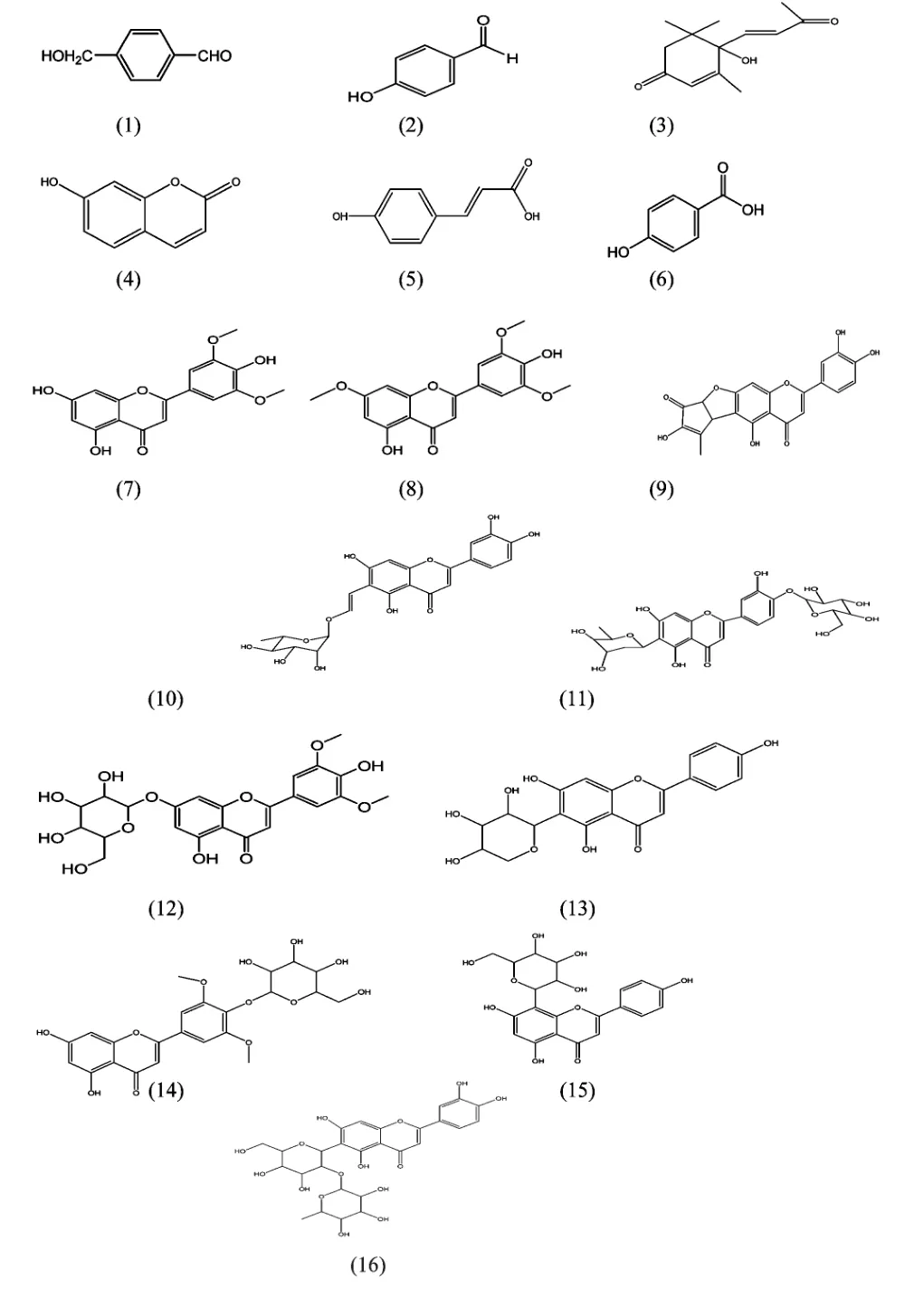
图1 化合物1~16 结构Fig.1 The chemical structures of compounds 1-16
化合物16 黄色粉末,微溶于甲醇和水,不溶外吸收峰型均一致,鉴定其为异荭草苷-2''-O-鼠李糖苷,如图1 (16)。
4 小结与讨论
本文对苦竹叶乙醇提取物中乙酸乙酯相进行了化学成分的分离鉴定研究,共分离鉴定了16 种化合物,包括3 种酚酸类化合物、1 种萜类化合物、1 种香豆素类化合物、1 种苯丙素类化合物及10 种黄酮类化合物,分别为4-羟甲基-苯甲醛(1)、对羟基苯甲醛(2)、去氢催吐萝芙木醇(3)、7-羟基-香豆素(4)、反式香豆酸(5)、对羟基苯甲酸(6)、苜蓿素(7)、7-甲氧基-苜蓿素(8)、demethyltorosaflavone(9)、6-反式-(2''-O-α-鼠李糖基)乙烯基-5,7,3',4'-四羟基黄酮(10)、木犀草素-6-C-洋地黄毒糖苷-4'-O-葡萄糖苷(11)、苜蓿素-7-O-葡萄糖苷(12)、芹菜素-6-C-阿拉伯糖苷(13)、苜蓿素-4'-O-葡萄糖苷(14)、牡荆苷(15)和异荭草苷-2''-O-鼠李糖苷(16),其中除化合物4,7 及12 外,其余化合物均为首次从苦竹叶中分离得到。
竹叶黄酮具有抗氧化、抗衰老、抑菌及抗炎等多种生物活性,是一类生物活性较强的天然产物,用途广泛,如可用于调节血脂及预防心脑血管疾病,还可作为有效成分用于化妆品和饲料添加剂等产品的生产中[15-17]。本文分离得到的化合物中,黄酮类化合物占大多数。苦竹叶中黄酮类化合物应考虑为苦竹叶药理作用的主要物质基础,这一推测有待进一步研究。本文对苦竹叶化学成分的分离与纯化,为阐明苦竹叶药理活性提供了理论依据,对苦竹叶中天然产物的开发利用具有指导意义。
1 Chinese Herbal Medicine Editorial Board of State Administration of Traditional Chinese Medicine(国家中医药管理局《中华本草》编委会).Chinese Herbal Medicine(中华本草).Shanghai:Shanghai Science and Technology Press,1999.Vol 23,406.
2 Wang HB,Yao H,Bao GH,et al.Flavone glucosides with immunomodulatory activity from the leaves of Pleioblastus amarus.Phytochem,2004,65:969-974.
3 Zhang Q(章晴),Hua RM(花日茂),Cao HQ(操海群),et al.Determination of insecticidal activity of Phyllostachys amarus extract and prelim inary purification of its insecticidal ingredients.J Anhui Agri Univ(安徽农业大学学报),2010,37:107-110.
4 Wang HB(王红兵),Yao H(姚慧),Gu WF(顾伟峰),et al.Chemical constituents from the leaves of Pleioblastus amarus.Chin Tradit Herb Drugs(中草药),2004,35:739-740.
5 Wang XL(王学利),Lv JQ(吕健全),Zhang YD(章一德).Analysis of volatile oilcomposition of Pleioblastus amarus.J Zhejiang Forest Coll(浙江林学院学报),2002,19:387-390.
6 Yin J(殷婕),Wu YX(邬云霞),Wu QN(吴启南),et al.Chemical constituents from the lesves of Lophatherum gracile.J Nothwt Pharm(西北药学杂志),2010,25:413-414.
7 Saitoh T,Shibata S.New type chalcones from licorice root.Tetrahedron Lett,1975,50:4461-4462.
8 Zhou HY(周惠燕),Li SM(李士敏).Study on constituents from leaves of Phyllostachys pubescens.Chin Pharm J(中国药学杂志),2006,41:662-663.
9 Zhang HY(张慧艳),Tang F(汤锋),Wang CM(王春梅),et al.Chemical constituents of Lophatherum gracile Brongn..J Anhui Agri Univ(安徽农业大学学报),2011,38:540-542.
10 Susumu K,Michio T.Demethyltorosaflavones C and D from Cassia Nomame.Phytochem,1992,31:2927-2929.
11 Wang GJ,Chen YM,Wang TM,et al.Flavonoids with iNOS inhibitory activity from Pogonatherum crinitum.J Ethnopharm,2008,118:71-78.
12 Guo XF,Yue YD,Tang F,et al.Flavonoids from the leaves of Pleioblastus argenteastriatus.J Asian Na Prod Res,2008,10:903-907.
13 Dai HF(戴好富),Liu YQ(刘玉清),Deng SM(邓世明),et al.Study on chemical constituents of Lychnis coronaria.Nat Prod Res Dev(天然产物研究与开发),2002,14:9-12.
14 Sun J(孙嘏).Studies on constituents of two bamboo species and analysis method about chemical compounds from bamboo leaf.Beijing:Chinese Academy of Forestry(中国林业科学研究院),Postdoctoral.2012.
15 Jing WJ(荆文静).Research progress of flavonoids in bamboo leaves(FBL).Sci-Tech Inform Dev & Econ(科技情报开发与经济),2009,19:139-140,171.
16 Wang CY(王春艳),Liu SL(刘树立),Zhong G(钟耕).Physiological function,extraction technology and development prospect of bamboo leaf flavones.Food Drug(食品与药品),2007,9(4):59-62.
17 Feng XA(冯香安),Liu HN(刘红南),Liu Y(刘莹),et al.Research progress of safety evaluation of Plant flavonoids as feed additives.Chin Feed(中国饲料),2011,12:31-33.
