鹰嘴豆铁蛋白提取工艺优化研究
2014-01-09郝鹏飞唐劲天
辛 敏,黄 昀,郝鹏飞,詹 欣,唐劲天*,盛 军
1北京中医药大学中药学院,北京 100102;2 清华大学工程物理系粒子技术与辐射成像教育部重点实验室,北京 100084;3云南农业大学,普洱茶学教育部重点实验室,昆明 650201
鹰嘴豆(Cicer arietinum L.)是豆科鹰嘴豆属植物,作为重要的植物蛋白来源广泛种植于世界诸多地区,具有极高的营养价值[1]。同时,鹰嘴豆是重要的维吾尔医用传统药材,具有悠久的药用历史,对缺铁性疾病引起的乏力、食欲不振、皮肤瘙痒等症状具有明显改善作用。植物铁蛋白是广泛存在于动物、植物及微生物体中的一种铁贮藏蛋白,由24 个同源或异源亚基所结合成的一个蛋白质复合体。目前已在豆科植物,如大豆、豌豆、黄豆、蚕豆、黑豆、红小豆、羽扇豆中都发现了植物铁蛋白的存在。铁蛋白是植物光合作用和固氮等生化反应的铁源,具有调节生物体细胞内铁代谢平衡的功能[2]。作为一种重要的胁迫反应蛋白,铁蛋白在植物发育中起了重要作用[3]。近年来研究发现,植物铁蛋白补铁效果好,可有效地缓解铁缺乏症,且无毒副作用,是一种新型的天然铁补充剂。同时,植物铁蛋白还具有降脂降糖、抗肿瘤、抗氧化、抗HIV 等诸多生物活性[4]。
本研究以鹰嘴豆为研究对象,在单因素实验基础上采用正交实验方法,综合考虑生产成本及提取率等因素,成功优化铁蛋白的提取工艺,为其作为植物补铁制剂进一步开发与利用提供理论依据。
1 材料与方法
1.1 材料与仪器
鹰嘴豆于2011 年10 月购自新疆木垒县,经中国医学科学院药用植物研究所刘新民教授鉴定为豆科鹰嘴豆属植物鹰嘴豆(Cicer arietinum L.);凯基Braford 蛋白含量检测试剂盒(南京凯基生物科技发展有限公司);其余试剂均为国产分析纯;二次蒸馏水;超纯水。
himac CF 16RX 冷冻离心机(日本日立公司);iMark 酶标仪(美国伯乐公司);MH-2 微量振荡器(澳门市其林贝尔仪器制造有限公司);BM255C 搅拌机(美的集团有限公司);Venticell 烘箱(德国MMM 公司);Seven Easy 酸度计(美国梅特勒-托利多公司);NANOpure 超纯水系统(美国巴恩斯特德公司);AL204-IC 电子天平(美国梅特勒-托利多公司)。
1.2 实验方法
1.2.1 Fe2+浓度标准曲线方程的测定
准确称取FeSO4·7H2O 晶体1.0000 g,加水溶解并于10 mL 棕色容量瓶中定容。精密量取此溶液1 mL,加入100 mL 棕色容量瓶中稀释至刻度,作为待测母液。精密移取母液0、1、2、3、4、5 μL 于96 孔板中,加水稀释至180 μL,加入30 μL 20%连二亚硫酸钠溶液还原后,再加入40 μL 0.1%邻菲咯啉溶液染色。混匀,放置2 min 后,酶标仪混匀10 s 在510 nm 波长下检测吸光值。以吸光度(A)为纵坐标,浓度(C,μg/mL)为横坐标,绘制出标准曲线,并计算出标准回归方程。
1.2.2 邻菲咯啉显色法测定提取液中Fe2+含量
根据Fe2+与邻菲咯琳络合后显特殊的桔红色的反应原理,在96 孔酶标板小孔中加入10 μL 待测液,20 μL 超纯水,30 μL 20%的连二亚硫酸钠溶液还原后,再加入40 μL 0.1%邻菲咯琳溶液,混匀,放置2 min 后,酶标仪混匀10 s 在510 nm 波长下检测[5]。根据所测吸光度,可计算Fe2+浓度=(吸光度-常数项)/回归系数。
1.2.3 蛋白质浓度标准曲线方程的测定
用凯基Braford 蛋白含量检测试剂盒,以吸光度(A)为纵坐标,浓度(C,g/L)为横坐标,绘制出标准曲线,并计算出标准回归方程。
1.2.4 Bradford 分光光度法测定提取液中蛋白质含量
利用考马斯亮蓝G-250 与蛋白质结合显蓝色的特性,在96 孔酶标板小孔中加入1 μL 待测液,4 μL超纯水,195 μL 考马斯亮蓝G-250 染色后,混匀,放置2 min 后,酶标仪混匀10 s 在570 nm 波长下检测。根据所测吸光度,可计算总蛋白浓度=(吸光度-常数项)/回归系数。
1.2.5 提取液干重的测定
精密量取7.5 mL 待测提取液于干燥培养皿中进行60 ℃鼓风干燥直至恒重,平行测定3 次,即可测得提取液干重。
1.2.6 单因素实验
参考袁小红[5]豌豆种子铁蛋白预处理及盐析,增加种子匀浆后缓冲液清洗3 次(20、20、10 mL)步骤。分别考虑缓冲液种类(KH2PO4-NaOH 缓冲液、Tris-HCl 缓冲液)、pH 值(7.0、7.5、8.0、8.5、9.0)、料液比(1∶1、1∶2、1∶3、1∶4)、盐析盐种类(50 mmol/L 的MgCl2、饱和度为15%~20%的(NH4)2SO4、盐析浓度(10、20、30、40、50、60、70、80 mmol/L)对鹰嘴豆铁蛋白提取工艺的影响[6-9]。
采用1.2.2、1.2.4、1.2.5 方法进行铁浓度、蛋白浓度、总提取物干重的测定。以铁含量代表铁蛋白含量,按如下公式分别计算铁蛋白提取率,总蛋白提取率。
铁蛋白提取率=稀释倍数×Fe2+浓度×待测液体积/鹰嘴豆种子质量
总蛋白提取率=稀释倍数×总蛋白浓度×待测液体积/鹰嘴豆种子质量
1.2.7 正交实验优化提取工艺
根据单因素实验结果及文献[7]报道温度对铁蛋白提取的影响,确定鹰嘴豆种子中提取铁蛋白的正交实验因素和水平,采用SPSS 软件进行L9(34)正交实验设计,优化铁蛋白提取工艺,平行重复3次。
采用1.2.2、1.2.4、1.2.5 方法进行铁浓度、蛋白浓度、干重的测定。
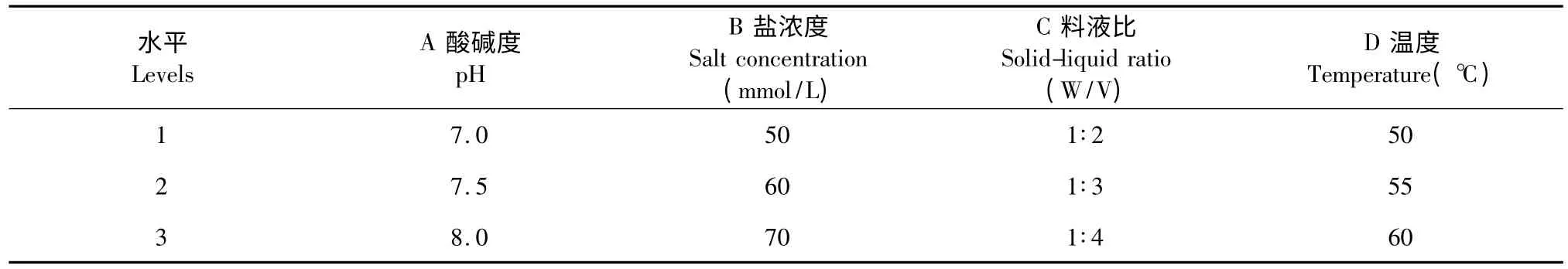
表1 铁蛋白提取L9(34)正交实验因素水平表Table 1 Factors and levels of L9(34)orthogonal experimental design for extraction of ferritin
1.2.8 数据处理
各实验均重复3 次以确保实验结果的准确性,所得实验数据用SPSS17.0 处理行t 检验及方差分析。
2 结果与分析
2.1 线性关系及回归方程
以1.2.1 方法测定Fe2+线性关系,得到Fe2+标准曲线方程:A=0.142C-0.023,R2=0.9990。表明在4~20 μg/mL 范围内,Fe2+浓度与吸光度呈线性关系。
以1.2.3 方法测定总蛋白线性关系,得到总蛋白标准曲线方程:A=19.400C+0.028,R2=0.9960。表明在0.005~0.025 g/L 定范围内,总蛋白浓度与吸光度呈线性关系。
2.2 单因素实验
2.2.1 缓冲液种类的筛选
在缓冲液pH 7.0,50 mmol/L 的MgCl2盐析,料液比1∶2 提取条件下,缓冲液种类对鹰嘴豆铁蛋白提取的影响结果如表2 所示。

表2 不同缓冲液下铁蛋白提取率、总蛋白提取率及干重的比较Table 2 Comparison of ferritin extraction yield,protein extraction yield and dry weight under different buffers
由表2 可知,KH2PO4-NaOH 缓冲液组铁蛋白提取率高于Tris-HCl 缓冲液组铁蛋白提取率,组间差异无统计学意义(P >0.05)。KH2PO4-NaOH 缓冲液组总蛋白提取率低于Tris-HCl 缓冲液组总蛋白提取率,组间存在显著性差异(P <0.05)。KH2PO4-NaOH 缓冲液组干重均值0.1337 g 低于Tris-HCl 缓冲液组干重均值0.1761 g,组间存在显著性差异(P<0.05)。
KH2PO4-NaOH 缓冲液组在铁含量检测中高于Tris-HCl 缓冲液组,且在总蛋白提取率及物质干重方面低于Tris-HCl 缓冲液组,说明KH2PO4-NaOH 缓冲液利于铁蛋白的富集,且所含杂蛋白少,纯度高,故选择KH2PO4-NaOH 缓冲液作为鹰嘴豆铁蛋白提取的缓冲液。
2.2.2 缓冲液pH 值的筛选
在KH2PO4-NaOH 缓冲液,50 mmol/L 的MgCl2盐析,料液比1∶2 提取条件下,缓冲液pH 值对鹰嘴豆铁蛋白提取的影响结果如表3 所示。
以铁蛋白提取率为指标,当缓冲液pH 为7.5时,与pH 为7.0、8.0、8.5、9.0 组比较,均存在显著性差异(P <0.05),且缓冲液pH 为7.5 时铁蛋白提取率存在最大值。以总蛋白提取率为指标,缓冲液pH 7.5 组与pH 7.0 组、9.0 组存在显著性差异(P<0.05),其余各组间无统计学意义。当缓冲液pH为7.5 时总蛋白提取率存在最大值。以干重为指标,缓冲液pH 7.5 组与pH 7.0 组、8.5 组、9.0 组存在显著性差异(P <0.05),其余各组间无统计学意义。当缓冲液pH 为7.5 时物质干重存在最大值。
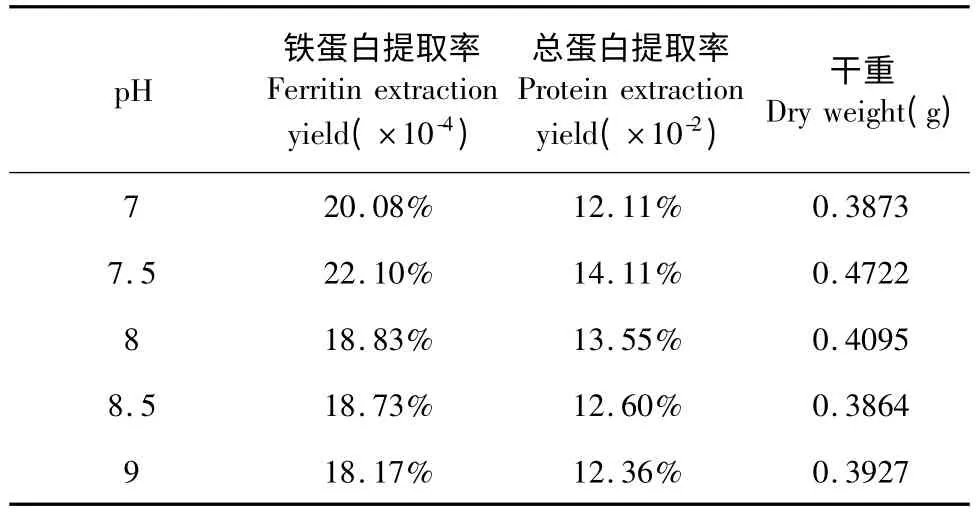
表3 不同pH 值下铁蛋白提取率、总蛋白提取率及干重的比较Table 3 Comparison of ferritin extraction yield,protein extraction yield and dry weight under different pH
由表3 可知,缓冲液pH 值对鹰嘴豆铁蛋白提取有显著影响。当缓冲液pH 为7.5 时,鹰嘴豆铁蛋白提取率存在最大值,且与其余组存在显著性差异,当pH 继续升高,一方面降低铁蛋白含量,另一方面会降低铁蛋白食用价值[10]。故pH 7.5 为鹰嘴豆铁蛋白提取缓冲液pH 最适值。
2.2.3 盐析盐种类的筛选
在pH 7.5 的KH2PO4-NaOH 缓冲液,料液比1∶2 提取条件下,盐种类对鹰嘴豆铁蛋白提取的影响结果如表4 所示。
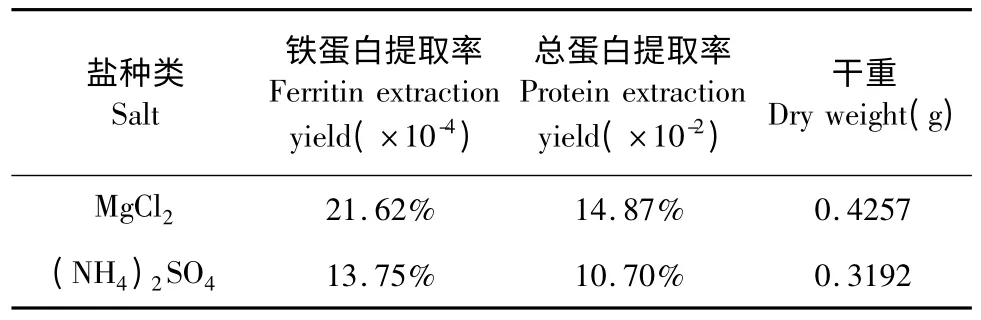
表4 不同盐种类下铁蛋白提取率、总蛋白提取率及干重的比较Table 4 Comparison of ferritin extraction yield,protein extraction yield and dry weight under different salt
50 mmol/L 的MgCl2盐析组铁蛋白提取率高于饱和度为15%~20%的(NH4)2SO4盐析组,组间存在极显著性差异(P <0.01)。50 mmol/L 的MgCl2盐析组总蛋白提取率高于饱和度为15%~20%的(NH4)2SO4盐析组,组间无统计学意义(P >0.05)。50 mmol/L 的MgCl2盐析组物质干重高于加饱和度为15%~20%的(NH4)2SO4盐析组物质干重,组间存在极显著性差异(P <0.05)。
在鹰嘴豆铁蛋白分离纯化过程中,加入MgCl2先析出淀粉,再析出铁蛋白,可以通过离心去除部分淀粉[7]。实验数据表明,MgCl2可特异的从鹰嘴豆种子提取液中盐析出铁蛋白,且盐析效果显著优于(NH4)2SO4盐析,与文献[2]报道一致,故选取MgCl2盐析。
2.2.4 盐浓度的筛选
在pH 7.5 的KH2PO4-NaOH 缓冲液,MgCl2盐析,料液比1∶2 提取条件下,盐浓度对鹰嘴豆铁蛋白提取的影响结果如表5 所示。

表5 不同盐浓度下铁蛋白提取率、总蛋白提取率及干重的比较Table 5 Comparison of ferritin extraction yield,protein extraction yield and dry weight under different salt concentration
由表5 可知,当盐浓度在10~60 mmol/L 变化时,随着盐浓度的增加,铁蛋白提取率增大。但当盐浓度继续增加时,铁蛋白提取率下降。60 mmol/L时存在最大值。当盐浓度在10~70 mmol/L 变化时,随着盐浓度的增加,总蛋白提取率、干重增大。但当盐浓度继续增加时,总蛋白提取率及干重均下降。70 mmol/L 时总蛋白提取率最高为2.436%,干重最高为0.5913 g。当盐浓度为60 mmol/L 时,铁浓度存在最大值,且杂蛋白含量低于70 mmol/L,利于铁蛋白的富集,故选取60 mmol/L 为MgCl2盐析浓度。
2.2.5 料液比的筛选
在pH 7.5 的KH2PO4-NaOH 缓冲液,50 mmol/L的MgCl2盐析提取条件下,料液比对鹰嘴豆铁蛋白提取的影响结果如表6 所示。
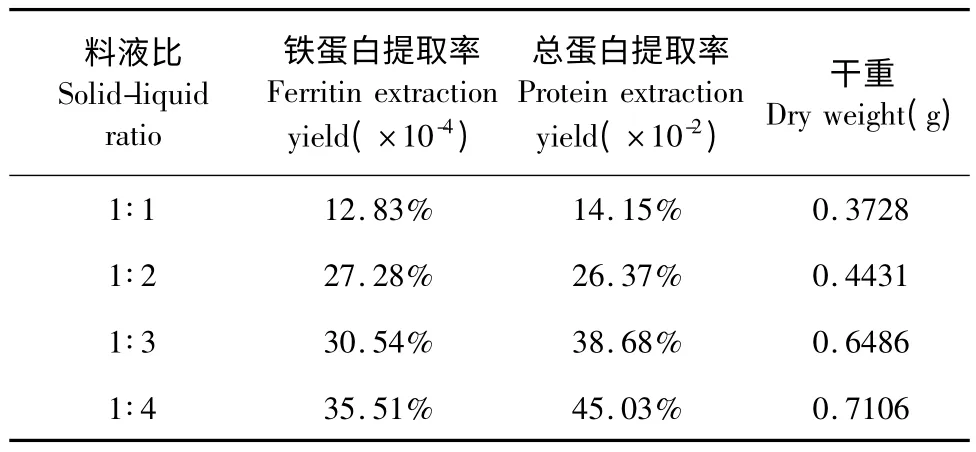
表6 不同料液比下铁蛋白提取率、总蛋白提取率及干重的比较Table 6 Comparison of ferritin extraction yield,protein extraction yield and dry weight under different solid-liquid ratio
实验数据表明,随着料液比的增大,所得鹰嘴豆铁蛋白提取率、总蛋白提取率、物质干重均逐步增加,且趋于平台区。因为适当增大料液比,有利于蛋白质的溶出,从而使铁蛋白含量增加。但料液比过大会使铁蛋白浓度降低,且增加后续工艺中提取液的浓缩成本。故选取1∶4 为最佳料液比。
2.3 正交实验
根据单因素实验结果,以鹰嘴豆种子中铁蛋白提取率、总蛋白提取率、干重为考察指标,进行L9(34)正交实验,实验结果见下表。
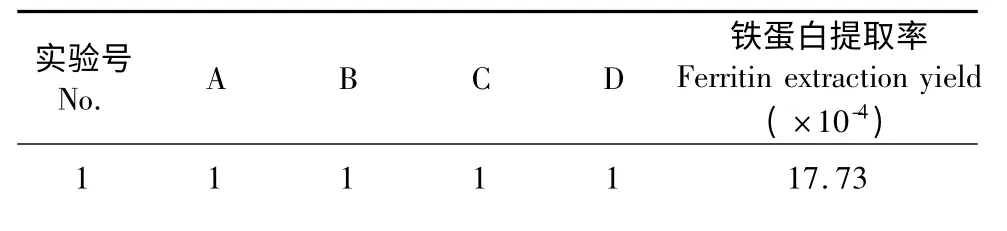
表7 -1 L9(34)正交实验设计及铁蛋白提取率结果Table 7 -1 L9(34)orthogonal array design and results of ferritin extraction yields

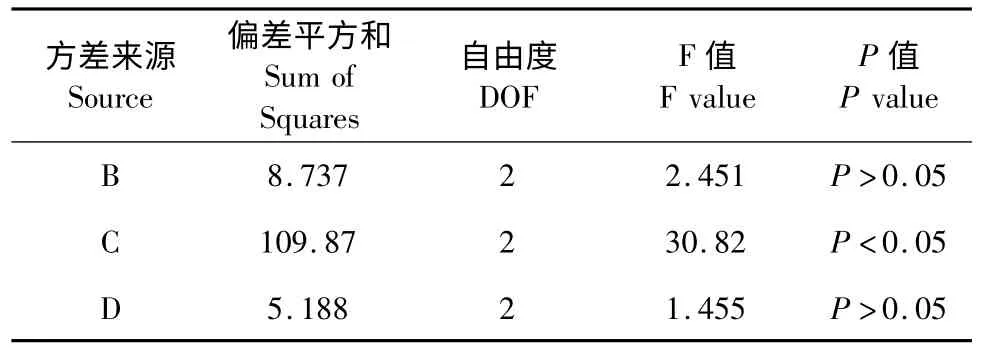
表7 -2 L9(34)正交实验铁蛋白提取率方差表Table 7 -2 Analysis of variance for ferritin extraction yield with different extraction conditions
由表7-1 极差分析可知,以铁蛋白提取率为指标,影响鹰嘴豆铁蛋白提取工艺因素的主次顺序为料液比>盐浓度>温度>pH,经方差分析,料液比对鹰嘴豆铁蛋白的提取有显著影响。最佳提取工艺条件为A2B3C3D1,即缓冲液pH 7.5,70 mmol/L 氯化镁盐析,料液比1∶4,温度50 ℃提取。
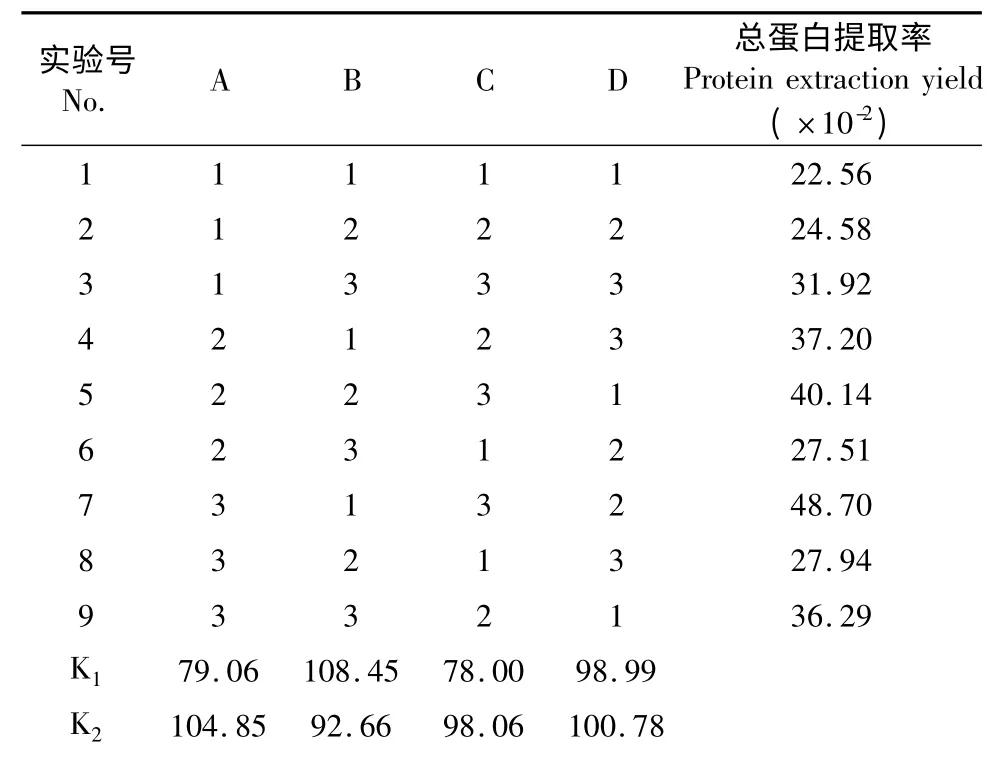
表8 -1 L9(34)正交实验设计及总蛋白提取率结果Table 8 -1 L9(34)orthogonal array design and results of protein extraction yield

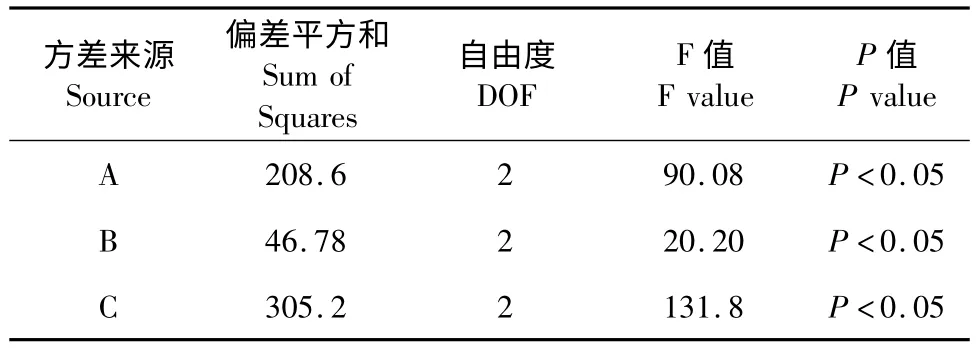
表8 -2 L9(34)正交实验总蛋白提取率方差表Table 8 -2 Analysis of variance for protein extraction yield with different extraction conditions
由表8-1 极差分析可知,以总蛋白提取率为指标,影响鹰嘴豆铁蛋白提取工艺因素主次顺序为料液比>pH >盐浓度>温度,经方差分析,pH、盐浓度、料液比对鹰嘴豆铁蛋白提取有显著性影响。最佳提取工艺为A3B1C3D2,即缓冲液pH 8.0,50 mmol/L 氯化镁盐析,料液比1∶4,温度55 ℃提取。

表9 -1 L9(34)正交实验设计及干重结果Table 9 -1 L9(34)orthogonal array design and results of dry weight
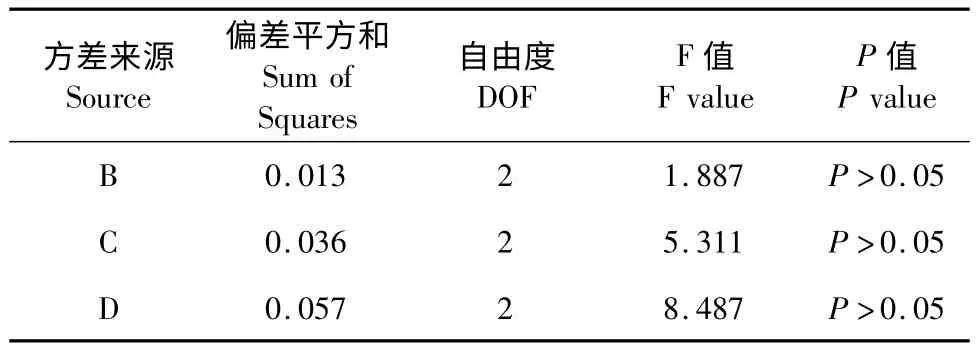
表9 -2 L9(34)正交实验干重方差表Table 9 -2 Analysis of variance for dry weight with different extraction conditions
由表9-1 极差可知,以干重为指标,影响鹰嘴豆铁蛋白提取工艺因素主次顺序为温度>料液比>盐浓度>pH。最佳提取工艺为A2B1C3D2,即缓冲液pH 7.5,50 mmol/L 氯化镁盐析,料液比1∶4,温度55 ℃提取。
综合鹰嘴豆铁蛋白提取正交实验结果的极差分析、方差分析,以铁蛋白提取率、总蛋白提取率、干重为评价指标,最终确定提取工艺条件为A2B3C3D1,即缓冲液pH 7.5,70 mmol/L 氯化镁盐析,料液比1∶4,温度50 ℃提取,可使铁蛋白浓度最大化时,尽可能降低杂蛋白、淀粉、糖等物质含量。
2.4 验证实验
用上述确定的最佳提取工艺条件进行3 次平行实验,鹰嘴豆铁蛋白提取率为0.002643%,说明所选取的工艺稳定。
3 结论
本研究以干燥鹰嘴豆种子为原料,在单因素实验的基础上,进行L9(34)正交实验确定的最优工艺参数为,pH 7.5 的KH2PO4-NaOH 缓冲液,浓度70 mmol/L 的MgCl2盐析,料液比1∶4,作用温度50 ℃。本工艺具有操作简单、提取效果好、成本低等优点,可为工业化鹰嘴豆铁蛋白的提取提供一定理论依据。
1 Torres-Fuentes C,Alaiz M,Vioque J.Affinity purification and characterization of chelating peptides from chickpea protein hydrolysates.Food Chem,2011,129:485-490.
2 Laulhere JP,Lescure AM,Briat JF.Purification and characterization of ferritins from maize,pea,and soyabean seeds.J Biol Chem,1998,263:10289-10294.
3 Chen LP(陈丽萍),Zhang LJ(张丽静),Fu H(傅华).Progress in research on plant ferritin.Acta Pratac Sin(草业学报),2010,19:263-371.
4 Yang JM(杨建梅),Zhang H(张慧),Yu C(余琛),et al.Progress in research on chickpea seed.J Liaoning Univ TCM(辽宁中医药大学学报),2010,12:89-90.
5 Yuan XH(袁小红).Purification of ferritin from pea seed and preparation of its antiserum.Chongqing:Southwest Agricultural University(西南农业大学),MSc.2002.
6 Singh N,Kayastha AM.Purification and characterization of α-galactosidase from white chickpea(Cicer arietinum).J Agric Food Chem,2012,60:3253-3259.
7 Hu J(胡菊),Liao XY(廖夏云),Deng JJ(邓建军),et al.New method of soybean seed ferritin purification and comparison of activity with pea seed ferritin,Chem J Chin U(高等学校化学学报),2009,30:2003-2008.
8 Liu WY(刘文营).Purification,characterization and biochemical properties of ferritin from chick pea seeds.Xinjiang:Shihezi University(石河子大学),MSc,2011.
9 Yun SJ,Yang SP,Huang LY.Isolation and characterization of a new phytoferritin from broad bean(Vicia faba)seed with higher stability compared to pea seed ferritin.Food Res Int,2012,48:271-276.
10 Zhou LQ(周丽卿),Du SK(杜双奎),Zhao J(赵佳),et al.Optimization of chickpea protein extraction using response surface methodology.Food Sci (食品科学),2012,33(8):66-70.
