玉米黄素转化为虾青素的工艺参数研究
2014-01-09王严飞刘燕青陶正国陈小兵
王严飞 ,刘燕青,陶正国,陈小兵,陈 佳,余 勃,陆 豫*
1南昌大学中德联合研究院,南昌 330047;2 南昌大学药学系,南昌 330006;3 广州立达尔生物科技有限公司,广州 510530
虾青素和玉米黄素是两个非常重要的类胡萝卜素,其抗氧化、抗癌、防治心血管疾病、增强机体免疫等生物活性受到人们越来越多的关注[1]。虾青素是在鸟类和鱼类中发现的,包括虾、蝲蛄、蟹和龙虾在内的大多数甲壳类动物由于虾青素在体内的聚集而呈现红色。野生鲑鱼同样是由于虾青素的作用而呈现粉红色。由于水产养殖业中缺乏天然食用色素来源,虾青素可以用来使水产品呈现出消费者所想要的粉红色。研究发现虾青素不仅是鱼类着色及正常生长和健康必不可少的,也可用于养禽业来增加蛋黄的色泽[2,3]。虾青素在某些植物和藻类中也有发现。事实上,动物本身并不能合成虾青素,而是藻类和植物为它们提供这种类胡萝卜素来源[4,5]。随着虾青素在食品、化妆品和饲料中的应用越来越广泛,具有天然构型的虾青素的工业化生产具有巨大的市场[6]。本课题组在研究由天然叶黄素转化为玉米黄素的时候发现,可以直接通过一步氧化玉米黄素得到虾青素,由于原料玉米黄素保持了叶黄素的天然手性结构,所以通过氧化玉米黄素得到的虾青素也保持了这一天然手性[7]。而具有天然手性结构的虾青素和非天然手性结构的虾青素在体内的代谢过程是不一样的,后续本课题组将继续研究所得到的保持有天然手性的虾青素在动物体内的生物效价的评估。
由玉米黄素转化为虾青素的研究方面报道比较少,其中Ribera Ruiz 等[8]人以次氯酸钠为氧化剂,4-乙酰胺-2,2,6,6-四甲基哌啶-1-氧为催化剂得到虾青素。青岛大学的鹿林[9]也以玉米黄素氧化为虾青素,但是产率都较低。本文对实验中的影响因素进行了优化,以期提高转化率,提高工业效应。
1 实验部分
1.1 主要仪器与试剂
仪器:78-1 型恒温磁力搅拌器(上海南汇电器厂);LC-15C 型高效液相色谱仪(日本岛津,SPD-15C 紫外-可见光检测器);RV05-ST 型旋转蒸发仪(JANKE&KUUNKEL 实验仪器公司);ZQ400 型质谱仪(美国Wasters 公司,质谱条件:毛细管电压3.00 KV,锥孔电压30 V,提取电压3 V,离子源温度110℃,脱溶剂气温度350 ℃,脱溶剂气流度250 L/h,锥孔气流量50 L/h,正离子模式电喷雾质谱分析)。
试剂:玉米黄素(本课题组合成);全反式虾青素标准品(化学合成,广州智特奇生物科技有限公司提供);2,6-二叔丁基对甲酚、三氯甲烷、溴酸钠、次氯酸钠、过氧化氢、过氧乙酸、二氧化锰、硫代硫酸钠、碘、甲醇、二氯甲烷、丙酮、二甲基亚砜均为分析纯。
1.2 色谱分析条件
色谱柱:Hypersil BOS C18(250 mm ×4.6 mm,5 μm);流动相:V(甲醇)∶V(乙腈)∶V(水)=70∶25∶5;检测波长:481 nm;流速:1 mL/min;进样量:20 μL;柱温:室温。
1.3 实验步骤
在通有氮气保护的三口瓶中加入20 mL 溶剂和0.5 g 玉米黄素(由本课题组从天然提取的叶黄素制取,下同),待玉米黄素完全溶解后,分别加入用氢氧化钠调好pH 值的氧化剂溶液。取少量的碘溶于10 mL 溶剂后加入烧瓶中,一定温度下,剧烈搅拌反应一段时间。加入少量2,6-叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 检测。
经初步实验和本实验室多年来对类胡萝卜素研究积累经验以及文献[8-10]报道,首先对溶剂和氧化剂的种类进行了初步筛选。然后对溶剂量、氧化剂量、pH 值、反应温度、反应时间五个因素进行了优化。
1.3.1 溶剂对转化率的影响
在氮气保护的100 mL 三口烧瓶中分别加入20 mL 二氯甲烷、三氯甲烷、丙酮、甲醇和二甲亚砜,将0.5 g 玉米黄素溶解于溶剂中,分别加入3 g 用氢氧化钠调pH 值为9.5 的溴酸钠溶液10 mL。取少量的碘溶于10 mL 三氯甲烷后加入烧瓶中,一定温度下,剧烈搅拌反应一段时间。加入少量2,6-二叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 检测按面积归一化方法计算含量。
1.3.2 氧化剂对转化率的影响
玉米黄素经氧化剂氧化即可得到虾青素,本文就对氧化剂进行了筛选。在氮气保护下,在三口瓶中加入20 mL 三氯甲烷和0.5 g 玉米黄素,待玉米黄素完全溶解后,分别加入调好pH 值的氧化剂溴酸钠、次氯酸钠、二氧化锰、过氧化氢和过氧乙酸。取少量的催化剂溶于10 mL 三氯甲烷后加入烧瓶中,一定温度下,剧烈搅拌反应一段时间。加入少量2,6-二叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 跟踪监测。
1.3.3 pH 值对转化率的影响
在氮气保护的100 mL 三口烧瓶中加入20 mL三氯甲烷和0.5 g 玉米黄素,待玉米黄素完全溶解后,分别加入pH 值为3.5、4.5、5.5、7、8.5、9.5、10.5 的溴酸钠,取少量碘溶于10 mL 三氯甲烷后加入反应液中。一定温度下,剧烈搅拌,反应一段时间。加入少量2,6-二叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 检测。
1.3.4 温度对转化率的影响
在氮气保护的100 mL 三口烧瓶中加入20 mL三氯甲烷和0.5 g 玉米黄素,待玉米黄素完全溶解后,加入3 g pH 为9.5 的溴酸钠,取少量碘溶于10 mL 三氯甲烷后加入反应液中。分别设定温度为10、15、20、25、30、35、40 ℃,剧烈搅拌,反应一段时间。加入少量2,6-二叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 检测。
1.3.5 反应时间对转化率的影响
在氮气保护的100 mL 三口烧瓶中加入20 mL三氯甲烷和0.5 g 玉米黄素,待玉米黄素完全溶解后,加入3 g pH 为9.5 的溴酸钠,取少量碘溶于10 mL 三氯甲烷后加入反应液中,30 ℃下剧烈搅拌反应3、6、9、12、15、18、21 h。加入少量2,6-二叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 检测。
1.3.6 三氯甲烷用量对转化率的影响
在氮气保护的100 mL 三口烧瓶中分别用三氯甲烷/玉米黄素(v/m)10、20、30、40 和50 用量的三氯甲烷,将0.5 g 玉米黄素溶解于三氯甲烷中,加入3 g pH 值为9.5 的溴酸钠溶液10 mL,取少量碘溶于10 mL 三氯甲烷后加入反应液中。一定温度下,剧烈搅拌,反应一段时间。加入少量2,6-二叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 检测。
1.3.7 溴化钠用量对转化率的影响
在氮气保护的100 mL 三口烧瓶中加入20 mL三氯甲烷和0.5 g 玉米黄素,待玉米黄素完全溶解后,分别加入溴酸钠/玉米黄素3、4.5、6、7.5、9 当量比的pH 值为9.5 的溴酸钠,取少量碘溶于10 mL三氯甲烷后加入反应液中。一定温度下,剧烈搅拌,反应一段时间。加入少量2,6-二叔丁基对甲酚,饱和硫代硫酸钠溶液洗三次,再纯水洗三次,除去溶剂,HPLC 检测。
2 结果与讨论
2.1 溶剂对转化率的影响
5 种溶剂所得实验结果如表1 所示。

表1 不同溶剂对虾青素含量的影响Table 1 The effect of different solvents on the content of astaxanthin
从表1 中可以看出,二氯甲烷和三氯甲烷作为溶剂时,虾青素含量较高。丙酮、甲醇和二甲亚砜中没有明显反应,这是因为它们能与氧化剂溶液中的水混溶,玉米黄素析出,反应不进行。二氯甲烷沸点太低,不宜在升温和长时间条件下作为反应溶剂,所以选择三氯甲烷为反应溶剂。
2.2 最佳氧化剂的选择
5 种氧化剂所得结果如表2 所示。
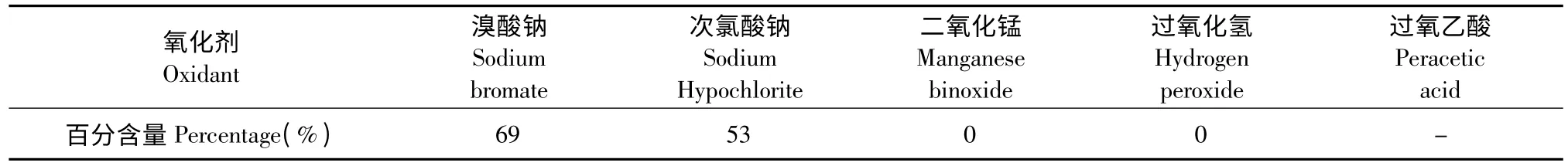
表2 不同氧化剂对虾青素含量的影响Table 2 The effect of different oxidants on the content of astaxanthin
从表2 中可以看出溴酸钠和次氯酸钠可以较好的将玉米黄质氧化为虾青素,次氯酸钠反应时间稍长或稍过量玉米黄素都将很快被破坏,不易控制,溴酸钠则不会,相比较溴酸钠更好;二氧化锰和过氧化氢作氧化剂时没有明显反应;而过氧乙酸氧化性太强,直接将玉米黄质破坏。所以选取溴酸钠作为玉米黄素氧化为虾青素的氧化剂。
2.3 pH 值对转化率的影响
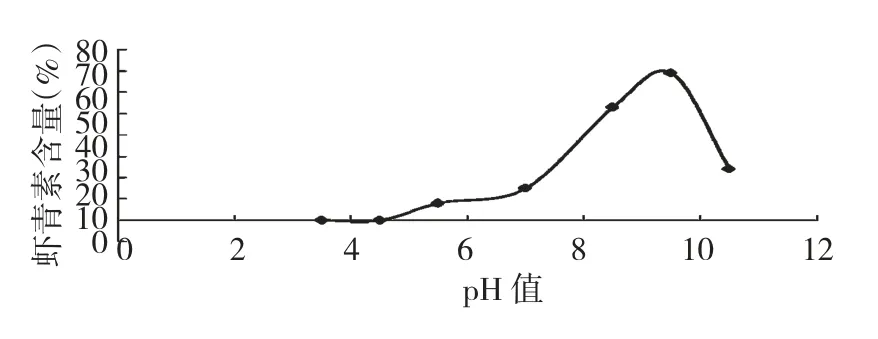
图1 pH 值对虾青素含量的影响Fig.1 Effect of the pH value on the content of astaxanthin
由图1 可以看出随着反应体系pH 值的增大,虾青素含量相应增加,当pH 值达到9.5 时,虾青素含量达到最大值,碱性有利于玉米黄质转化为虾青素,但碱性过强会破坏虾青素双键结构。所以反应体系PH 值优化为9.5。
2.4 温度对转化率的影响
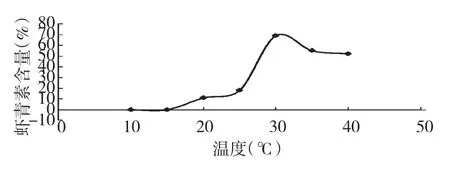
图2 温度对虾青素含量的影响Fig.2 Effect of the temperature on the content of astaxanthin
由图2 可以看出温度对虾青素含量的影响较大,低温不利于玉米黄质向虾青素的转化,温度过高使虾青素氧化破坏。所以最佳反应温度优选为30 ℃。
2.5 反应时间对转化率的影响
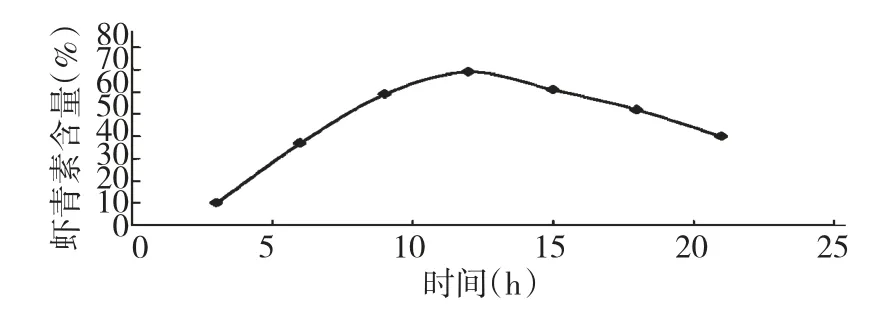
图3 反应时间对虾青素含量的影响Fig.3 Effect of the reaction time on the content of astaxanthin
由图3 可以看出随着反应时间的延长,虾青素的含量先增加,随后下降,在12h 时虾青素含量达到最大值,所以,反应时间选取为12h。
2.6 三氯甲烷用量对转化率的影响
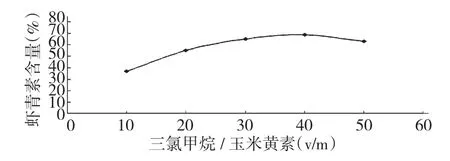
图4 三氯甲烷量对虾青素含量的影响Fig.4 Effect of the trichloromethane on the content of astaxanthin
从图4 可以看出,三氯甲烷/玉米黄素为40 时虾青素含量最高,随三氯甲烷用量的增加,虾青素含量开始下降,所以三氯甲烷/玉米黄素选择为40。
2.7 溴酸钠用量对转化率的影响
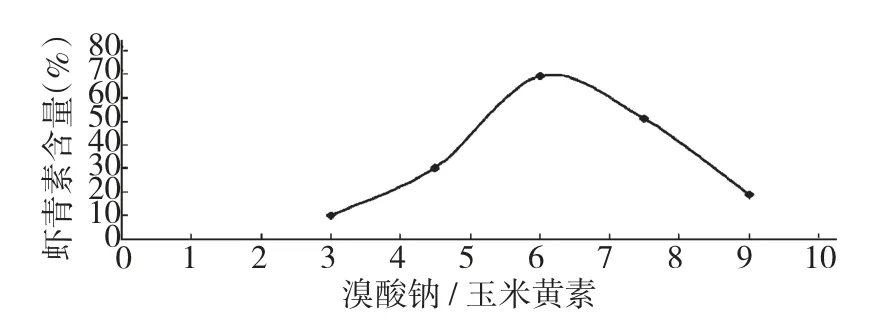
图5 氧化剂量对虾青素含量的影响Fig.5 Effect of the oxidant on the content of astaxanthin
从图5 中可以看出随着氧化剂量的增加,虾青素含量逐渐增加,但当溴酸钠/玉米黄素达到6 以后,虾青素开始部分被氧化,含量开始下降。所以溴酸钠/玉米黄素最佳区间为5~7,优选为6。
2.8 虾青素的表征
经实验对反应条件进行优化,以三氯甲烷为溶剂,溴酸钠为氧化剂,当三氯甲烷用量为20 mL,溴酸钠的用量为3 g,pH 为9.5,反应温度为30 ℃,反应时间为12 h,得到的虾青素粗品经HPLC 检测按面积归一化法计算其虾青素含量达到69%。从图6可以看出在t=11.10 min 和t=13.13 min 有2 个主峰,这两个主峰分子离子峰均为597,与虾青素的相对分子质量相符。从图7 的红外谱图可以看出,在1630.43 和1524.90 出现了2 个羰基伸缩振动的特征吸收,3302.02 有羟基的特征吸收,进一步证明了我们得到了虾青素。我们对这2 个主峰进行分离提纯并做了核磁共振鉴定,并与全反式虾青素标准品进行了对照,发现1 号峰是全反式虾青素,那么2 号峰就是一个顺式虾青素。由于一维的核磁共振谱图无法判断出顺式虾青素的具体位置,后续我们将通过二维核磁共振确定顺式虾青素的结构。
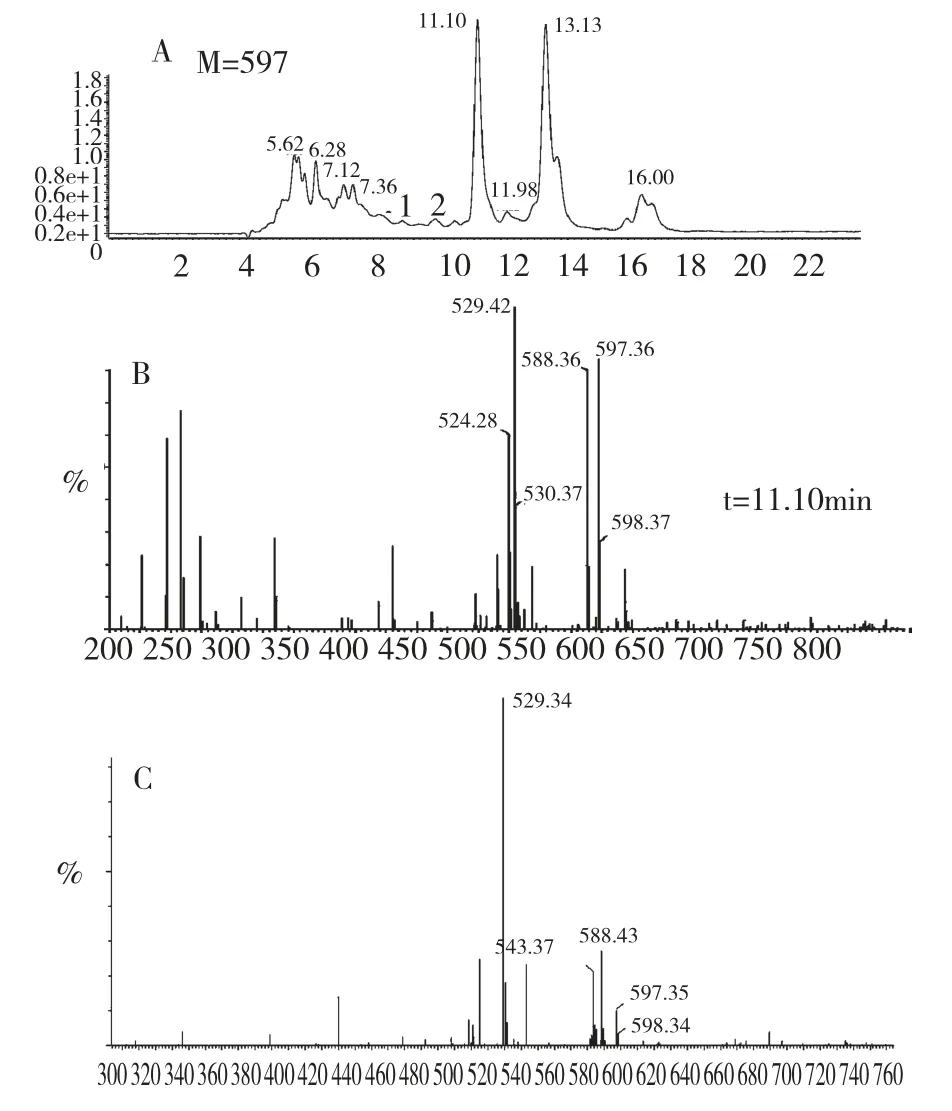
图6 虾青素HPLC-MS 总离子流图(A)以及保留时间11.10 min(B)和13.13 min(C)的质谱图Fig.6 Tatal ion chromatogram of astaxanthin prepared under the optimized oxidization condizations(A)and mass spectra at retention times 11.10 min(B)and 13.13 min(C)
全反式虾青素:1H NMR(CDCl3,600 MHz)δ:6.58(3H),6.44(3H),6.30(6H),4.33(2H),2.16(2H),1.99(10H),1.94(7H),1.81(6H),1.32(7H),1.21(6H)。
ESI-MS m/z(%):597([M+H]+,85)
顺式虾青素:1H NMR(CDCl3,600 MHz)δ:6.65(3H),6.46(3H),6.22(6H),4.32(1H),4.02(1H),1.98(13H),1.73(3H),1.32(11H),1.25(4H),1.07(7H).
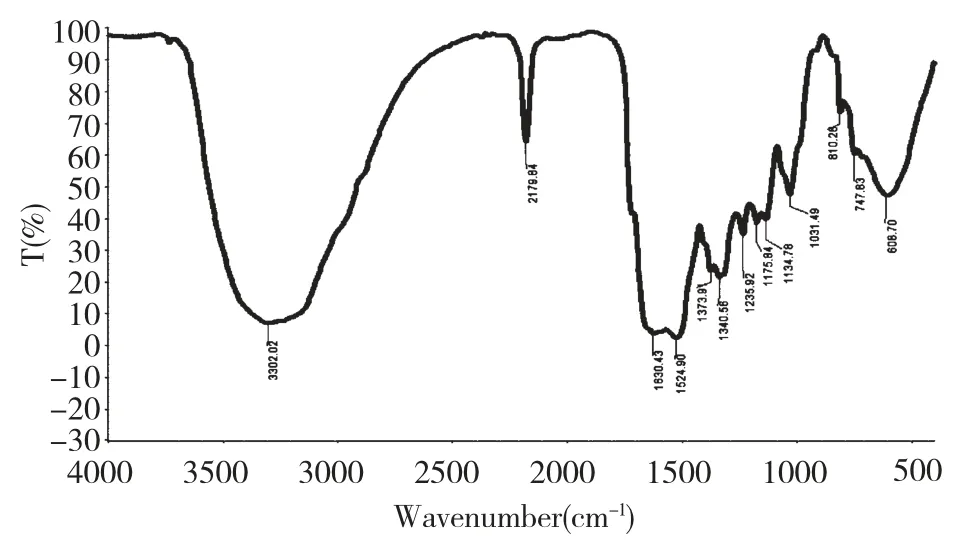
图7 虾青素红外谱图Fig.7 IR spectrum of astaxanthin
ESI-MS m/z(%):597([M+H]+,20)
3 结论
本论文以本实验室制备的玉米黄素为原料,在溴酸钠氧化下得到附加值更高的虾青素。并优化了影响氧化的因素,得出最佳反应条件:三氯甲烷为溶剂,用量为20 mL,溴酸钠为氧化剂,用量为3 g,pH值为9.5,于30 ℃下反应12 h,虾青素含量达69%。
1 Yang GZ(杨桂枝),Sun ZN(孙之南).Natural pigments and relative extraction technology from algae.Sea-Lake Salt Chem Ind(海湖盐与化工),2005,34(3):30.
2 Torrissen OJ,Christiansen R.Requirements for carotenoids in fish diets.J Appl Ichthyol,1995,11:225-230.
3 Lawlor SM,O’Brien NM.Astaxanthin:antioxidant effects in chicken embryo fibroblasts.Nutr Res,1995,15:1695-1704.
4 Naguib YM.Antioxidant activities of astaxanthin and related carotenoids.J Agric Food Chem,2000,48:1150-1154.
5 Hix LM,Lockwood SF,Bertram JS.Bioactive carotenoids:potent antioxidants and regulators of gene expression.Redox Rep,2004,9:181-191.
6 Choubert GO.Heinrich.Carotenoid pigments of the green alga Haematococcus pluvialis:assay on rainbow trout Onchorhynchus mykiss,pigmentation in comparison with synthetic astaxanthin and cantaxanthin.Aquaculture,1993,112:217-226.
7 Chen J(陈佳),Tao ZG(陶正国),Zhang GL(张贵林),et al.Technical parameters study on converting native lutein into zeaxanthin.Nat Prod Res Dev(天然产物开发与研究),2012,24:1109-1112.
8 Ribera R.Procedimiento para la preparacion de astaxantina.ES2299305,2008-05-16.
9 Lu L(鹿林).Experimental study on converting native lutein into astaxanthin.Qingdao:Qingdao University(青岛大学),PhD.2007.
10 Lu Y(陆豫),Kuang BH(匡滨海),Zhang B(张彬).Synthesis of canthaxanthin by one step.Fine Chem(精细化工),2000,17(2):74-78.
