UPLC-ELSD 法测定柴达木栽培和野生枸杞子中水溶性糖含量
2014-01-09曹静亚迟晓峰胡风祖
曹静亚,迟晓峰,谭 亮,胡风祖*
1中国科学院西北高原生物研究所,西宁 810008;2 中国科学院研究生院,北京 100049
糖是植物和动物的主要能源物质[1],也是人体六大营养素之一,对于人体正常生长发育起着重要作用。枸杞子(FructusLycii)是茄科植物枸杞的成熟果实,它是我国的传统名贵中药材,在我国传统医学中具有重要的地位。枸杞子中含有丰富的氨基酸、维生素、活性酶、多酚类、核苷类等活性物质及矿物质。其中,糖类是枸杞子中很重要的一部分,它的种类和含量反映了枸杞子的质量和营养价值。青海柴达木地区日照时间长,辐射量大,气温日差较大,制造有机物质多,其独特的高原大陆性气候造就了柴达木枸杞子的优良品质。据记载,柴达木地区栽培枸杞子的年产量约为10~20 吨,野生枸杞子的年产量约为2~10 吨,是一笔宝贵的可利用资源。
国家标准中测定糖的方法有直接滴定法和高效液相-示差折光检测法。文献报道的方法有气相色谱法[2]、连续流动分析法[3,4]、离子色谱法[5,6]、毛细管电泳法[7]等,但这些方法都存在着一定的不足,如:滴定法耗时太长,且只能测定的是总糖含量;高相液相色谱-示差折光不能进行梯度洗脱[8];而气相法需要对糖类化合物进行衍生,比较复杂。超高效液相色谱(UPLC)是目前较先进的液相色谱,具有速度快、效率高、节约试剂等特点。另外,蒸发光散射检测器(ELSD)是一种质量型检测器,基于不挥发样品颗粒对光的散射程度与其质量成正比而进行检测,对没有紫外吸收、荧光或电活性的物质以及产生末端紫外吸收的物质均能产生响应[9]。ELSD 具有灵敏度高、溶剂与改性剂的兼容性宽泛、梯度洗脱时基线平稳等优势,适用于枸杞子中糖类物质的分析。本文采用UPLC-ELSD 法对柴达木栽培和野生枸杞子中水溶性糖含量进行了测定,旨在为青海柴达木枸杞子的开发利用提供一定的理论依据。
1 材料与方法
1.1 原料、试剂及主要仪器
实验中所用的柴达木栽培和野生枸杞子样品均采自青海省海西州各地区,经中科院西北高原生物研究所胡风祖研究员鉴定为枸杞子真品。
各标准品鼠李糖(批号:111683-200401)、木糖(批 号:111508-200404)、果 糖(批 号:111504-200001)、葡萄糖(批号:110833-200904)、蔗糖(批号:111507-200302)均购自中国药品生物制品检定所;乙腈(色谱纯,Merck 公司);超纯水(实验室自制,电阻率≥18.2 MΩ);三乙胺(分析纯,山东禹王实业有限公司化工分公司)。
Waters ACQUITY 超高效液相色谱仪(配备有2424 蒸发光散射检测器,美国Waters 公司);AG135电子天平(德国Mettler Toledo 公司);KQ-100E 型超声波清洗器(昆山超声仪器科技公司)。
1.2 实验方法
1.2.1 标准储备溶液的制备
取鼠李糖、木糖、果糖、葡糖糖及蔗糖标准品适量,精密称定,置于25 mL 容量瓶中,加乙腈-水溶液(80:20,v/v)溶解并稀释至刻度,摇匀,配制成质量浓度约为1 mg/mL 的各标准品储备溶液。置于4℃冰箱中存放,备用。
1.2.2 样品的处理
枸杞子鲜样粉碎,匀浆,精密称定约0.2 g,置于具塞三角瓶中,加入50 mL 乙腈-水溶液(80:20,v/v)密封称重,在35 ℃条件下,以50 W 功率超声30 min,用提取溶剂补重,过滤。弃去初滤液,取续滤液2.0 mL 过预先活化好的固相萃取小柱(小柱活化方式:用3.0 mL 甲醇冲洗,再用6.0 mL 水冲洗),待液体全部流过小柱后用2.0 mL 水冲洗,萃取液和洗脱液收集到5 mL 容量瓶中,加提取溶剂稀释至刻度,摇匀。溶液过0.22 μm 微孔滤膜过滤后进样分析。
1.2.3 UPLC 分析
色谱柱:ACQUITY UPLC BEH Amide 柱(2.1 mm × 100 mm,1.7 μm);流动相:乙腈-水溶液(80∶20,v/v,且两相均含0.2% 三乙胺);流速:0.15 mL/min;柱温:45 ℃;进样体积:3 μL;ELSD 条件:漂移管温度:50 ℃;载气:氮气;气体压力:40 psi;喷雾器模式:冷却。标样色谱图如图1(a)所示,样品色谱图如图1(b)所示。
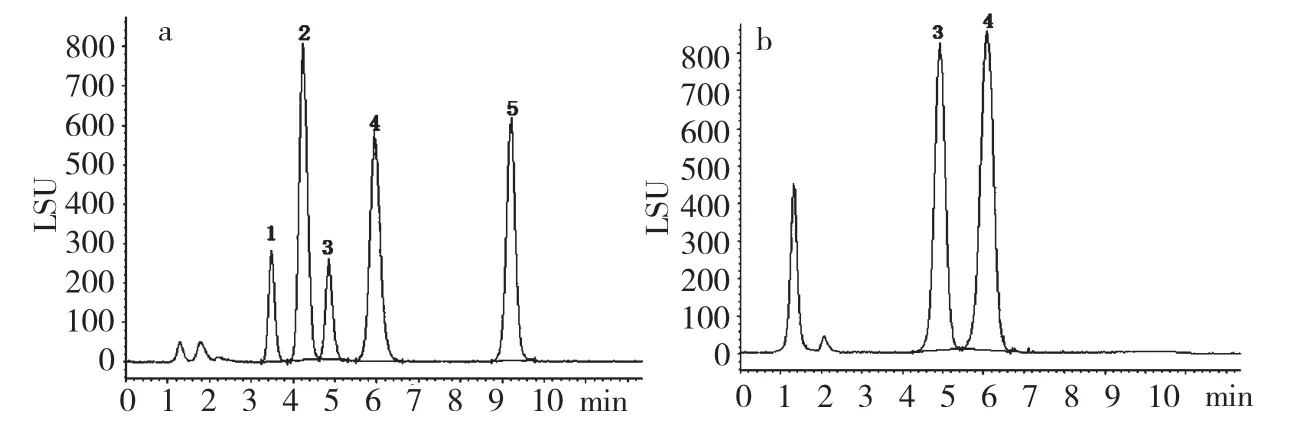
图1 标准品(a)和样品(b)的UPLC 色谱图Fig.1 UPLC chromatograms of mixture of five sugarstandards(a)and sample(b)
1.2.4 标准曲线的绘制
实验测得枸杞子样品中的水溶性糖主要为果糖和葡萄糖,因此分别精密吸取2.5 mL 果糖和葡萄糖标准储备液于10 mL 容量瓶中,加乙腈-水溶液(80∶20,v/v)稀释至刻度,摇匀,得果糖和葡萄糖的混标液,其中果糖的浓度为212.5 μg/mL,葡萄糖的浓度为247 μg/mL。分别精密吸取8.00、6.00、4.00、2.00、1.00 和0.50 μL 混标液,按“1.2.3”项下色谱条件测定峰面积。分别以果糖和葡萄糖的进样量(x)为横坐标,色谱峰面积l g 值(y)为纵坐标绘制标准曲线。
2 结果与分析
2.1 色谱分析条件优化
考察了不同比例的乙腈-水溶液作为流动相的色谱分离条件,在此流动相条件下,色谱峰多有拖尾现象,且各色谱峰分离度均不高,分析其原因可能是还原糖的变旋导致峰形变差,出现不必要的α-与β-端基异构体的分离。因此在A、B 流动相中均加入0.2%三乙胺改性剂,在乙腈-水溶液(70∶30,v/v,且两相均含0.2%三乙胺)作为流动相时,五种糖在5 min 内出峰完毕,但前三种糖没有达到基线分离。因此,继续加大乙腈比例,在乙腈-水溶液(80∶20,v/v)作为流动相时,五种糖均达到基线分离。对于ELSD 检测器,漂移管温度和载气流速是两个重要参数[10]。选择漂移管温度为50 ℃,氮气作为载气,气体压力为40 psi 时可达到最小的噪声信号,色谱图基线平稳。
2.2 萃取条件的优化
实验选择超声提取的方法,考察了水、乙腈-水溶液(50∶50,v/v)、乙腈-水溶液(80∶20,v/v)和乙腈萃取溶剂体系的萃取效果。结果发现水、乙腈-水溶液的萃取效果较好。考虑到进样溶剂应该接近流动相的组成,且尽可能低于流动相洗脱能力,所以选择乙腈-水溶液(80∶20,v/v)作为萃取溶剂。
2.3 方法学验证
2.3.1 线性关系
依据“1.2.4”项下标准曲线绘制方法,得果糖的回归方程为:Y=1.057X+5.506 (R2=0.9983),进样质量在0.106~1.700 μg 范围内线性关系良好;葡萄糖的回归方程为:Y=0.891X +5.695(R2=0.9991),进样质量在0.123~1.976 μg 范围内线性关系良好。
2.3.2 重复性
取同一枸杞子鲜样6 份,精密称定,按“1.2.2”项下方法处理,按“1.2.3”项下色谱条件测定峰面积。结果果糖和葡萄糖峰面积的RSD 分别为3.15%和2.39%,表明该方法重复性良好。
2.3.3 精密度
精密吸取果糖和葡萄糖对照品溶液3 μL 和一份样品溶液3 μL 分别进样6 次,测定各成分的峰面积。结果果糖和葡萄糖对照品的RSD 分别为1.91%和2.03%,样品中果糖和葡萄糖的RSD 分别为2.67%和2.23%,表明仪器及进样精密度良好。
2.3.4 稳定性
取枸杞子供试品溶液一份,室温放置,分别在0、2、4、8、12 和24 h 时进样3 μL,分别测定果糖和葡萄糖的峰面积。结果果糖的RSD 为2.36%,葡萄糖的RSD 为1.91%,表明供试品溶液在24 h 内稳定。
2.3.5 加样回收率
分别称取已知含量的枸杞子样品9 份,每份0.1 g,精密称定,分别精密加入不同浓度水平的混合对照品溶液,进行加标回收实验。结果果糖和葡萄糖的平均回收率分别为91.8% (RSD=1.66%)和89.6%(RSD=2.55%)。结果见表1。
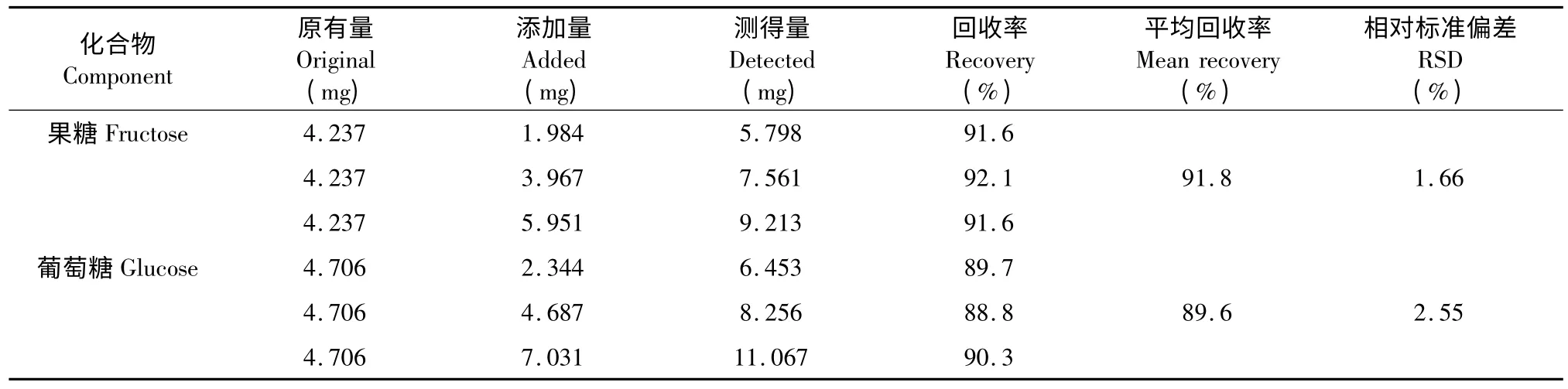
表1 枸杞子样品中果糖和葡萄糖的加样回收率实验结果(n=9)Table 1 Results of recoveries of fructose and glucose in the FructusLyciifrom Qaidam Basin(n=9)
2.3.6 检测限和定量限
配制3 个不同浓度水平的果糖和葡萄糖混标溶液,每个水平的标准溶液分析3 次,以3 倍信噪比(S/N=3)条件确定检测限,以10 倍信噪比(S/N=10)条件确定定量限。结果果糖的检出限为0.86 μg/mL,定量限为2.17 μg/mL;葡萄糖的检出限为0.64 μg/mL,定量限为1.68 μg/mL。
2.4 样品的测定及数据分析
22 个柴达木栽培和野生枸杞子样品均按“1.2.2”项下方法处理,按“1.2.3”项下色谱条件测定峰面积,结果见表2 和表3。

表2 柴达木栽培枸杞子中水溶性糖含量(n=3)Table 2 Contents of water-soluble sugar in the cultivatedFructusLycii from Qaidam Basin(n=3)
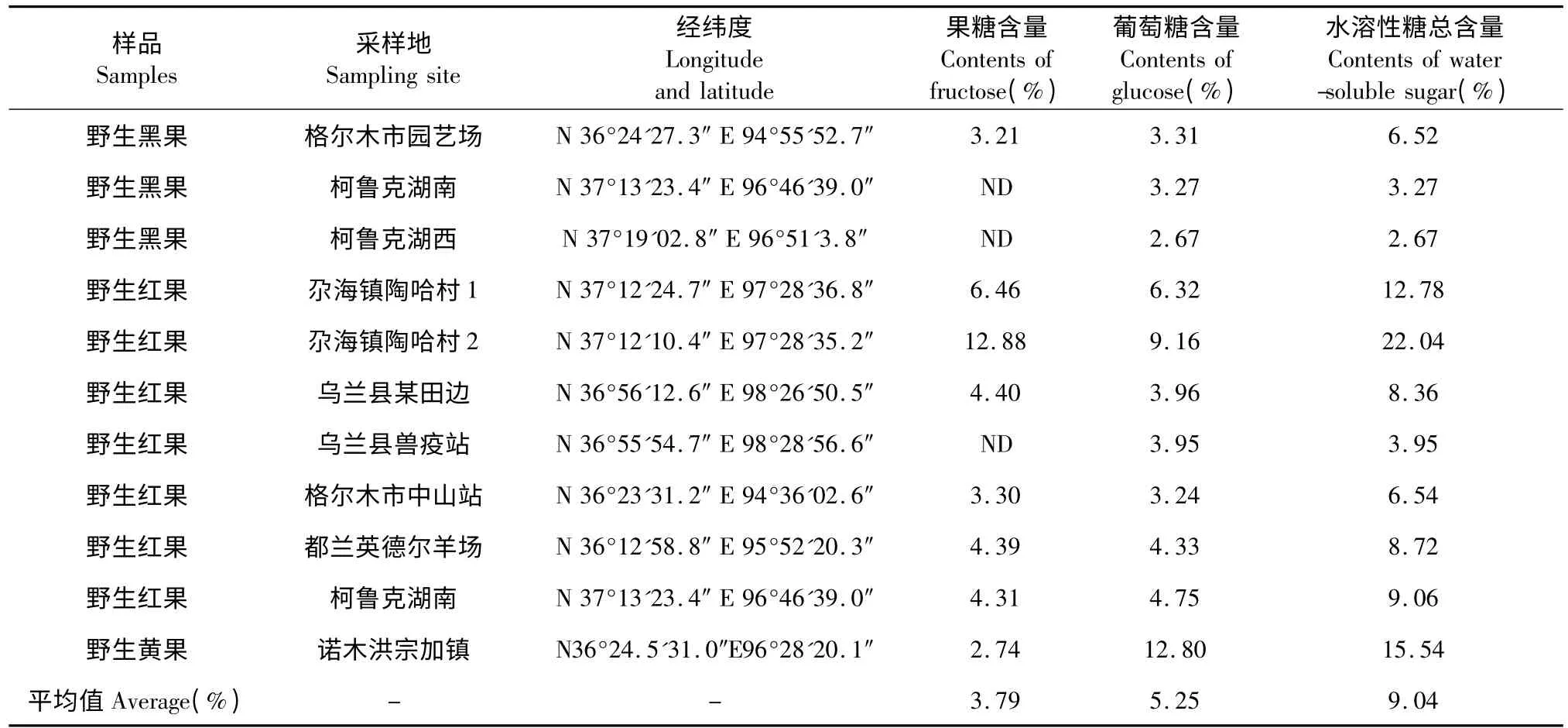
表3 柴达木野生枸杞子中水溶性糖含量(n=3)Table 3 Contents of water-soluble sugar in the wild FructusLycii from Qaidam Basin(n=3)
2.4.1 枸杞子中各单糖含量的比较
由以上两表看出,柴达木地区栽培枸杞子中果糖和葡萄糖平均含量均高于野生枸杞子,栽培枸杞子中水溶性糖含量差异的波动远小于野生枸杞子,其原因可能是由于野生枸杞子本身的品种差异及生长环境的差异所造成。
2.4.2 枸杞子中水溶性糖总含量的比较
栽培枸杞子中水溶性糖总含量最高在诺木洪地区(为14.85%),最低在都兰县夏日哈镇沙珠玉村(为8.69%);野生枸杞子中,尕海镇陶哈村的野生红果枸杞子中水溶性糖总含量最高(为22.04%),诺木洪宗加镇的野生黄果枸杞子次之(为15.54%),而柯鲁克野生黑果枸杞子中水溶性糖总含量最低(为3%左右)。从枸杞子果实颜色上看,野生黑果枸杞子中水溶性糖总含量最低,红果枸杞子含量普遍较高。另外,野生黄果枸杞子中葡萄糖含量最高。
综上,柴达木栽培枸杞子具有很整齐的品质优良性,而野生枸杞子因其生长地区和自身品种不同,品质差异很大,适宜于选择性的开发。
3 结论
本研究建立的超高效液相-蒸发光散射法可同时定量测定枸杞子中的鼠李糖、木糖、果糖、葡萄糖和蔗糖。样品中加入乙腈-水溶液(80∶20,v/v)超声提取,经固相萃取小柱净化后,定容过滤,以ACQUITY UPLC BEH Amide 柱为分析柱,以乙腈-水溶液(80∶20,v/v,且两相均含0.2 %三乙胺)作为流动相,流速为0.15 mL/min,柱温为45 ℃,漂移管温度为50 ℃,N2流量为40 psi 进行检测。该方法操作简单、效率高、重现性好、结果准确可靠,适用于枸杞子中水溶性糖含量的测定。
过对青海柴达木栽培和野生枸杞子中水溶性糖含量的比较,发现栽培枸杞子中果糖和葡萄糖含量整齐度远优于野生枸杞子;而不同地区、不同品种野生枸杞子中果糖和葡萄糖含量差异很大,这一研究对于柴达木地区野生枸杞子的选择性开发利用提供了一定的理论依据。
1 Patriciam M,Simoneit BR.Analysis of sugars in environmen-tal samples by gas chromatography-mass spectrometry.J Chromatogr A,2007,1141:271-278.
2 Cai K(蔡凯),Xiang ZM(向章敏),Zhang J(张婕),et al.Determination of water-soluble sugars in curred tobacco with gas chromatography.Chin J Anal Lab(分析试验室),2012,31:91-94.
3 Zhao LH(赵立红),Fang DH(方敦煌).Study on water-soluble sugars,nicotine and chlorion in tobacco by different continuous flow analyzers.Chin J Spectrosc Lab(光谱实验室),2007,24:224-230.
4 He XF(何秀芬),Luo JH(罗金辉),Chen X(陈歆),et al.Simultaneous determination of the starch and soluble sugar in food by continuous fluxion analysis.Food Res Dev(食品研究与开发),2012,33:137-139.
5 Liu QS(刘庆生),Zhang P(张萍),Fan ZY(范志影).Analysis of carbohydrates by high performance anion exchange chromatography with pulsed amperometric detection(HPAEPAD).Mod Sci Instrum(现代科学仪器),2005,1:75-78.
6 Cao WJ(曹文军),Cui H(崔晗),Huang DL(黄大亮).Determination of glucose and fructose in wine by ion chromatography.Mod Sci Instru(现代科学仪器),2011,6:144-146.
7 Duan LH(段隆慧),Zhou X(周勰),Chen ZG(陈缵光).The application on analysis of carbohydrates by the capillary electrophoresis and microchip electrophoresis.Mol Diagn Ther(分子诊断与治疗杂志),2011,3:42-45.
8 Yang W,Ming YD.Analysis of carbohydrates in drinks by high performance liquid chromatography with a dynamically modified amino column and evaporative light scattering detection.J Chromatogr A,2000,904:113-117.
9 Zhao YX(赵宇新),Li ML(李曼玲).Application of evaporative light-scattering detector in analysis of the active constituents in Chinese herbal medicine.China J Chin Mater Med(中国中药杂志),2003,28(10):19-23.
10 Wang MJ(王明娟),Hu CQ(胡昌勤),Jin SH(金少鸿).Review on the application of evaporative lightscattering detector in pharmaceutical analysis.Chin Pharm Aff(中国药事),2002,16:431-434.
