广东桑根心材的化学成分研究
2014-01-09何细新巢晓娟张翠仙皮荣标曾海祥李国西徐玉娟林燕燕
何细新 ,巢晓娟,杨 璐,张翠仙,皮荣标,曾海祥,李国西,徐玉娟,林燕燕
1广州中医药大学中药学院;2 中山大学药学院,广州 510006
桑属植物具有广泛的药用价值。如桑(Morus abla L.)的枝、叶、果、根皮均可入药,其中桑叶具有疏散风热,清肺润燥,清肝明目功效;桑椹能滋阴补血,生津润燥;桑枝祛风湿,利关节;桑白皮则泻肺平喘,利水消肿[1]。化学成分研究显示,桑属植物富含黄酮类化合物,苯骈呋喃衍生物,生物碱,香豆素,甾体,挥发油等多种成分[2],具有降血压、抑菌、消炎镇痛,抗癌,抗病毒等多种药理作用[3]。
广东桑Morus atpropurpurea 主要在广东、广西地区广泛栽培。近年来,广东桑的不同部位,如种子[4],桑枝[5],根皮[6]的化学成分已有报道。本文对广东桑根心材部分的化学成分进行研究,从中分离得到8 个已知化合物,并对其多酚类化合物进行了抗氧化和神经保护作用研究,为广东桑的资源利用提供科学依据。
1 实验部分
1.1 仪器与试剂
Brucker 400 MHz 型核磁共振仪;Thremo LCQ DECA XP 质谱分析仪;层析硅胶(200~300 目),青岛海洋化工厂产;Sephdax LH-20,Merck 公司产品;D101 型阳离子交换树脂,购置于南开大学化工厂;其他所用溶剂均为分析纯;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、1,1-二苯基-2-三硝基苯肼(DPPH),美国Sigma 公司;酶标仪,美国Bio-Tek 公司;分光光度计,美国Varian 公司。
1.2 生物材料
广东桑根于2010 年8 月采自广东湛江,种属由广州中医药大学药用植物教研室鉴定。样品编号为MA2010-ZJ。储藏于广州中医药大学中药学院中药化学实验室,研究所用材料为其心材部分。
1.3 提取与分离
将广东桑根的心材(干重1.3 kg)粉碎后用95%乙醇回流提取3 次,减压浓缩提取液,得棕褐色浓缩物,将浓缩物用200 毫升水悬浮,然后分别以石油醚、乙酸乙酯、正丁醇萃取3 次,乙酸乙酯萃取液浓缩后得浸膏14 g。将此浸膏经硅胶(200~300目)层析分离,以石油醚/乙酸乙酯洗脱。石油醚/乙酸乙酯(体积比6∶4)洗脱部分经Sephadex LH-20,甲醇洗脱得化合物1(15 mg),2(10 mg),3(15 mg),4(100 mg);石油醚/乙酸乙酯(体积比4∶6)洗脱部分,经Sephadex LH-20 进一步分离,甲醇洗脱得化合物5(5 mg),6(5 mg);乙酸乙酯洗脱部分,经甲醇重结晶得化合物7(10 mg)。正丁醇部分约8 g,经D101 型阳离子交换树脂层析,先以水洗2 个保留体积,然后0.2M 氨水洗脱。氨水洗脱部分,依次经Sephadex LH-20(甲醇洗脱),硅胶柱层析(200~300目),从甲醇∶氯仿(体积比4∶6)流份中得化合物8(60 mg)。
2 结果与分析
2.1 结构解析
化合物1 白色固体,ESI-MS m/z:311[M +H]+;1H NMR(400 MHz,CD3OD)δ 7.32(1H,d,J=8.4 Hz,H-4),6.88(1H,d,J=1.9 Hz,H-7),6.83(1H,d,J=0.8 Hz,H-3),6.78(2H,s,H-2',6'),6.72(1H,dd,J=8.4,2.1 Hz,H-5),5.37-5.05(1H,t,J=7.2Hz,H-8'),3.33(2H,d,J=7.2 Hz,H-7'),1.78(3H,s,-CH3),1.67(3H,s,-CH3);13C NMR(100 MHz,CD3OD)δ157.5(C-3',5'),157.1(C-6),156.6(C-8),156.5(C-2),131.3(C-9'),130.2(Cl'),124.3(C-8'),123.2(C-9),121.8(C-4),116.9(C-4'),113.1(C-5),103.8(C-2',6'),101.3(C-3),98.4(C-7),26.0(-CH3),23.3(C-7'),17.9(-CH3)。以上数据与文献[7]报道的Moracin C 的数据一致,将化合物1 鉴定为Moracin C。
化合物2 淡灰色固体,ESI-MS m/z:243[M+H]+;1H NMR(400 MHz,CD3OD)δ 7.34(1H,d,J=8.4 Hz,H-4),6.91(1H,d,J=2.3Hz,H-6),6.90(1H,s,H-3),6.78(2H,d,J=2.2 Hz,H-2',6'),6.74(1H,dd,J=8.4,2.0 Hz,H-5),6.27(1H,t,J=2.2 Hz,H -4');13C NMR(CD3OD,100 MHz)δ160.5(C-3',5'),157.7(C-7a),157.3(C-6),156.6(C-2),134.3(C-1'),123.5(C-3a),122.5(C-4),113.7(C-5),104.5(C-2',6'),104.1(C-4'),102.7(C-3),98.9(C-7)。以上数据与文献[8]报道的Moracin M 的数据一致,鉴定化合物2 为Moracin M。
化合物3 无色针状结晶,ESI-MS:m/z 305[M+H]+;1H NMR(400 MHz,CD3OD)δ 7.24(1H,d,J=9.0 Hz,H-6'),6.42-6.34(2H,m,H-3',5'),5.94(1H,d,J=2.1 Hz,H-8),5.90(1H,d,J=2.1 Hz,H-6),5.41(1H,d,J=11.4 Hz,H-2),4.79(1H,d,J=11.4 Hz,H-3);13C NMR(100 MHz,CD3OD)δ 199.02(C-4),168.68(C-5),165.42(C-9),165.10(C-7),160.27(C-4'),158.70(C-2'),130.97 (C-6'),115.72 (C-1'),108.08 (C-5'),103.90(C-3'),102.06(C-10),97.30(C-8),96.37(C-6),80.17(C-2),72.68(C-3)。以上数据与文献[9]报道的二氢桑色素的数据一致,将化合物3 定为二氢桑色素。
化合物4 淡黄色结晶,ESI-MS:m/z 245[M+H]+;1H NMR(400 MHz,CD3OD)δ 7.33(1H,d,J=9.2 Hz,H-6),7.27(1H,d,J=16.5 Hz,H-α),6.82(1H,d,J=16.4 Hz,H-β),6.46(2H,d,J=2.1 Hz,H-2',6'),6.34-6.31(2H,m,H-3,5),6.15(1H,t,J=2.2 Hz,H-4);13C NMR(100 MHz,CD3OD)δ158.2(C-3',5'),157.8(C-2),155.9(C-4),140.77(C-1'),127.0(C-α),125.0(C-β),123.0(C-6),116.0(C-1),106.9(C-5),104.2(C-2,6),102.0(C-3),100.8(C-4')。以上数据与文献[10]报道的氧化白藜芦醇的数据一致,鉴定化合物4 为氧化白藜芦醇。
化合物5 淡黄色针状结晶,ESI-MS m/z:163[M+H]+;1H NMR(400 MHz,CD3OD)δ 7.86(1H,d,J=9.4 Hz),7.47(1H,d,J=8.5 Hz),6.81(1H,dd,J=8.5,2.3 Hz),6.73(1H,d,J=2.2 Hz),6.20(1H,d,J=9.4 Hz);13C NMR(100 MHz,CD3OD)δ:163.7(C-2),163.1(C-9),157.3(C-7),146.0(C-4),130.7(C-5),114.5(C-3),113.2(C-10),112.4(C-6),103.4(C-8)。以上数据与文献[11]报道的伞形花内酯的数据一致,鉴定化合物5 为伞形花内酯。
化合物6 灰白色固体,空气中长期放置变黄色粉末结晶。ESI-MS m/z:139[M +H]+;1H NMR(400 MHz,CD3OD)δ 9.72(1H,s,CHO),7.51(1H,d,J=8.6 Hz,1H,H-6),6.46(1H,dd,J=8.6,2.2 Hz,H-5),6.29(1H,d,J=2.2 Hz,H-3)。以上数据与文献[12]基本一致,鉴定该化合物为2,4-二羟基苯甲醛。
化合物7 白色粉末,TLC 分析与胡萝卜苷标准品Rf值一致,与胡萝卜苷混合熔点不下降,鉴定该化合物为胡萝卜苷[13]。
化合物8 无色油状物,ESI-MS m/z:116[M+H]+;1H NMR(400 MHz,CD3OD)δ 4.03(1H,dd,J=8.5,6.3 Hz,H-3),3.41(1H,dt,J=11.5,6.9 Hz,H-4),3.28(1H,dt,J=11.4,7.3 Hz,H-4)2.32(1H,td,J=15.7,7.4 Hz,H-6),2.13(1H,td,J=13.3,6.4 Hz,H-6),2.06-1.94(2H,m,H-5).13C NMR(100 MHz,CD3OD)δ174.14(C-2),62.47(C-3),46.85(C-6),30.26(C-4),24.99(C-5)。以上数据与文献一致[14],鉴定化合物为3-羟基-2-哌啶酮(3-Hydroxy-2-piperidinone)。该化合物首次从桑属植物中得到。
2.2 DPPH 自由基清除率测试
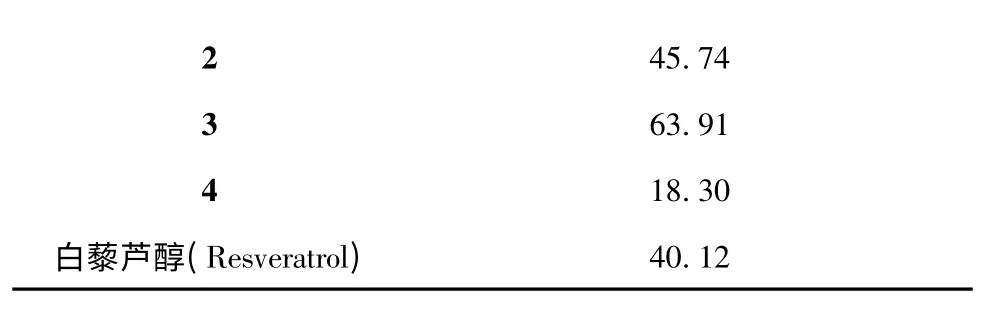
利用DPPH 溶液的特征紫红色团的吸收峰,以分光光度法测定加抗氧化剂后,在517 nm 处吸光度减少值,表示其对有机自由基消除能力[15]。在反应管中加入1 mL 0.2 mM DPPH 的甲醇溶液,再加入1 mL 的化合物1~4 和白藜芦醇终浓度为(2.0,4.0,8.0,16.0 和32.0 μM),混合均匀,室温避光反应60 min 后在517 nm 处读取吸光度。设1 mL DPPH+1 mL 化合物溶液为实验组,同时以1 mL DPPH+1mL甲醇混合后的吸光度为对照组。计算清除率(%)=[(对照组A517-实验组A517)/对照组A517]×100%。计算使DPPH 溶液吸光度降低50%的化合物浓度(IC50)。将IC50定义为清除50%DPPH 有机自由基的化合物浓度。结果见表1。由结果显示,化合物1~4 都具有自由基清除能力。其中化合物1 和4 对DPPH 自由基清除能力的IC50低于白藜芦醇的IC50,提示它们的清除自由基能力强于白藜芦醇。

表1 化合物抗氧化活性(IC50,μM)Table 1 The antioxidant activity of compounds(IC50,μM)
2.3 HT22 神经元细胞保护活性测试
在96 孔板中种入HT22 细胞(每孔1*104个),然后加入空白和设定浓度的化合物预处理30 min,再加入空白和L-谷氨酸钠(5 mM)孵化24 h。细胞存活率采用MTT 法测试,活性结果见图1。由结果显示,化合物1,2,3,4 在5 μM 和20 μM 两个浓度下均有一定的神经保护作用。未加L-谷氨酸钠情况下,20 μM 化合物1,2,3,4 降低HT22 细胞活力。L-谷氨酸钠能够造成HT22 细胞死亡,化合物1~4的加入均能减少L-谷氨酸钠诱导的细胞毒性,增加存活率。其中化合物2 在高浓度(20 μM)下活性显著。
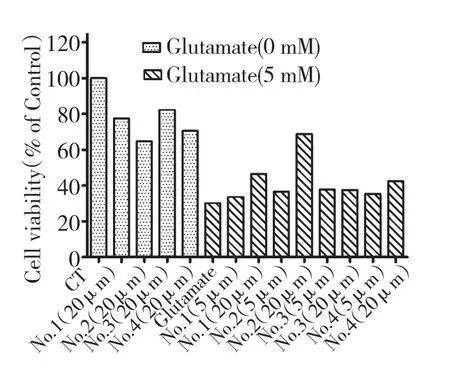
图1 化合物1,2,3,4 对L-谷氨酸钠诱导HT22 细胞毒性的影响Fig.1 Effects of compound 1、2、3、4 on L-Glutamate induced cytotoxicity.Cells were grown on 96-well plates(1* 104 cells per well)and pretreated with or without compounds as indicated concentrations for 30 min,and then incubated with or without L-Glutamate(5 mM)for 24 h.Cell viability was measured using the MTT assay.
3 结论与讨论
本研究从广东桑根的心材中分离了8 个已知化合物,经分析将其分别鉴定为桑辛素C(1),桑辛素M (2),二氢桑色素(3),氧化白藜芦醇(4),2,4-二羟基苯甲醛(5),伞形花内酯(6),胡萝卜苷(7)和3-羟基-2-哌啶酮(8)。其中化合物1,3~6 和8 为首次从广东桑Morus atpropurpurea 中分离得到。化合物8 亦首次从桑属植物中分离到。活性研究显示多酚类化合物1~4 均具能清除DPPH 自由基,其中化合物1 和4 的清除能力高于白藜芦醇;均能抑制L-谷氨酸钠诱导海马神经元细胞HT22 毒性,具有神经保护,其中化合物2 在20 μM 浓度下活性显著。
桑属植物具有多种药理活性,包括对心血管系统有降血压作用、提取物在体外有抑菌作用、消炎镇痛作用,还有抗癌抗病毒等药理活性作用。此外,有研究报道[16]桑色素可以诱导肿瘤细胞在S 期中阻滞,从而抑制细胞增殖。本研究采用的永生系小鼠海马神经细胞HT22 是一种可增殖的细胞,化合物1~4 处理24 h 后,HT22 细胞的活力有所降低,可能是由于化合物对细胞产生抑制增殖作用,而不是毒性作用。其抑制细胞增殖的作用机制有待进一步研究。另外,有报道桑色素具有神经保护作用[17],手术前3 d 给予桑色素(4 mg/kg)可以减少脑缺血再灌注大鼠模型的梗死面积,减少炎性细胞浸润,促进神经功能恢复。本研究发现从广东桑根的心材中分离得到的化合物1、2、3 和4 均可清除自由基,减少由氧化应激引起的神经细胞损伤,这对于广东桑提取物作为抗氧化剂和神经保护剂,应用于神经系统疾病提供了一定的实验依据。但仅是体外实验研究,尚有待更进一步的开展动物水平实验。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol Ⅰ.
2 Li QH(黎琼红),Zhang GG(张国刚),Dong SH(董淑华).The advancement in the chemical constituents and pharmacological activity study of Morus.J Shenyang Pharm Univ(沈阳药科大学学报),2003,20:386-389.
3 Xiao NS(肖年生),Gu GY(顾关云),Jiang Y(蒋昱).Advances in studies on pharmacological effects of plants in Morus L..Drugs & Clinic(现代药物与临床),2012,27:70-74.
4 Ya J(轧霁),Zhang XQ(张晓琦),Ye WC(叶文才),et al.Chemical constituents from the seeds of Morus atropurpurea.J China Pharm Univ(中国药科大学学报),2006,37:301-303.
5 Xu YL(许延兰),Li XE(李续娥),Zou YX(邹宇晓),et al.Studies on chemical constituents from twigs of Morus atropurpurea.China J Chin Mater Med(中国中药杂志),2008,33:2499-2502.
6 Wu DL(吴东玲),Zhang XQ(张晓琦),Huang XJ(黄晓君),et al.Chemical constituents from root barks of Morus atropurpurea.China J Chin Mater Med(中国中药杂志),2010,35:1978-1982.
7 Takasugi M,Nagao S,Ueno S,et al.Moracin C and D,new phytoalexins from diseased mulberry.Chemstry Letters,1978,7:1239-1240.
8 Jing Y(景莹),Zhang XQ(张晓琦),Han LW(韩伟立),et al.Chemical constituents from the leaves of Morus mongolica.Nat Prod Res Dev(天然产物研究与开发),2010,22:181-184.
9 Zheng ZP,Cheng KW,To JT,et al.Isolation of tyrosinase inhibitors from Artocarpus heterophyllus and use of its extract as antibrowning agent.Mol Nutr Food Res,2008,52:1530-1538.
10 Dong ZY(佟志远),Yan XP(颜新培),Li SX(李顺祥),et al.Isolation and identification of oxyresveratrol in mulberry branch.Science of Sericulture(蚕业科学),2011,37:948-951.
11 Jiang WW(姜薇薇),Zhang XQ(张晓琦),Li Q(李茜),et al.Chemical constituents of the root of Ficus stenophylla.Nat Prod Res Dev(天然产物研究与开发),2007,19:588-590.
12 Zhang DW(张德武),Dai SJ(戴胜军),Li GH(李贵海),et al.Chemical constituents in cane of Pueraria lobata.Chin Tradit Herb Drugs(中草药),2011,42:649-651.
13 Li ZC(李兆春),Chen Z(陈重),Li XR(李笑然),et al.Chemical constituents in roots and stems of Physalis alkekengi var.franchetii.Chin Tradit Herb Drugs(中草药),2012,43:1910-1912.
14 Alam N,Choi IS,Song KS,et al.A new alkaloid from two coccinellid beetles Harmonia axyridis and Aiolocaria hexaspilota.Bull Korean Chem Soc,2002,23:497-499.
15 Larrauri JA,Sánchez-Moreno C,Rupérez P,et al.Free radical scavenging capacity in the aging of selected red Spanish wines.J Agric Food Chem,1999,47:1603-1606.
16 Zhi TD(植天道),Huang QH(黄齐慧).The research development on the bioactivities of morin.Chin Med Modern Distance Edu China(中国中医药现代远程教育),2009,7:112-115.
17 Wang Y(王莹),Ding L(丁利),Li WY(李文媛),et al.Effects of morin on expression of poly adenosine diphosphate ribose polymerase and nuclear factor-κB in rats undergone cerebral ischemia-reperfusion injury.J Anhui Tradit Chin Med Colle(安徽中医学院学报),2012,31:43-46.
