红景天配伍维生素C 对大鼠运动性肾脏缺血再灌注的保护作用
2014-01-08周海涛曹建民
周海涛,曹建民,林 强*
1北京联合大学,北京 100023;2 北京体育大学,北京 100084
随着现代中医药理论的发展、现代药理学理论及现代生物技术的更新,更多的单剂或配伍组方应用于体育实践。中药以其多靶点、多途径作用且几乎不含违禁成分的特点日益显示出其独特的优势,肾为先天之本,主骨骼生精髓;补肾中药对肾脏具有保护功效,其在肾脏缺血再灌注保护机制值得深入研究。
机体在稳定状态下,肾血流量可以通过自身调节机制来维持相对恒定。在剧烈运动时,肾血流在神经和体液因素的影响下发生改变。由于各器官血流量重新分配,使活动器官特别是肌肉的血流量增多,肾血流量急剧下降,并伴随运动过程的持续和强度递增表现的更加明显[1]。肾脏的这种不完全缺血状态形成了“运动性肾缺血”。运动停止后,肾血供应恢复形成运动性肾缺血后的“再灌注”[2]。缺血再灌注损伤过程中,自由基的产生异常增多起着重要作用。研究表明,红景天具有较高的抗氧化活性,可以清除体内过量生成的自由基对机体细胞的损伤[3],维生素C 作为体内重要的抗氧化剂,可以有效清除自由基。本文研究红景天配伍维生素C对大鼠缺血再灌注肾脏的影响,并探讨二者在缺血再灌注损伤中的作用及其机制,旨在为其临床应用提供理论依据。
1 材料与仪器
1.1 动物
清洁级雄性Wistar 大鼠100 只,42 d 龄,平均体重(198.1 ±13.4)g,北京大学医学部实验动物科学部提供,许可证号SCXK(京)2006-0008。在整个实验过程中,实验室内温度保持在(22 ±2)℃,相对湿度55%~75%,光照时间随自然变化。所有实验大鼠均以基础饲料(北京大学医学部实验动物科学部提供)和蒸馏水常规饲养,自由饮食。实验时间为63 d,正式训练时间为56 d。
1.2 实验用药
红景天(Rhodiola rosea),产自河北,北京同仁堂购得,批号:120413537 并经天津中瑞药业有限公司高占友高级工程师鉴定。称取红景天干品50 g 加水500 mL,浸泡30 min 后煎30 min,将所得水煎液过滤,再将过滤出的红景天加水500 mL 煎30 min,将所得水煎液过滤。将2 次过滤出的水煎液混合,浓缩至生药浓度1g(生药)/mL,4 ℃存放备用。
1.3 试剂
血清肌酐(serum creatinine,Scr)采用Jaffe 苦味酸法测定,血尿素氮(blood urea nitrogen,BUN)采用二乙酰-肟法测定,丙二醛(malondialdehyde,MDA)采用比色法测定;超氧化物歧化酶(superoxide dismutase,SOD),采用黄嘌呤氧化酶法测定,均采用南京建成生物工程研究所提供试剂盒,试剂盒编号20120509,并严格按照使用说明操作。
1.4 仪器
BS224S 型电子分析天平(德国赛多利斯);光学显微镜(日本OLYMPUS 公司);ALCYON300 全自动生化分析仪(美国雅培);756M C 型紫外-可见分光光度计(上海精密仪器厂);GL-20G 高速冷冻离心机(上海安亭)。
2 实验方法
2.1 动物分组
实验大鼠适应性饲养4 d 后,以20 min/d 的运动量对其进行为期3 d 的筛选,淘汰个别不适应游泳训练者,将剩余大鼠以数字随机分组法分6 组:对照组(C 组)12 只,一般训练组(M 组)12 只,过度训练组(OM 组)24 只,红景天+过度训练组(ROM组)16 只,维生素C+过度训练组(VCOM 组)16 只,红景天+维生素C+过度训练组(RVCOM 组)16 只进行56 d 的游泳训练。训练期间,ROM 组、RVCOM组采用专业灌胃器灌胃(ig),每天一次,剂量为4.48 g/kg[3],ig 体积为5 mL/kg;VCOM 组、RVCOM组采用腹腔注射(ip),剂量为100 mg/kg,每天一次,注射体积为0.5 mL(通过预实验获得最佳剂量),其他各组ig 等量生理盐水。
2.2 实验方法。
2.2.1 训练及测试方案
C 组常规饲养,不加任何干预,平时不运动。M组进行中等强度游泳训练,正式游泳训练8 周。每周训练6 d,每天训练1 次,第一次下水游20 min,此后逐渐增加,至第1 周末时每天游60 min,第2 周末时加至每天游90 min,第3 周末时加至每天游120 min,此后5 周均保持此运动量。其他各组前3 周训练安排同M 组,第4 周起开始安排高强度训练。大鼠进行负重游泳,每次训练至力竭。力竭标准以大鼠下沉后10 s 不露出水面为度。第1~3 周负0.5%体重,第4 周负1%体重,第5 周负2%体重,每天训练1 次。第6 周每天上、下午各训练1 次,第7~8 周,每天上、下午、夜间各训练1 次,均负5%体重。至第8 周末,C、M 组大鼠,均正常生长,无意外死亡发生。其他各组大鼠因尾部负重,疲劳衰竭不能恢复及训练意外死亡等原因,死亡率较高。OM组、ROM 组、VCOM 组、RVCOM 组分别剩余14、13、12、14 只。各组分别取10 只用于实验取材,其他随机剔除。
2.2.2 指标测定
各组大鼠于末次游泳训练24 h 后,乙醚适度麻醉,从颈总动脉处取血加入柠檬酸钠溶液抗凝,37℃水浴中30 min 后,4 ℃3000 rpm 离心10 min,分离制备血清,置-20 ℃冰箱中保存待查。迅速取双肾,剔除筋膜,置于预冷的生理盐水中洗净血污,肉眼观察肾脏大小,色泽、质地。分离左肾,取肾上极组织0.5 g,用1.5 mL 生理盐水在1 ℃下以12000 r/min 研磨制成10%肾组织匀浆;10%甲醛固定肾组织标本,石蜡包埋,制成4 μm 厚切片,HE 染色,观察组织病理学变化。
2.2.3 肾脏病理变化评价
参照Pallers 标准[4],400 倍光镜下随机选5 个视野,每个视野选10 个肾小管评分。肾小管明显扩张,细饱扁平为1 分;刷状缘损伤为1 分;脱落为2分;细胞膜大泡为1 分;细胞浆空泡为1 分;间质水肿1 分;肾小管腔内有脱落的坏死细胞未形成管型或碎片为1 分;形成管型或碎片为2 分。肾小管评分由两名技术员双盲计算,取平均值。
2.3 数据统计
所有数据均用SPSS 12.0 统计软件包进行处理,数据以均数±标准差表示,资料进行正态性检验;多组计量资料采用one-way ANOVA,方差齐时采用LSD 法,方差不齐时采用Dunnett's T3 法。P<0.05 有统计学意义。
3 实验结果
3.1 运动及红景天、维生素C 对大鼠肾组织的病理改变
光镜下静止对照组、一般训练组大鼠肾组织结构正常,无淤血、变性和水肿,肾小管管腔内无管型。过度训练组大鼠肾小球有淤血现象,小管上皮细胞水肿、空泡变性、管腔扩张,管腔中有少量的脱落绒毛和上皮细胞,以及各种管型。其他各组组织病理学改变较过度训练组轻,有轻微的小管上皮细胞水肿、空泡变性,管腔扩张现象,无蛋白管型和细胞管型。各组大鼠肾小管Paller[4]评分,C 组、M 组组间无显著差异(P>0.05),C 组明显低于其他组(P<0.01),治疗组显著低于OM 组大鼠(P<0.05),且均未见肾小球明显病理改变。
表1 各组大鼠肾小管损害评分比较(n=10,± s)Table 1 Tubular damage score in various groups of rats (n=10,± s)

表1 各组大鼠肾小管损害评分比较(n=10,± s)Table 1 Tubular damage score in various groups of rats (n=10,± s)
注:与C 组比较,1)表示P <0.05,2)表示P <0.01;与OM 组比较,3)表示P <0.05,4)表示P <0.01。Note:compared with C group,1)represent P <0.05,2)represent P <0.01;compared with OM group,3)and 4)represent P <0.05 and P <0.01,respectively.
3.2 运动及红景天、维生素C 对大鼠血清BUN 和SCr 的影响
由表2 可知:血尿素氮和血清肌酐各组与C 组相比,M 组、OM 组、ROM 组、VCOM 组、RVCOM 组,明显上升,分别为P<0.05、P<0.01、P<0.01、P<0.01、P<0.05;与OM 组相比ROM 组、VCOM组、RVCOM 组明显下降,分别为P<0.05、P<0.05、P<0.01;与VCOM 组相比,ROM 组、RVCOM组明显下降,分别为P<0.05,P<0.01。
表2 各组大鼠血清尿素氮和肌酐含量比较(n=10,± s)Table 2 Blood urea nitrogen (BUN)and serum creatinine(SCr)levels in plasma of various groups (n=10,± s)
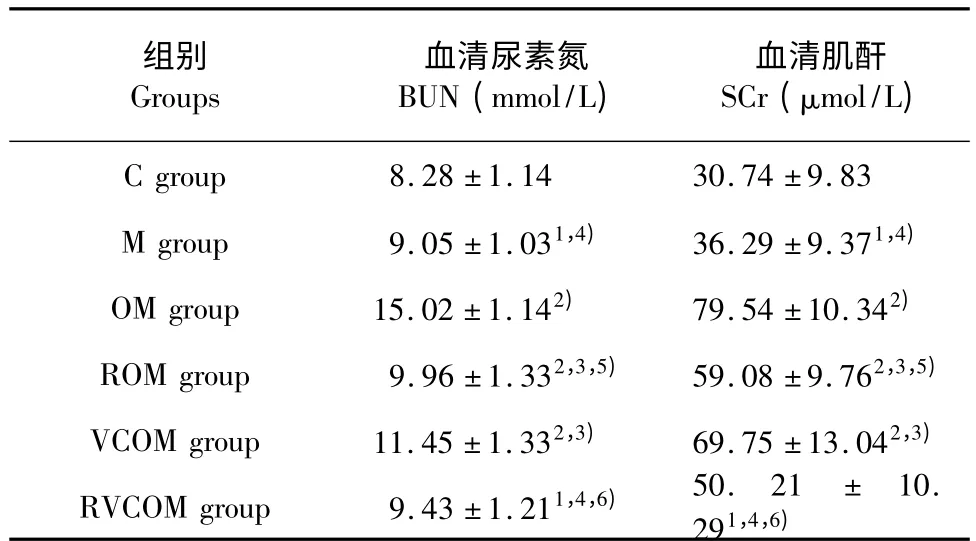
表2 各组大鼠血清尿素氮和肌酐含量比较(n=10,± s)Table 2 Blood urea nitrogen (BUN)and serum creatinine(SCr)levels in plasma of various groups (n=10,± s)
注:与C 组比较,1)表示P <0.05,2)表示P <0.01;与OM 组比较,3)表示P <0.05,4)表示P <0.01;与VCOM 组比较,5)表示P <0.05,6)表示P <0.01。Note:compared with C group,1)represent P <0.05,2)represen t P <0.01;compared with OM group,3)and 4)represent P <0.05 and P <0.01;compared with VOCM group,5)and 6)represent P <0.05 and P <0.01,respectively.
表3 各组大鼠肾组织匀浆中SOD 活性和MDA 含量比较(n=10,± s)Table 3 Comparison of rat kidney homogenate SOD activity and MDA content in each group (n=10,± s)

表3 各组大鼠肾组织匀浆中SOD 活性和MDA 含量比较(n=10,± s)Table 3 Comparison of rat kidney homogenate SOD activity and MDA content in each group (n=10,± s)
注:与C 组比较,1)表示P <0.05,2)表示P <0.01;与OM 组比较,3)表示P <0.05,4)表示P <0.01;与VCOM 组比较,5)表示P <0.05,6)表示P <0.01。Note:compared with C group,1)represent P <0.05,2)represent P <0.01;compared with OM group,3)and 4)represent P <0.05 and P <0.01;compared with VOCM group,5)and 6)represent P <0.05 and P <0.01,respectively.
3.3 运动及红景天、维生素C 对大鼠肾组织匀浆中SOD 活性和MDA 含量的影响
由表3 可知:SOD 活性,与C 组对比,M 组、OM组、ROM 组、VCOM 组、RVCOM 组,明显下降,分别为P<0.01、P<0.01、P<0.01、P<0.01、P<0.05;与OM 组相比ROM 组、VCOM 组、RVCOM 组明显上升,分别为P<0.05、P<0.05、P<0.01;与VCOM组相比,ROM 组、RVCOM 组明显上升,分别为P<0.05,P<0.01。MDA 含量与C 组对比,M 组、OM组、ROM 组、VCOM 组、RVCOM 组明显升高,分别为P<0.01、P<0.01、P<0.01、P<0.01、P<0.05;与OM 组相比,ROM 组、VCOM 组、RVCOM 组明显下降,分别为P<0.05、P<0.05、P<0.01;与VCOM组相比,ROM 组、RVCOM 组明显降低,分别为P<0.05、P<0.01。
4 讨论
肾缺血再灌注(Ischemic reperfusion,I/R)损伤是一个复杂的病理生理变化过程,其具体机制尚未完全阐明。但氧自由基(Oxygen free radicals,OFR)在I/R 发生、发展过程中起着至关重要的作用[5]。正常情况下,体内可产生少量自由基,但由于体内具有灭活自由基酶系统,自由基被迅速清除,不产生损伤作用。运动时由于I/R 使自由基产生增加,可引发膜脂质过氧化反应,导致膜的液态性、流动性及通透性改变,进而造成膜功能障碍,尤其是线粒体膜的破坏将影响细胞的代谢和机能,并干扰整个器官的生理功能。机体内存在清除自由基、减轻其危害的主要物质是抗氧化酶。SOD 是需氧生物体内数千种酶中以氧自由基为底物的唯一酶。其通过催化超氧阴离子形成过氧化氢而清除超氧阴离子,保护机体免受损伤,同时在一定范围内,自由基代谢增强时,SOD 会代偿性增加。因此SOD 活性的高低是机体抗氧化能力强弱的标志。MDA 是细胞脂质过氧化的一种主产物。组织线粒体MDA 含量是目前公认的衡量机体自由基代谢的敏感指标。肌酐和尿素氮分别是肌肉和蛋白质的分解代谢产物,主要经血循环从肾脏排除体外,其血中的浓度取决于肾小球滤过能力,当肾脏实质受到损伤,肾小球滤过率降到临界点后,二者的浓度就会明显上升[6]。
实验结果显示8 周过度训练已造成大鼠肾脏运动性缺血“再灌注”损伤,肾功能受到严重损坏,肾组织组织病理学发生改变。但肾组织组织病理学改变方面,ROM 组、VOM 组、RVOM 组(P<0.05)较OM 组明显减轻。血尿素氮和血清肌酐方面,ROM组、VCOM 组、RVCOM 组低于OM 组,分别为P<0.05、P<0.05、P<0.01。SOD 活性方面,ROM 组、VCOM 组、RVCOM 组明显高于OM 组,分别为P<0.05、P<0.05、P<0.01。MDA 含量方面,ROM 组、VCOM 组、RVCOM 组低于OM 组,分别为P<0.05、P<0.05、P<0.01。表明,红景天及维生素C 可以有效清除自由基,减轻肾脏的缺血缺氧,抑制脂质过氧化作用,提高SOD 活性。有效减轻肾脏缺血再灌注损伤,起到保护作用。其机制可能为:1、红景天的主要成分红景天苷和苷元酪醇,都具有酚羟基。酚羟基作为清除自由基的主要功能基团,可通过清除体内过量生成的自由基对机体细胞的损伤,激活抗老化酶(SOD)的活性,降低脂质过氧化物(LPO)的浓度,抑制脂褐素在组织细胞中的堆积,保护腺体结构[7];2、红景天中含有的多元酚类化合物、黄酮类化合物和超氧化歧化酶等也具有抗氧化作用,可以提高大鼠运动时自由基的消除,保护腺体结构;3、红景天多糖自动氧化,产生新的有机自由基,使多糖本身产生自由基与它清除的自由基达到或超过平衡,从而提高大鼠运动时自由基的消除;4、红景天内含Cu-Zn-SOD 与Mn-SOD,是重要的超氧自由基清除剂,直接提供并增加SOD 水平,维持细胞膜的完整性与稳定性[8];5、红景天能够维持体内免疫系统处于平衡状态,既能提高机体免疫功能,又能防止免疫系统的矫枉过正,阻止炎性细胞因子的过度生成,减轻氧化应激程度[9];6、维生素C 是重要的抗氧化维生素,作为强抗氧化剂可有效清除氧自由基、抑制凋亡级联的启动而减轻细胞、器官的缺血再灌注损伤[10]。此外,3 个治疗组间比较,血尿素氮、血清肌酐、MDA 含量,ROM 组(P<0.05),RVCOM 组(P<0.01)低于VCOM 组;SOD 活性,ROM 组(P<0.05),RVCOM 组(P<0.01)高于VCOM 组。提示红景天对运动性肾脏缺血再灌注损伤的疗效可能优于维生素C;而二者配伍使用可能更有利于缺血再灌注损伤肾脏的保护。
综上所述,红景天和维生素C 均对肾脏缺血再灌注损伤具有保护作用,可能是通过增强超氧化物歧化酶活性,清除自由基,减轻脂质过氧化作用,进而改善肾脏功能。就疗效而言,二者配伍使用优于二者单独应用,而红景天又优于维生素C,但也可能和二者在应用中的剂量大小有关,其剂量和疗效之间的关系,还有待进一步研究。
1 Barclar WF.Review of Medical Physiology.California:Lange Medical Publication,1995.577-580.
2 Heifets M,Davis TA,Tegtmeyer E,et al.Exercise training ameliorates progressive renal disease in rats with subtotal nephrectomy.Kidney Int,1987,32:815-820.
3 Zhou HT(周海涛),Cao JM(曹建民),Lin Q(林强),et al.Effect of Rhodiola on testosterone content,substance metabolism and exercise capacity in rats after exercise training.Nat Prod Res Dev(天然产物研究与开发),2012,24:1808-1812.
4 Paller MS,Hoidal JR,Ferris TF.Oxygen free radicals in ischemic acute renal failure in the rat.J Clin Invest,1984,74:1156-1164.
5 Wang L(王丽),Mei CL(梅长林).Hypoxia-inducible factor-1α and oxygen free radicals in renal ischemia-reperfusion injury in rats.Chin J Nephrol(中华肾脏病杂志),2006,22:371-373.
6 Hong P(洪平),Chen G(陈耿),Li QZ(李清正),et al.Influence of rapid weight loss by different temperature on certain biochemical indexes.Chin Sport Sci(体育科学),2010,30(4):44-48.
7 Zhang Y(张彧),Gao Y(高云),Fu R(付荣),et al.Study on the antioxidant activity of the Chinese herbRhodiola sachalinensisA.Bor extract.Food Sci(食品科学),2004,25:315-318.
8 Zhang SM(张生明).Study on the extraction of polysaccharide fromRhodiola crenulataby alkali method and its antioxidation.J Anhui Agric Sci(安徽农业科学),2008,36:7741-7742.
9 Jiang HY(姜红彦).Protect effects of salidroside on renal ischemia-reperfusion injury in rat.Dalian:Dalian Medical University(大连医科大学),MSc.2005.
10 Korkmaz A,Kolankaya D.The protective effects of ascorbic acid against renal ischemia-reperfusion injury in male rats.Ren Fail,2009,31:36-43.
