灯盏细辛提取物对2 型糖尿病小鼠氧化损伤的保护作用研究
2014-01-08王建勇杨庆雄黄小燕
王建勇,杨庆雄,黄小燕*
1贵州师范大学生命科学学院;2 贵州师范大学化学与材料科学学院,贵阳 550001
灯盏细辛[Erigeron breviscapus(Vant.)Hand.-Mazz.]是菊科(Compositae)飞蓬属(Erigeron)植物,产于湖北、广西、贵州、四川、云南及西藏等省区。临床主要用于治疗脑血栓形成、脑栓塞等[1,2];本课题前期研究发现,灯盏细辛提取物具有改善2 型糖尿病模型动物糖代谢,调节血脂等作用[3,4],但具体机制尚不明确,本研究将从灯盏细辛提取物抗氧化以及对肝脏、胰腺损伤的保护作用,探讨其改善糖代谢、调节血脂的相关机制。
1 材料与仪器
1.1 灯盏细辛提取物的制备
灯盏细辛,采自云南弥勒,由中国科学院昆明植物研究所杨崇仁研究员鉴定;干燥灯盏细辛药材经粉碎后,用70%乙醇热回流提取三次,合并提取液,回收溶剂,得灯盏细辛总提取物。总提取物经水乙酸乙酯萃取三次,合并乙酸乙酯回收溶剂得浅棕色粉末,总酚粉末经大孔树脂柱层析进一步纯化,得到供试药粉末,冰箱保存备用,实验时按要求配制相应浓度药液。
1.2 试验动物
选取健康成年KM 种小鼠,体重18~20 g,雌雄各半,购于第三军医大学大坪医院野战外科研究所医学实验动物中心,合格证号:SCXK(渝)2001-0005。分笼饲养于贵州省贵阳中医学院药理教研室实验室。动物适应性喂养1 周后开始实验。室温18~28 ℃,相对湿度62%~80%。
1.3 主要试剂
高糖高脂饲料(蛋黄2.5%,蔗糖20%,猪油10%,基础饲料67.5%);生理盐水(重庆大新药业股份有限公司,批号:09082210);95%医用酒精(贵州宏泰工贸保健品厂,批号:09082305);四氧嘧啶(SIGMA 公司,批号:L7424);盐酸吡格列酮片(江苏德源药业有限公司,生产批号:11110351);胆固醇测定试剂盒(批号:BD1315)、甘油三酯测定试剂盒(批号:BA1293,Siemens Healthcare Diagonstics Inc.);总超氧化物歧化酶(T-SOD 生产批号:20120903)测定试剂盒、丙二醛(MDA 生产批号:20120905)测定试剂盒:购自南京建成生物工程研究所;其他试剂均为分析纯。
1.4 主要仪器
UV-1800 型紫外-可见分光光度计(日本岛津有限公司);稳豪血糖仪(强生公司);恒温水浴锅(天津市泰斯特仪器有限公司);电子天平(美国丹佛);TG16-W 微量高速台式离心机(长沙湘仪离心机仪器有限公司);OLYMPUS 光学显微镜[日本奥林巴斯(中国)有限公司];MIAS-4400 显微图像分析系统(北京炳洋科技有限公司)等。
2 试验方法
2.1 动物前期饲养及处理
,建立2 型糖尿病实验动物模型[5],试验期间,严格按照动物饲养管理标准和规范进行饲养。随机选取出20 只小鼠喂普通饲料,自由饮水,其余小鼠喂高糖高脂饲料,自由饮水。喂养8 周后,两组各随机抽取4 只小鼠禁食不禁水12h,摘眼球取血,3000 rpm 离心5 min,取血清,进行血脂检测,喂高糖高脂饲料的小鼠血清中TC、TG 较对照组显著升高(P<0.01),表明高脂动物模型建模成功。取高脂模型小鼠禁食不禁水12 h,腹腔注射小剂量四氧嘧啶(180 mg/kg)。72 h 后,对小鼠进行尾尖取血,用血糖仪检测小鼠空腹血糖(检测前12 h 禁食不禁水),以血糖值≥10 mmol/L 为建立2 型糖尿病模型标准,筛选造模成功动物。
2.2 动物分组及处理
选取喂养普通饲料的小鼠10 只作为正常对照组;2 型糖尿病模型小鼠按血糖值随机分成4 组,每组10 只,分别为模型组、灯盏细辛提取物高(200 mg/kg·d)、低剂量组(100 mg/kg·d),吡格列酮(100 mg/kg·d)组,灌胃给药,0.1 mL/10 g 体重,连续15 d。正常对照组给予等体积生理盐水。除正常对照组外,其余各组继续喂高糖高脂饲料。末次给药1 h 后,小鼠眼球取血,3000 rpm 离心5 min,分离血清。取血后小鼠立即采用颈椎脱臼处死,取肝脏和胰腺组织,分别放于10%的福尔马林中固定。
2.3 测定方法
严格按照试剂盒说明书分别进行测定,T-SOD酶活性测定采用黄嘌呤氧化酶法;MDA 浓度测定采用硫代巴比妥酸(TBA)法,检测血清SOD 酶活性及MDA 浓度。病理切片采用常规HE 染色观察,观察胰腺外分泌部腺泡细胞和肝细胞变性及坏死,炎症细胞浸润,间质水肿,血管反应,纤维增生。上述病变占组织块的30%以下1 分,占30%~50%之间2分,占50%以上3 分,将所有评分累加即胰腺和肝脏损伤的评分。
2.4 数据统计
数据用SPSS 16.0 统计软件进行处理,所得统计结果均以平均数±标准差表示,进行正态性检验,组间比较采用单因素方差分析,P<0.05作为显著性差异,P<0.01 作为极显著性差异。
3 试验结果
3.1 灯盏细辛提取物对小鼠血清中T-SOD 活力和MDA 含量的影响
结果表明(表1),模型组与正常组相比,血清中T-SOD 活力显著降低(P<0.01),血清中MDA 含量显著升高(P<0.01);灯盏细辛提取物低剂量组与模型组相比,血清中T-SOD 活力显著升高(P<0.05),血清中MDA 含量显著降低(P<0.01);灯盏细辛提取物高剂量组与模型组相比,血清中T-SOD活力显著升高(P<0.01),血清中MDA 含量显著降低(P<0.01);其中灯盏细辛提取物高剂量组与灯盏细辛提取物低剂量组相比,对提高血清T-SOD 活力的作用效果差异不显著(P>0.05),对降低血清中MDA 含量的作用效果差异也不显著(P>0.05)。由结果可以看出,灯盏细辛提取物能够显著提升2型糖尿病小鼠血清T-SOD 的活力,降低其血清中MDA 的含量,具有较强的体内抗氧化活性。

表1 小鼠血清中总超氧化物歧化酶(T-SOD)活力及丙二醛(MDA)含量的测定结果Table 1 The T-SOD activities and MDA concentrations of mice serums in different groups
3.2 灯盏细辛提取物对2 型糖尿病模型小鼠胰腺、肝脏病理改变的影响
3.2.1 小鼠胰腺组织病理损伤评分
病理切片检测表明,正常组小鼠胰腺组织中见个别腺泡细胞变性,其余腺泡细胞无变性坏死,偶见间质血管充血及炎症细胞浸润,未见间质水肿。与正常组相比,模型组小鼠胰腺组织中腺细胞变性、间质血管充血、间质水肿及炎症细胞浸润部分非常明显;与模型组相比,灯盏细辛高剂量组和灯盏细辛低剂量组小鼠胰腺组织中腺细胞变性、间质血管充血、间质水肿及炎症细胞浸润部分明显较少,通过组织病理损伤评分结果表明,灯盏细辛提取物对2 型糖尿病小鼠胰腺组织损伤具有一定的改善作用。评分结果见表2。
表2 HE 观察小鼠胰腺组织病理损伤评分(± s)Table 2 Scores of pathological damages of pancreas tissue of mice in different groups(± s)
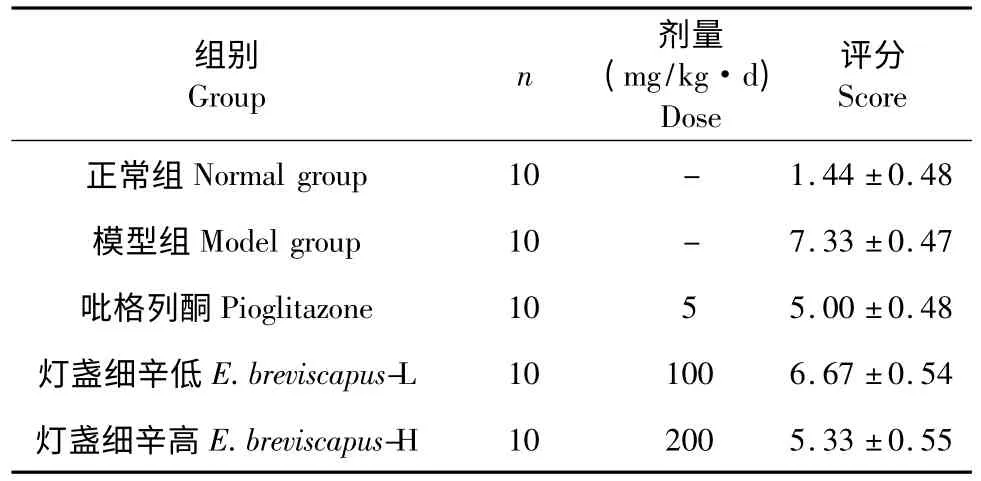
表2 HE 观察小鼠胰腺组织病理损伤评分(± s)Table 2 Scores of pathological damages of pancreas tissue of mice in different groups(± s)
3.2.2 小鼠肝脏组织病理损伤评分
病理切片检测表明,正常组小鼠肝脏组织中见个别肝细胞变性,其余肝细胞无变性坏死,偶见间质血管充血及炎症细胞浸润,未见间质水肿。与正常组相比,模型组小鼠肝脏组织中肝细胞变性、间质血管充血、间质水肿及炎症细胞浸润部分非常明显;与模型组相比,灯盏细辛高剂量组和灯盏细辛低剂量组小鼠肝脏组织中肝细胞变性、间质血管充血、间质水肿及炎症细胞浸润部分明显较少,通过组织病理损伤评分结果表明,灯盏细辛提取物对2 型糖尿病小鼠肝脏组织损伤具有一定的改善作用。评分结果见表3。
4 讨论

图1 胰腺组织病理切片(400X)Fig.1 Pathological sections of pancreas tissues (400X)
表3 HE 观察小鼠肝脏组织病理损伤评分(± s)Table 3 The scores of pathological damage of liver tissue of mice in different groups(± s)
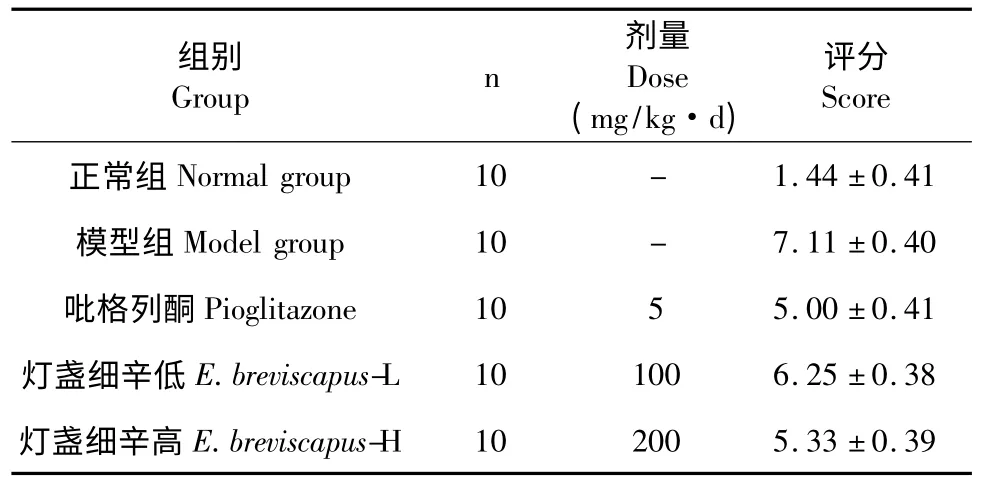
表3 HE 观察小鼠肝脏组织病理损伤评分(± s)Table 3 The scores of pathological damage of liver tissue of mice in different groups(± s)
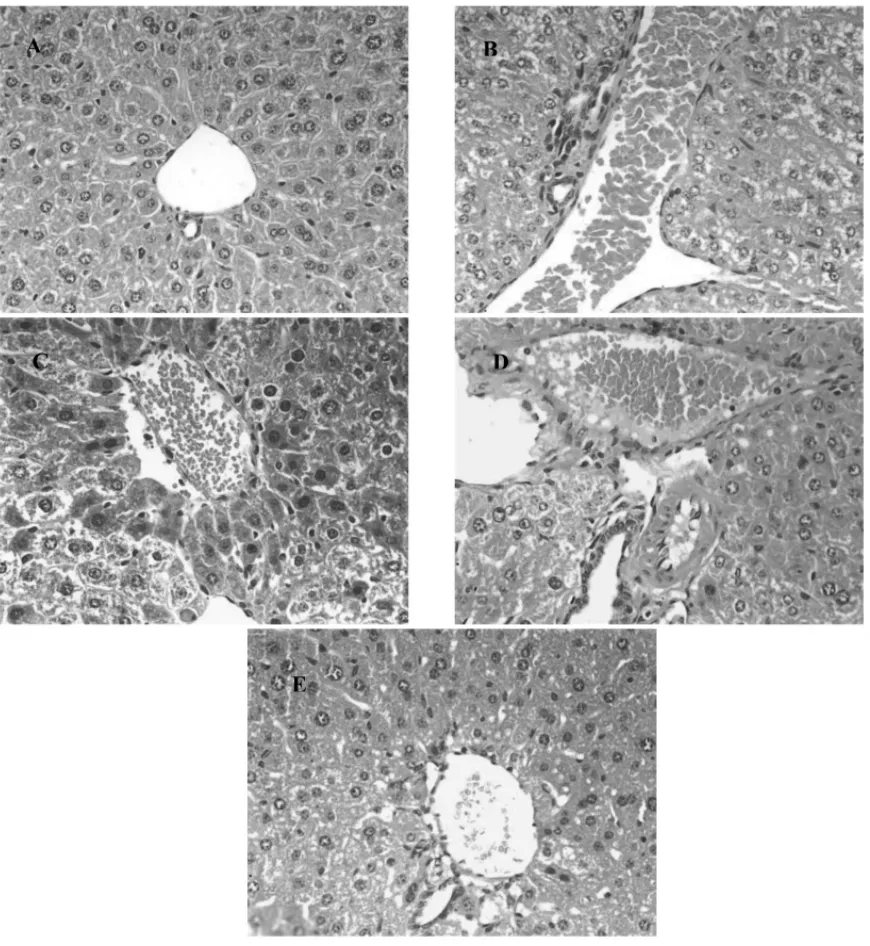
图2 肝脏组织病理切片(400X)Fig.2 Pathological sections of liver tissues (400X)
大量动物实验和临床研究证明,患糖尿病时存在着明显的氧化应激效应[6],糖尿病活性氧增多的确切机制尚未完全阐明,可能的原因:升高的血糖和糖化血红蛋白自氧化使自由基的产生增加,机体抗氧化系统清除自由基的能力减弱,葡萄糖自氧化产生的醛基进一步氧化修饰蛋白质,导致蛋白质结构和功能改变而参与氧化应激[7]。正常机体内自由基代谢维持动态平衡,是由于存在有效的自由基清除系统。动物体内源性自由基清除系统包括酶和非酶抗氧化系统。SOD 是生物酶系统抗氧化剂,MDA是氧自由基引起的脂质过氧化反应所产生的脂质过氧化物在机体内的代谢终产物,能够间接地反映机体内氧自由基代谢状况、机体组织细胞受自由基攻击的程度及脂质过氧化程度[8]。由本实验结果可以看出,灯盏细辛提取物能够显著提升2 型糖尿病小鼠血清T-SOD 的活力,降低其血清中MDA 的含量,能够有效清除体内活性氧自由基和脂质过氧化物,保护机体免受自由基的损伤。
研究发现,2 型糖尿病发生中,常同时存在脂代谢紊乱,超过一半的2 型糖尿病患者合并脂代谢紊乱,造成脂肪酸在胰岛内沉积,导致胰岛细胞的“脂毒性”和“脂凋亡”,继而引起胰岛功能衰竭[9]。肝脏有大量胰岛素受体,肝脏得不到滋养时,必然会使代谢产生的有害物质积聚,进一步损伤肝细胞线粒体,使其能量供应受损,核糖体合成蛋白质的活性下降,肝脏合成蛋白质的能力减弱。而肝脏、胰腺的损伤又进一步加剧了血糖及脂肪代谢的紊乱。本研究表明,灯盏细辛提取物对2 型糖尿病小鼠胰脏、肝脏组织损伤具有一定的改善作用,可以减轻模型动物肝脏及胰腺组织炎症细胞浸润及变性、水肿等。
综上研究结果,灯盏细辛提取物能够改善血糖代谢以及血脂代谢与其有效清除体内活性氧自由基和脂质过氧化物以及对肝脏和胰腺的保护作用有关。
参考文献
1 Flora of China Editorial Committee of Chinese Academy of Sciences(中国科学院中国植物志编辑委员会).Flora of China(中 国 植 物 志).Beijing:Science and Technology Press,1985.74,308.
2 Zhang XL(张晓莉),Liu SH(刘四海),Zhou F(周芳),et al.Study advancement about pharmacological actions ofErigeron breviscapus.Sichuan J Physiol Sci(四川生理科学杂志),2008,30(2):75-77.
3 Dang CZ(党翠芝),Huang XY(黄小燕),Yang QX(杨庆雄).Antioxidant activity of constituents fromErigeron breviscapus.China J Exp Tradit Med Form(中国实验方剂学杂志),2012,18:100-103.
4 Huang XY(黄小燕),Dang CZ(党翠芝),Yang QX(杨庆雄).The effect of extracts fromErigeron breviscapusplants on treating type 2 diabetic hyperlipidemia.Lishizhen Med Mater Med Res(时珍国医国药),2013,24:847-849.
5 Ai J(艾静),Wang N(王宁),Du J(杜杰),et al.Establishment of type 2 diabetic animal model in Wistar rats.Chin Pharm Bull(中国药理学通报),2004,20:1309-1312.
6 Hunt JV,Smith CC,Wolff SP.Autoxidative glycosylation and possible involvement of peroxides and free radicals in LDL modification by glucose.Diabetes,1990,39:1420-1424.
7 Genet S,Kale RK,Baquer NZ.Alterations in antioxidant enzymes and oxidative damage in experimental diabetic rat tissues:effect of vanadate and fenugreek (Trigonellafoenum graceum).Mol Cell Biochem,2002,236(1-2):7-12.
8 Zhao Y(赵燕),Liu GY(刘国艳),Shi XM(史贤明).Study on antioxidative activity of the extract and mogroside ofSiraitia grosvenorii in vivo.Food Res Dev(食品研究与开发),2012,33:174-176.
9 Xu ZR(许樟荣),Wang YZ(王玉珍),Jing H(敬华),et al,Lipids disorder,macrovascular diseases,and insulin resistance in Chinese diabetic patients.Acta Acade Med Sin(中国医学科学院学报),2002,24:457-461.
