11个携带线粒体tRNASer(UCN) G7444A突变的中国汉族非综合征型耳聋家系分析评估
2014-01-05唐霄雯阳娅玲高应龙肖红利何哲耘郑静郑斌娇吕建新金龙金管敏鑫
唐霄雯,阳娅玲,高应龙,肖红利,何哲耘,郑静,3,郑斌娇,吕建新,金龙金,管敏鑫,3
(1.温州医科大学 Attardi线粒体生物医学研究院,浙江 温州 325035;2.温州医科大学 仁济学院,浙江 温州 325035;3.浙江大学 遗传研究所,浙江 杭州 310058)
耳聋是人类感觉系统障碍最常见的疾病之一。50%以上的耳聋是由遗传因素造成的,遗传方式包括常染色体显性遗传、常染色体隐性遗传、X-连锁以及母系遗传等[1-2]。线粒体DNA(mitochondrial DNA,mtDNA)突变是母系遗传性耳聋重要的分子遗传基础。目前与氨基糖甙类(aminoglycoside antibiotics,AmAn)药物性耳聋和非综合征型耳聋密切相关的mtDNA突变主要集中在线粒体12S rRNA和tRNASer(UCN)基因上[3-5]。其中位于线粒体12S rRNA上的A1555G和C1494T突变分别导致新的G-C和A-U碱基配对的形成,在线粒体12S rRNA上形成一个与AmAn结合的位点,使该类药物更容易结合到线粒体12S rRNA上,从而导致耳聋的发生[6-7]。而位于线粒体tRNASer(UCN)基因上的A7445G、A7445C、G7444A、7472insC、T7510C和T7511C突变在功能上已经被证明与非综合征型耳聋发病相关[8-13]。本研究将对已收集的以及新发现的11个携带线粒体tRNASer(UCN)G7444A突变的中国汉族母系遗传非综合征型耳聋家系从临床、家系和分子遗传学等角度进行详细的评估和分析。
1 对象和方法
1.1 研究对象 选取2003年4月-2013年12月本课题组收集的中国汉族非综合征型耳聋患者样本2 650例。所有患者的临床资料以及外周血样采集均依据温州医科大学伦理委员会管理规定执行。经温州、宁波地区4家医院耳鼻咽喉头颈外科门诊进行详细的发病史调查和体格检查,确定患者是否具有其他临床疾病表型,是否有AmAn使用史,以及是否有噪声接触史等其他致聋因素。
1.2 听力学检查 听力学检查主要包括纯音测听(pure tone audiometry,PTA)、听觉脑干反应(auditory brainstem response,ABR)、声阻抗以及畸变产物耳声发射(distortion product otoacoustic,DPOAE)。以听力水平的分贝(dB)值为单位记录PTA结果,并以频率500、1 000、2 000、4 000和8 000 Hz的听阈平均值计算,根据标准对患者听力损失程度进行分类,分5级:正常≤25 dB,轻度聋=26~40 dB,中度聋=4l~70 dB,重度聋=71~90 dB和极重度聋>90 dB。PTA的听力曲线类型分为斜坡型(slope):听力损失主要以2 000~8 000 Hz为主,患者听力阈值水平随测试频率的升高而逐渐升高;平坦型(flat):也称全频听力下降型曲线,患者各声音频率的听力水平基本一致;上升型(rising):患者的低频听力250~1 000 Hz较差,随测试频率的升高听力阈值逐渐降低;谷型(valley):听力损失以500~2 000 Hz为主;切迹型(notched):仅单一频率处阈值明显升高,相邻频率正常或接近于正常;山型(ridge):中间频率阈值比两端至少低20 dB。
1.3 耳聋相关热点基因突变检测
1.3.1 全基因组DNA提取:首先抽取耳聋患者外周静脉血2~3 mL(EDTA抗凝),使用DNA提取试剂盒(Universal Genomic DNA Extraction Kit Ver.4.0)提取全基因组DNA,-20 ℃保存。婴幼儿可采用三菱针针刺患儿耳垂、足底或手指,滤纸吸取2~3滴静脉血后使用酚氯仿手工法提取全基因组DNA[14],-20 ℃保存。
1.3.2 耳聋相关热点基因突变检测:以提取的全基因组DNA为模板,PCR扩增耳聋患者的线粒体12S rRNA、tRNASer(UCN)基因以及GJB2基因编码区[15-16],相应PCR扩增信息及测序峰图如表1和图1所示。
PCR产物经纯化后送华大基因测序公司进行双向测序,测序结果与校正的剑桥标准序列进行比对[17],以确定是否含有耳聋相关热点基因突变。
2 结果
2.1 先证者临床资料分析 新发现的4个携带线粒体tRNASer(UCN)G7444A突变家系如图2所示。NB133家系,先证者(II-3),男,24岁,2岁时因感冒静脉注射AmAn抗感染1 d,1个月后发现双侧听力下降,用药前说话正常。先证者的两个哥哥均表现为中度耳聋,大哥(II-4),42岁,有庆大霉素、新霉素用药史,右耳听阈55 dB,左耳听阈53 dB;二哥(II-6),39岁,右耳听阈52 dB,左耳听阈62 dB,听力曲线均为斜坡型。家系其他成员无AmAn用药史且听力正常。NB148家系,先证者(III-2),男,19岁,先天性耳聋,7~8个月时有用药史(具体用药不详),用药后逐渐出现听力下降。先证者弟弟(III-1),男,16岁,1个月时发现听力损失,右耳听阈113 dB,左耳听阈110 dB,听力曲线为斜坡型。家系其他成员听力正常。WLT024家系,先证者(III-2),女,13岁,无明确用药史,1岁时发现听力不好,测听发现极重度听力下降。右耳听阈110 dB,左耳听阈115 dB,听力曲线为平坦型。先证者表弟(III-10),男,7岁,先天性耳聋。WLT122家系,先证者(III-1),女,4岁,出生时对声音有反应,2岁时无诱因出现听力下降,否认AmAn用药史。右耳听阈108 dB,左耳听阈106 dB。先证者表弟(III-3)先天性耳聋,其母亲怀孕7个月时白带检验支原体阳性,医生曾告诫孩子出生后可能为聋哑儿。其他7个家系先证者及母系成员详细临床资料见杨爱芬等[18]和Jin等[19]报道。

表1 线粒体12S rRNA、tRNASer(UCN) 基因以及GJB2基因编码区扩增信息

图1 线粒体tRNASer(UCN)基因G7444A突变测序峰图
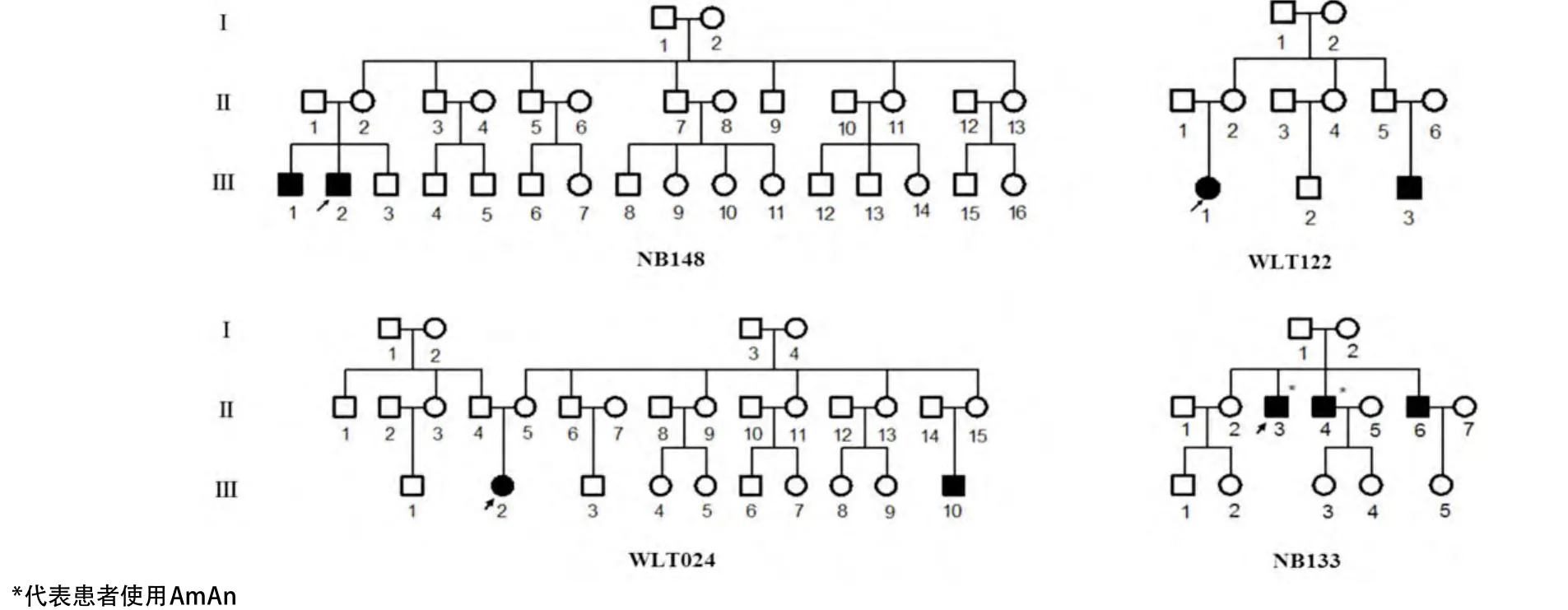
图2 4个携带线粒体tRNASer(UCN) G7444A突变的耳聋家系图
携带线粒体tRNASer(UCN)G7444A基因突变非综合征型耳聋家系11个先证者(见表2),男7个,女4个,测听年龄4~24岁不等,发病年龄均在婴幼儿时期(<3岁)。其中3例无AmAn用药史,11例患者均表现为双耳对称性听力下降,听力下降水平均为重度及以上。听阈以高频下降为主,PTA听阈曲线以斜坡型居多。

表2 11个携带线粒体tRNASer(UCN) G7444A基因突变家系先证者临床资料
2.2 耳聋相关突变热点分析 线粒体tRNASer(UCN)G7444A突变与非综合征型耳聋相关[10]。该突变造成线粒体重链上COI基因终止密码子AGA改变为AAA,导致COI基因翻译出的多肽在羧基末端增加了3个氨基酸残基(Lys、Gln和Lys)。同时,线粒体tRNASer(UCN)G7444A位点临近轻链上tRNASer(UCN)前体3’端核酸外切酶的作用位点(见图3)[9,12-13,20],而且线粒体tRNA初级转录产物3’端多余核苷酸需在核酸外切酶的作用下从末端逐个切除[21],因此,线粒体tRNASer(UCN)G7444A突变可能影响tRNASer(UCN)的加工修饰。Guan等[22-23]发现tRNASer(UCN)前体上A7445G突变可造成tRNASer(UCN)前体加工缺陷,从而导致tRNASer(UCN)稳定性和ND6 mRNA量的明显下降。而线粒体tRNASer(UCN)7444位点与7445位点位置相邻,可能通过相似机制影响线粒体功能。

图3 人类线粒体tRNASer(UCN)二级结构图
本研究对收集的2 650例中国汉族非综合征型耳聋样本进行耳聋相关突变热点分析发现,其中14例携带线粒体tRNASer(UCN)G7444A突变,突变率为0.5%。在仅携带线粒体tRNASer(UCN)G7444A突变的LS40、RA119、HA186和HA115 4个家系中,考虑AmAn用药史的情况下,外显率分别为9%、37.5%、13.3%、6.7%;不考虑AmAn用药史的情况下外显率分别为0、25%、7.7%、0。表明线粒体tRNASer(UCN)G7444A突变可能在AmAn性耳聋中发挥一定的作用。这11个中国汉族非综合征型耳聋家系母系成员在听力损失严重程度、发病年龄以及耳聋外显率方面存在较大差异,推测除线粒体tRNASer(UCN)G7444A突变在这些家系中发挥作用外,可能其他因素如核基因和线粒体背景等因素也发挥一定的作用。在11个携带线粒体tRNASer(UCN)G7444A突变耳聋家系中,母系人数共126人,其中26人发病,男16人,女10人。当包括和不包括AmAn使用史时,耳聋的平均外显率分别为20.6%和10.3%,明显高于只携带线粒体tRNASer(UCN)G7444A突变家系耳聋外显率,而这6个家系同时携带有其他突变位点(表3所示)。如NB133家系同时携带线粒体tRNASer(UCN)G7444A和线粒体12S rRNA C1494T突变,外显率高达42.9%。SX003、YJ042和YJ049 3个家系同时携带线粒体tRNASer(UCN)G7444A和线粒体12S rRNA A1555G突变,平均发病率为29.4%。线粒体12S rRNA A1555G和C1494T突变是目前已知的与母系遗传药物性耳聋和非综合征型耳聋发病密切相关的主要线粒体突变位点,世界各地已有多个相关报道[6,24-25]。不仅如此这几个家系家系内和家系间的母系成员在听力损失程度、发病年龄以及听力临床表型上都存在很大差异[17-19,26-29]。因此,推测在这6个家系中,线粒体tRNASer(UCN)G7444A突变可能与线粒体12S rRNA A1555G和C1494T原发突变存在协同作用,共同影响非综合征型耳聋的表型表达。除此之外,2001年,Abe等[30]报道了1个同时携带线粒体12S rRNA A1555G突变和GJB2基因突变的日本耳聋家系,并认为GJB2基因突变加重了mtDNA突变导致的耳聋表型。Kokotas等[31]也报道了一个同时携带GJB 235delG杂合突变和线粒体tRNASer(UCN)G7444A同质性突变的希腊耳聋家系。目前,仅在一些中国、日本、西班牙及希腊等耳聋家系中报道了GJB2基因突变和mtDNA突变协同致病现象[32]。本研究中发现的WLT024和WLT122家系同时携带线粒体tRNASer(UCN)G7444A和GJB2 235delC-/-突变,家系耳聋平均外显率为19.0%。耳聋外显率与只携带线粒体tRNASer(UCN)G7444A突变5个家系不考虑AmAn用药史的情况下的平均外显率差别不明显,是否存在协同作用仍需要对家系进行深入调查,并进行进一步的功能验证。
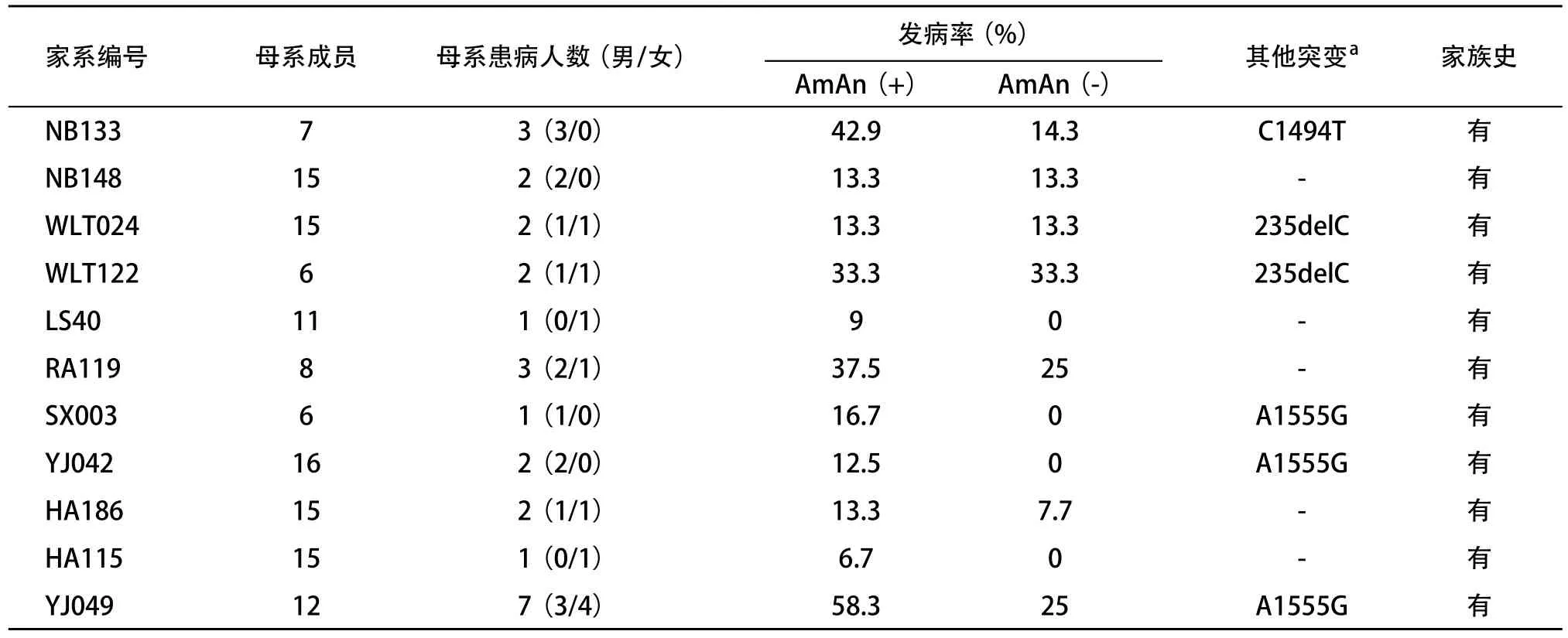
表3 11个携带线粒体tRNASer(UCN) G7444A突变耳聋家系临床及分子遗传学资料
3 讨论
本研究探讨了11个携带线粒体tRNASer(UCN)G7444A基因突变的中国汉族非综合征型耳聋家系的临床、家系、遗传学特征及可能的分子致聋机制。这11个家系中,听力障碍作为唯一的临床表型仅存在于母系成员中(除同时携带线粒体tRNASer(UCN)G7444A突变和GJB2 235delC的家系外),提示在这11个家系中耳聋的发病与线粒体DNA的突变密切相关。同时针对耳聋相关的热点突变筛查发现,在2 650例中国汉族非综合征型耳聋患者中,14例携带线粒体tRNASer(UCN)G7444A突变,突变率为0.53%,分属于11个耳聋家系。在这11个携带线粒体tRNASer(UCN)G7444A突变的家系中,其中同时携带线粒体tRNASer(UCN)G7444A突变和线粒体12S rRNA A1555G、12S rRNA C1494T或GJB2 c.235delC的家系分别为3、1和2个。这6个家系中家系内和家系间的母系成员在听力损失程度、发病年龄以及听力临床表征上均存在很大差异。同时携带线粒体tRNASer(UCN)G7444A突变和线粒体12S rRNA A1555G、C1494T或GJB2 c.235delC突变的家系的耳聋平均外显率分别为29.4%、42.9%和19.0%,而且同时携带线粒体tRNASer(UCN)G7444A突变和线粒体12S rRNA A1555G或C1494T突变家系耳聋的平均外显率明显高于只携带线粒体tRNASer(UCN)G7444A突变耳聋家系的平均外显率14.0%。提示在这11个中国汉族非综合征型耳聋家系中,携带线粒体tRNASer(UCN)G7444A突变和线粒体12S rRNA A1555G、C1494T或GJB2 c.235delC突变的6个家系线粒体tRNASer(UCN)G7444A突变可能与线粒体12S rRNA A1555G和C1494T原发突变存在协同作用,共同影响这些非中国汉族非综合征型耳聋家系耳聋的表型。然而明确线粒体tRNASer(UCN)G7444A突变和线粒体12S rRNA A1555G或C1494T突变之间是否存在协同作用,进一步揭示母系遗传性耳聋的分子致病机制仍需要深入开展功能验证相关研究。
[1] Morton CC. Genetics, genomics and gene discovery in the auditory system[J]. Hum Mol Genet, 2002, 11(10): 1229-1240.
[2] Xing G, Chen Z, Cao X. Mitochondrial rRNA and tRNA and hearing function[J]. Cell Res, 2007, 17(3): 227-239.
[3] Prezant TR, Agapian JV, Bohlman MC, et al. Mitochondrial ribosomal RNA mutation associated with both antibioticinduced and non-syndromic deafness[J]. Nat Genet, 1993,4(3): 289-294.
[4] Li R, Xing G, Yan M, et al. Cosegregation of C-insertion at position 961 with the A1555G mutation of the mitochondrial 12S rRNA gene in a large Chinese family with maternally inherited hearing loss[J]. Am J Med Genet A, 2004,124A(2): 113-117.
[5] 赵立东, 王秋菊, 郭维维, 等. 与线粒体 DNA A1555G突变有关的非综合征型耳聋[J]. 中华耳科学杂志, 2004, 2(2):136-141.
[6] Zhao H, Li R, Wang Q, et al. Maternally inherited aminoglycoside-induced and nonsyndromic deafness is associated with the novel C1494T mutation in the mitochondrial 12S rRNA gene in a large Chinese family[J]. Am J Hum Genet,2004, 74(1): 139-152.
[7] Hamasaki K, Rando RR. Specific binding of aminoglycosides to a human rRNA construct based on a DNA polymorphism which causes aminoglycoside-induced deafness[J]. Biochemistry, 1997, 36(40): 12323-12328.
[8] Pandya A, Xia XJ, Erdenetungalag R, et al. Heterogenous point mutations in the mitochondrial tRNASer(UCN)precursor coexisting with the A1555G mutation in deaf students from Mongolia[J]. Am J Hum Genet, 1999, 65(6): 1803-1806.
[9] Li R, Ishikawa K, Deng JH, et al. Maternally inherited nonsyndromic hearing loss is associated with the T7511C mutation in the mitochondrial tRNASer(UCN)gene in a Japanese family[J]. Biochem Biophys Res Commun, 2005, 328(1): 32-37.
[10] 李为民, 韩东一, 袁慧军, 等. 非综合征型遗传性聋家系系谱分析及mtDNA 12S rRNA tRNALeu(UUR)tRNASer(UCN)基因突变分析[J]. 临床耳鼻咽喉科杂志, 2004, 18(10): 582-585.
[11] Yuan H, Qian Y, Xu Y, et al. Cosegregation of the G7444A mutation in the mitochondrial COI/tRNA(Ser(UCN)) genes with the 12S rRNA A1555G mutation in a Chinese family with aminoglycoside-induced and nonsyndromic hearing loss[J]. Am J Med Genet A, 2005, 138A(2): 133-140.
[12] Yuan H, Chen J, Liu X, et al. Coexistence of mitochondrial 12S rRNA C1494T and CO1/tRNASer(UCN)G7444A mutations in two Han Chinese pedigrees with aminoglycosideinduced and non-syndromic hearing loss[J]. Biochem Biophys Res Commun, 2007, 362(1): 94-100.
[13] Fischel-Ghodsian N, Prezant TR, Fournier P, et al. Mitochondrial mutation associated with nonsyndromic deafness[J]. Am J Otolaryngol, 1995, 16(6): 403-408.
[14] 张永梅, 冀延春, 刘晓玲, 等. 线粒体tRNAGluA14693G可能是与Leber遗传性视神经[J]. 遗传, 2010, 32(4): 35-3359.
[15] Ruiz-Pesini E, Wallace DC. Evidence for adaptive selection acting on the tRNA and rRNA genes of human mitochondrial DNA[J]. Hum Mutat, 2006, 27(11): 1072-1081.
[16] Lu J, Li Z, Zhu Y, et al. Mitochondrial 12S rRNA variants in 1642 Han Chinese pediatric subjects with aminoglycosideinduced and nonsyndromic hearing loss[J]. Mitochondrion,2010, 10(4): 380-390.
[17] Andrews RM, Kubacka I, Chinnery PF, et al. Reanalysis and revision of the Cambridge reference sequence for human mitochondrial DNA[J]. Nat Genet, 1999, 23(2): 147.
[18] 杨爱芬, 郑静, 吕建新, 等. 修饰因子对线粒体DNA突变致聋的影响[J]. 中华医学遗传学杂志, 2010, 28(2): 16-5171.
[19] Jin L, Yang A, Zhu Y, et al. Mitochondrial tRNASer(UCN)gene is the hot spot for mutations associated with aminoglycoside-induced and non-syndromic hearing loss[J]. Biochem Biophys Res Commun, 2007, 361(1): 133-139.
[20] Zhu Y, Qian Y, Tang X, et al. Aminoglycoside-induced and non-syndromic hearing loss is associated with the G7444A mutation in the mitochondrial COI/tRNASer(UCN)genes in two Chinese families[J]. Biochem Biophys Res Commun,2006, 342(3): 843-850.
[21] Levinger L, Morl M, Florentz C. Mitochondrial tRNA 3’end metabolism and human disease[J]. Nucleic Acids Res,2004, 32(18): 5430-5441.
[22] Guan MX, Enriquez JA, Fischel-Ghodsian N, et al. The deafness-associated mitochondrial DNA mutation at position 7445, which affects tRNASer(UCN)precursor processing, has long-range effects on NADH dehydrogenase subunit ND6 gene expression[J]. Mol Cell Biol, 1998, 18(10):5868-5879.
[23] 郑静, 郑斌娇, 方芳, 等. 与耳聋相关的线粒体tRNA突变[J]. 生物化学与生物物理进展, 2012, 39(1): 2-230.
[24] Chen J, Yang L, Yang A, et al. Maternally inherited aminoglycoside-induced and nonsyndromic hearing loss is associated with the 12S rRNA C1494T mutation in three Han Chinese pedigrees[J]. Gene, 2007, 401(1-2): 4-11.
[25] Estivill X, Govea N, Barcelo E, et al. Familial progressive sensorineural deafness is mainly due to the mtDNA A1555G mutation and is enhanced by treatment of aminoglycosides[J]. Am J Hum Genet, 1998, 62(1): 27-35.
[26] Tang X, Yang L, Zhu Y, et al. Very low penetrance of hearing loss in seven Han Chinese pedigrees carrying the deafness-associated 12S rRNA A1555G mutation[J]. Gene,2007, 393 (1-2): 11-19.
[27] 张婷, 陈波蓓, 郑静, 等. 五个母系遗传非综合征性耳聋和药物性耳聋的中国汉族家系[J]. 中华医学遗传学杂志,2011, 28(4): 367-373.
[28] Chen B, Sun D, Yang L, et al. Mitochondrial ND5 T12338C,tRNACysT5802C, and tRNAThrG15927A variants may have a modifying role in the phenotypic manifestation of deafness-associated 12S rRNA A1555G mutation in three Han Chinese pedigrees[J]. Am J Med Genet A, 2008, 146A(10): 1248-1258.
[29] Lu J, Qian Y, Li Z, et al. Mitochondrial haplotypes may modulate the phenotypic manifestation of the deafnessassociated 12S rRNA 1555A>G mutation[J]. Mitochondrion, 2010, 10(1): 69-81.
[30] Abe S, Kelley PM, Kimberling WJ, et al. Connexin 26 gene(GJB2) mutation modulates the severity of hearing loss associated with the 1555A→G mitochondrial mutation[J]. Am J Med Genet, 2001, 103(4): 334-338.
[31] Kokotas H, Grigoriadou M, Yang L, et al. Homoplasmy of the G7444A mtDNA and heterozygosity of the GJB2 c.35delG mutations in a family with hearing loss[J]. Int J Pediatr Otorhinolaryngol, 2011, 75(1): 89-94.
[32] Kokotas H, Grigoriadou M, Korres GS, et al. Are GJB2 mutations an aggravating factor in the phenotypic expression of mitochondrial non-syndromic deafness?[J]. J Hum Genet,2010, 55(5): 265-269.
