CdTe量子点与蛋白质相互作用的荧光猝灭效应
2014-01-05李荣霞安文汀李世琴赵俊红
焦 勇,李荣霞,安文汀,李世琴,赵俊红
(1.山西大学 分子科学研究所 化学生物学与分子工程教育部重点实验室,山西 太原030006;2.山西大学 化学化工学院,山西 太原030006)
自1998年水溶性量子点 (Quantum dots,QDs)成功应用于细胞成像以来[1,2],量子点以其宽激发-窄发射光谱和抗光漂白等优异性质,在生物成像、化学-生物传感器等领域展现出广阔的应用前景[3-9]。CdTe量子点的发射光谱随粒径的改变几乎可覆盖整个可见区,并具有较大的激子Bohr半径 (7.3nm),正在发展成为一类新型荧光探针[5]。体外研究量子点与蛋白质的相互作用及其对各自结构与性质的影响,可以模拟体内量子点与蛋白质的相互作用,为设计拓展量子点的生物医学应用提供依据。尽管人们已得到了量子点与蛋白质相互作用的结合常数[10]、热力学参数和驱动力等信息[11-14],但量子点与蛋白质作用对双方荧光性质的影响等关键问题,迄今尚未完全明了。
细胞色素c(Cytochrome c,Cyt c)是一种含铁卟啉蛋白,非常适宜于传递电子,是高效的荧光猝灭剂[14-18]。Cyt c表面的正电性残基使其可通过静电作用与表面负电性量子点发生相互作用。牛血清白蛋白(Bovine serum albumin,BSA)有两个色氨酸残基(Trp212和134)[19-22],具有内禀荧光;其表面的残基侧链能与量子点通过多种非共价作用相结合。
本文利用水热法合成了以N-乙酰基半胱氨酸(N-acetylcysteine,NAC)为稳定剂的水溶性CdTe和CdTe/CdS核壳量子点,研究了生理条件下Cyt c对不同粒径的CdTe和CdTe/CdS核壳量子点的荧光猝灭效应,以及CdTe量子点对BSA的荧光猝灭效应,并阐述了猝灭机理,为基于量子点-蛋白质荧光猝灭效应的相关应用提供了理论依据。
1 实验部分
1.1 试剂与仪器
碲粉、硼氢化钠、氯化镉、N-乙酰基-L-半胱氨酸(分析纯,阿拉丁试剂有限公司);氢氧化钠(分析纯,北京化工厂);高纯氮气(>99.999%,山西宜虹工业气体有限公司);牛血清白蛋白(99%,华美生物工程公司);细胞色素c(95%,Sigma);三(羟甲基)氨基甲烷(分析纯,美国AMRESCO)。
Varian-Cary 4000紫外分光光度计(美国瓦里安公司);Varian-Cary Eclipase荧光分光光度计(美国瓦里安公司);TE214S电子天平(德国赛多利斯科学仪器公司);Delta 320型酸度计(瑞士Mettler Teledo);JEM-2100透射电子显微镜(日本JEOL);FTIR-8400傅立叶变换红外光谱仪(日本岛津);JASCO 810圆二色谱仪(日本JASCO)。
1.2 CdTe量子点和CdTe/CdS核壳量子点的制备
按照参考文献所述方法[23]并加以改进,制备量子点。去离子水中,将NaBH4与Te粉以摩尔比2∶1反应制备NaHTe。冰水浴中,将20mL CdCl2溶液(12.5mmol/L)用去离子水稀释到170 mL,向其中注入20mL NAC溶液(30mmol/L)。用1.0mol/L NaOH溶液调节该前驱体溶液pH值为9.5。冰水浴中,通N2气30min。剧烈搅拌下,向其中迅速加入0.4mL NaHTe溶液(300 mmol/L)。控制Cd∶Te∶NAC的摩尔比约为1.0∶0.5∶2.4。将该橙黄色溶液转移至衬有聚四氟乙烯内胆的不锈钢反应釜中,在220℃反应31~55min,得到不同粒径的水溶性NAC稳定的CdTe量子点。按文献所述方法进行纯化[23]。
称取2.5mg Na2S固体溶解于5mL去离子水中备用。N2气保护下将其注入20mL的CdTe量子点中,冰浴下搅拌10min,然后装入不锈钢反应釜中,放入220℃烘箱中。加热一定时间后取出反应釜,得到NAC稳定的CdTe/CdS核壳量子点。
1.3 细胞色素c对CdTe量子点和CdTe/CdS核壳量子点荧光的猝灭效应
移取2.0mL 1.2×10-6mol/L不同粒径的CdTe量子点或CdTe/CdS核壳量子点的Tris-HCl溶液(0.05mol/L,pH 值为7.4)至1cm的比色皿中,10min后记录荧光光谱。每隔10min向上述溶液中加入适量的1.0×10-5mol/L Cyt c水溶液,摇匀,10min后测定荧光光谱。
1.4 CdTe量子点对牛血清白蛋白荧光的猝灭效应
移取2.0mL 3.0×10-6mol/L BSA的 Tris-HCl溶液 (0.05mol/L,pH 值为7.4)至1cm的比色皿中,10min后记录荧光光谱。每隔10min向上述溶液中加入适量的4.0×10-5mol/L CdTe量子点水溶液,摇匀,10min后测定荧光光谱。同样步骤向含有缓冲液的4.0×10-7mol/L CdTe量子点中加入不同浓度的BSA,测定其荧光光谱。
1.5 温度对CdTe量子点与牛血清白蛋白的荧光猝灭效应的影响
移取2.0mL 3.0×10-6mol/L BSA的 Tris-HCl溶液(0.05mol/L,pH 值为7.4)至1cm 的比色皿中,分别在20℃、25℃和30℃下恒温,10min后以280nm光激发进行荧光测定,然后每隔10min,向上述溶液中加入一定浓度的CdTe量子点储备液,分别考察20℃、25℃和30℃下的CdTe量子点对BSA的猝灭作用。
1.6 圆二色谱表征CdTe量子点对牛血清白蛋白构象的影响
向5.0×10-6mol/L BSA 溶液中,加入一定体积的CdTe量子点储备液,使其终浓度依次为0、4.0×10-8和2.0×10-7mol/L。圆二色谱由CdTe QDs-BSA结合物的椭偏率扣除同一波长下CdTe量子点的椭偏率而得到。
以上所有光谱测定均重复3次,除指明外,均在室温下进行。
2 结果与讨论
2.1 CdTe量子点的结构及光谱性质

图1 (A)CdTe量子点的紫外可见吸收光谱图,(B)归一化的CdTe量子点荧光光谱图,(C)紫外灯照射下发射不同波长荧光的CdTe量子点,(D)CdTe量子点的透射电镜图
图1A是不同粒径的CdTe量子点溶液的紫外-可见吸收光谱。1至7号样品的吸收峰分别位于416、501、534、548、579、592和606nm。样品的第一激子峰峰位从416nm显著红移至606nm,表明量子点的粒径在逐渐增大。图1B是相同样品在350nm光激发下的归一化荧光光谱图。1至7号样品的发射峰分别位于493、539、563、572、615、632和665nm,发射峰窄而对称,且随着发射波长的增长,半峰宽从21nm逐渐增大到70nm。图1C表示在紫外灯(254nm)照射下,随着CdTe量子点粒径的增大(从左至右),颜色由绿色逐渐变为黄色和红色。图1D是黄色CdTe量子点的高分辨透射电镜图,显示CdTe量子点形状近似球形,具有明显的晶格条纹,粒径约2~4nm,与基于紫外可见吸收光谱的计算结果2.44nm相吻合。
图2是NAC和CdTe量子点的傅里叶变换红外光谱图。NAC在2547cm-1处具有S—H的特征伸缩振动峰,而CdTe量子点则没有此峰。从图中还可看出,在1038cm-1附近保留了C—S的吸收峰,在3434cm-1处有羧羟基—OH 峰,1597~1653cm-1处有羰基峰,2900cm-1处有N—H的谱峰,说明稳定剂NAC主要是由巯基中的S与CdTe中的Cd进行配位形成Cd—S键而与量子点结合的,表明NAC已包覆到CdTe量子点表面,发挥稳定量子点的作用。绿、黄、红CdTe量子点的结构及光谱性质数据归纳于表1中。表中CdTe量子点的粒径根据Peng[24]的经验公式计算得到:
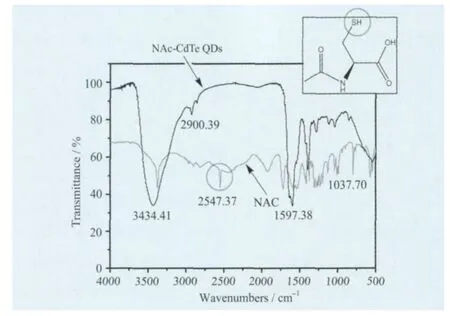
图2 NAC和CdTe量子点的傅里叶变换红外光谱图
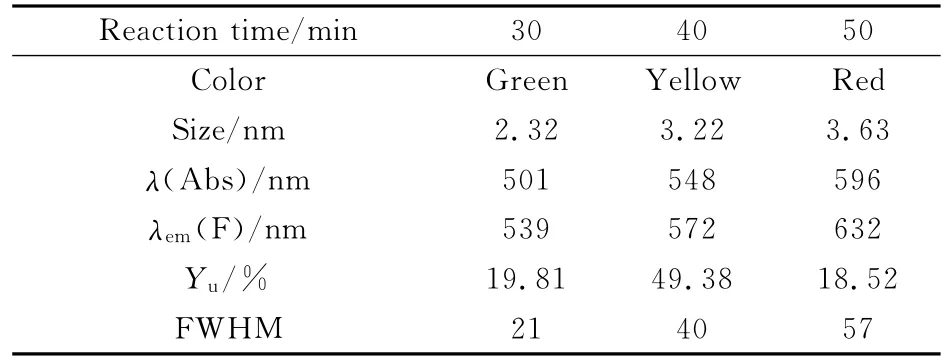
表1 绿、黄、红CdTe量子点的结构及光谱性质Structure and spectral properties of green,yellow and red CdTe QDs

式中,D(nm)为CdTe量子点的直径,λ(nm)为紫外-可见吸收光谱中CdTe量子点第一激子吸收峰的峰位。量子点的荧光性能用量子产率Yu来表征。按文献[25]所述方法,利用下式计算得到Yu:
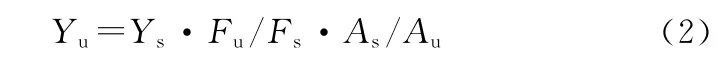
式中,Yu和Ys分别表示样品和标准物质的荧光量子产率,Fu和Fs分别表示样品和标准物质的积分荧光强度,Au和As分别表示样品和标准物质对该波长激发光的吸光度。由表1中结果可知,随着反应时间的延长,CdTe量子点的粒径逐渐变大,吸收峰和发射峰随着粒径的增大逐渐红移,颜色由绿到黄、红色,半峰宽(FWHW)逐渐增大。
2.2 细胞色素c对CdTe量子点的荧光猝灭效应及其机理
2.2.1 Cyt c对不同粒径CdTe量子点荧光的猝灭效应
由图3可知,在加入Cyt c之前,不同粒径的A、B、C三种CdTe量子点在350nm光激发下,其荧光发射峰分别位于514、546、601nm。随着体系中Cyt c的浓度逐渐升高,三种量子点的荧光强度都持续下降。当体系中Cyt c浓度达到1.8×10-7mol/L时,A、B、C三种量子点的荧光强度分别下降了64%、53%、47%,表明Cyt c对量子点的荧光猝灭效应随着量子点粒径的减小而增强。当Cyt c浓度在0~3.0×10-7mol/L范围内时,量子点的荧光猝灭强度F0/F(F0为量子点的初始荧光强度,F为加入Cyt c后量子点的荧光强度)与Cyt c的浓度成线性关系(见图4C,其中的直线为绿色量子点的情形,黄色和红色量子点的F0/F-[Cyt c]图与之类似)。同时,发射峰位都发生了微小的蓝移,分别从514nm移至512nm、546nm移至541nm、601nm移至599nm。量子点荧光的显著猝灭和发射峰位置的微小蓝移,表明二者之间发生了较强烈的作用。
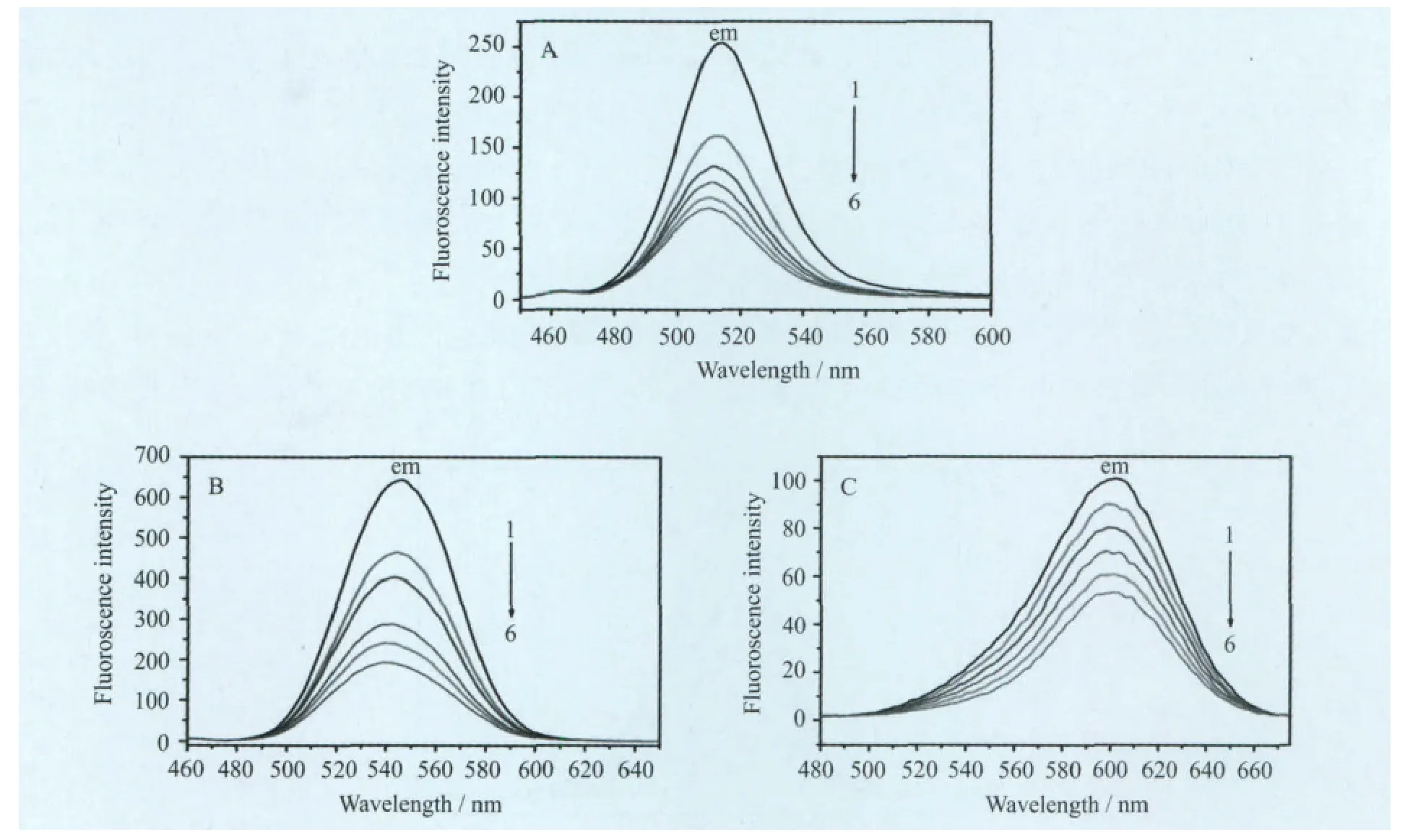
图3 Cyt c对不同粒径的绿(A)、黄(B)、红(C)CdTe量子点的荧光猝灭效应Cyt c的浓度[Cyt c]1~ 6:0,6,9,12,15,18(×10-8 mol/L)。[CdTe QDs]=1.2×10-6 mol/L,pH = 7.4,λex=350nm
根据量子点的基本性质,对上述现象可作以下解释:
1)从量子点的表面效应角度理解。随着量子点粒径的减小,其表面原子迅速增加,导致原子配位不足和高的表面能。具有悬挂键的表面原子会引入表面态,具有高的活性,极易与其他原子结合。所以,粒径较小的绿色量子点与Cyt c的表面结合作用较强。同时,处于激发态的载流子极易以非辐射跃迁方式弛豫到表面态。因此,以表面态为桥梁,受激电子被表面所结合的Cyt c捕获的几率大为提高,表现为较强的荧光猝灭效应。与绿色量子点相比,黄、红色量子点的粒径较大,表面能较低,处于表面态的原子数较少,一方面导致Cyt c与量子点的表面结合作用较弱,另一方面弛豫到表面态原子的受激电子数较少,因而使Cyt c

式中Eg为体相带隙,R为量子点半径,μ为电子和空穴的折合质量,ε2为体相介电常数。一般地,当R小于激子波尔半径时,1/R2项(动能项)的贡献大于1/R项(库伦项),E(R)随R的减小而增大,粒子显示出较强的量子限域效应。表面极化项(small polarization term)通常较小。根据公式(3),随着量子点半径R的减小,最低激发能E(R)增大,处于导带的受激电子的动能增大,被结合于捕获受激电子的几率降低,表现为较弱的荧光猝灭效应。
2)从量子点的量子限域效应角度理解。量子限域效应可用有效质量近似理论来定量描述。量子点的最低激发能E(R)可表示为[26]:量子点表面的Cyt c捕获的几率提高。
2.2.2 Cyt c对CdTe量子点和 CdTe/CdS核壳量子点的荧光猝灭效应比较及机理

图4 Cyt c对绿色CdTe量子点 (A)和绿色CdTe/CdS核壳量子点 (B)的荧光猝灭效应(C)Cyt c猝灭CdTe量子点和CdTe/CdS核壳量子点荧光的Stern-Volmer图
由图4A和4B可知,在350nm光激发下,随着浓度的增加,Cyt c对绿色CdTe量子点和CdTe/CdS核壳量子点都有显著荧光猝灭作用。当加入Cyt c浓度为1.35×10-7mol/L时,绿色CdTe量子点的荧光强度由254降低到132,降低了48%,而绿色CdTe/CdS核壳量子点其荧光强度由648降低到241,降低了63%。同时,发射峰位从514nm略微蓝移至512nm。由图4C可知,当Cyt c的浓度大于1.0×10-7mol/L 时,其对CdTe/CdS核壳量子点的猝灭效应强于CdTe量子点。
细胞色素c的等电点为9.79,在pH值为7.4的Tris-HCl缓冲溶液中,细胞色素c带正电,易与带负电的量子点结合。荧光猝灭机理可以描述为光诱导的电子传递过程。光照射下,量子点内的电子受激发由价带跃迁到导带。结合于量子点表面的Cyt c(Ⅲ)可以直接截获受激电子转变为Cytc(Ⅱ),从而阻止了受激电子与量子点内空穴的辐射复合,使量子点的荧光猝灭。
荧光猝灭的可能机理如下:
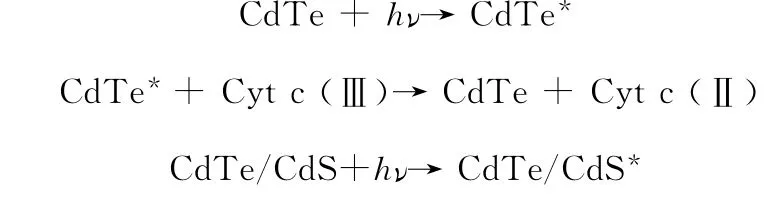
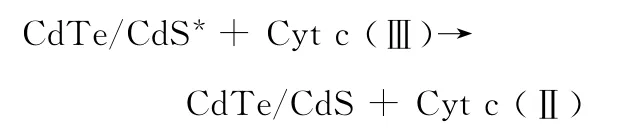
两种量子点的荧光猝灭效果之所以不同,是因为两种量子点的结构不同所导致的电子结构的差异。当CdTe外加CdS壳后,具有较大带隙的CdS壳对CdTe核的电子结构会产生一定的微扰,由于二者的最低未占据分子轨道(LUMOs)的能量较为接近,因此可以充分交叠融合,从而使核壳结构的LUMOs可以在整个量子点内离域;而二者的最高占据分子轨道(HOMOs)的能量相差较大,较少交叠,因此核壳结构的HOMOs是类似于核的HOMOs并定域于核。其结果是核壳结构的第一激发态的电子与空穴的复合将主要发生于核内。由于空穴被限域于核,而受激电子可在整个核壳结构中离域,从而使受激电子与空穴在量子点表面复合的几率大为降低,相应地,受激电子在量子点表面被Cyt c捕获的几率则大为提高。因此,光诱导的电子转移对于核壳结构的量子点而言更容易发生。基于以上推断,可利用粒径较小的绿色CdTe/CdS核壳量子点作为荧光探针定量检测细胞色素c。
2.3 CdTe量子点对牛血清白蛋白的荧光猝灭效应及其机理
研究了CdTe量子点对BSA荧光的猝灭效应(图5A)。以280nm的光激发BSA,其荧光发射峰位于343nm。随着CdTe量子点浓度的增加,BSA的荧光强度不断降低,表明CdTe量子点可以显著猝灭BSA的荧光。
根据校正的Stern–Volmer方程[27],

其中,F0为未加量子点时的荧光强度,F为加入不同浓度量子点后的荧光强度,K为荧光猝灭常数,[Q]为猝灭剂浓度,fa为BSA中荧光猝灭分数。作图(见图5B),直线的截距为斜率为由此可求出不同温度下CdTe量子点对BSA的猝灭常数K(见表2)。

表2 CdTe量子点对BSA的猝灭常数Quenching constants of BSA by CdTe QDs
由图5B和表2可知,量子点对BSA的荧光有较强的猝灭作用。猝灭常数随着温度的升高逐渐减小,且在0~2.4×10-6mol/L范围内,BSA的荧光猝灭强度与量子点的浓度成线性关系。荧光猝灭可由静态猝灭过程或动态猝灭过程引起,两种猝灭过程有着不同的温度依赖性:温度升高,静态结合物稳定性降低,导致结合常数降低,而动态猝灭则随温度上升,分子热运动增加,结合常数增加。因此,CdTe量子点对BSA的荧光猝灭属静态猝灭过程。
图5C利用圆二色谱考察了BSA结合CdTe量子点前后的溶液构象变化。在pH值为7.4的溶液中,游离BSA的CD谱显示出蛋白α-螺旋结构的特征谱带,即在UV区208nm和222nm处出现特征的负谱带。CdTe量子点的结合则导致BSA所有波长的负椭偏率的减少以及峰位的些微移动,表明CdTe量子点诱导下BSA的α-螺旋含量有所下降。类似地,有文献报道[23]porphyrin同人血清白蛋白的结合可导致蛋白的α-螺旋含量的减小。本研究中,依据CdTe量子点所导致的蛋白α-螺旋含量的减少,我们推测CdTe量子点的结合可使BSA的二级结构发生一定程度的松散,增大了BSA内疏水性色氨酸荧光团的溶剂暴露程度,从而猝灭了BSA的荧光。
2.4 BSA对CdTe量子点的荧光增强效应
研究了BSA对CdTe量子点荧光的增强效应(图6)。以350nm的光激发浓度为4.0×10-7mol/L的绿色CdTe量子点,其荧光发射峰位于514nm。随着CdTe量子点体系中BSA浓度的增加,量子点的荧光强度逐渐增强至初始强度的约2倍。这可能是由于BSA与量子点表面原子发生配位等作用,减少了量子点的表面缺陷,从而增强了量子点的荧光发射强度。

图5 (A)CdTe量子点对BSA (3.0×10-6 mol/L)的荧光猝灭效应:25℃,pH=7.4,λex=280nm,[QDs]1~17:0,0.3 ,0.9,1.35,2.25,3.0,4.5,6.0,7.5,9.0,10.5,12.0,13.5,15.0,16.5,19.5,24.0(×10-7 mol/L);(B)20℃、25℃和30℃时CdTe量子点猝灭BSA荧光的校正的Stern-Volmer图;(C)QDs与BSA相互作用的圆二色谱:25℃,pH=7.4,(1)5.0×10-6 mol/L BSA,(2)5.0×10-6 mol/L BSA+4.0×10-8 mol/L QDs,(3)5.0×10-6 mol/L BSA +2.0×10-7 mol/L QDs
3 结论
本文利用水热法合成了不同粒径的NAC稳定的CdTe量子点及核壳结构CdTe/CdS量子点,分别研究了细胞色素c对CdTe量子点及CdTe/CdS核壳量子点荧光的猝灭效应和CdTe量子点对牛血清白蛋白荧光的猝灭效应。研究表明,细胞色素c通过受激电子表面传递机理,对粒径较小或具有核壳结构的CdTe量子点具有较强的荧光猝灭能力。CdTe量子点通过松散BSA的螺旋结构,使BSA的疏水性色氨酸荧光团的溶剂暴露程度增大,从而猝灭其荧光。同时,BSA与CdTe量子点的表面原子发生配位等作用,可减少CdTe量子点的表面缺陷,从而增强CdTe量子点的荧光发射强度。
[1] Chan W C,Nie S.Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J].Science,1998,281(5385):2016-2018.
[2] Bruchez M,Moronne M,Gin P,et al.Semiconductor nanocrystals as fluorescent biological labels[J].Science,1998,281(5385):2013-2016.
[3] Michalet X,Pinaud F F,Bentolila L A,et al.Quantum dots for live cells,in vivo imaging and diagnostics[J].Science,2005,307(5709):538-544.
[4] Zhang C Y,Yeh H C,Kuroki M T,et al.Single-quantumdot-based DNA nanosensor[J].Nature Materials,2005,4(11):826-831.
[5] Klostranec J M,Chan W C.Quantum dots in biological and biomedical research:recent progress and present challenges[J].Advanced Materials,2006,18(15):1953-1964.
[6] Somers R C,Bawendi M G,Nocera D G.CdSe nanocrystal based chem-/bio-sensors[J].Chemical Society Review,2007,36(4):579-591.
[7] Zhou D J,Ying L M,Hong X,et al.A compact functional quantum dot-DNA conjugate:preparation,hybridization,and specific label-free DNA detection[J].Langmuir,2008,24(5):1659-1664.
[8] Medintz I L,Mattoussi H.Quantum dot-based resonance energy transfer and its growing application in biology[J].Physical Chemistry Chemical Physics,2009,11(1):17-45.
[9] Prasuhn D E,Blanco-Canosa J B,Vora G J,et al.Combi-ning chemoselective ligation with polyhistidine-driven selfassembly for the modular display of biomolecules on quantum dots[J].ACS Nano,2010,4(1):267-278.
[10] Jhonsi M A,Kathiravan A,Renganathan R.Spectroscopic studies on the interaction of colloidal capped CdS nanoparticles with bovine serum albumin[J].Colloid and Surface B:Biointerfaces,2009,72(2):167-172.
[11] Xiao Q,Huang S,Qi Z D,et al.Conformation,thermodynamics and stoichiometry of HSA adsorbed to colloidal CdSe/ZnS quantum dots[J].Biochimica et Biophysica Acta -Proteins and Proteomics,2008,1784(7-8):1020-1027.
[12] Shao L W,Dong C Q,Ren J C,et al.Using capillary electrophoresis mobility shift assay to study the interaction of CdTe quantum dots with bovine serum albumin[J].Chinese Chemical Letters,2008,19(6):707-710.
[13] Shao L W,Dong C Q,Ren J C,et al.Studies on interaction of CdTe quantum dots with bovine serum albumin using fluorescence correlation spectroscopy[J].Journal of Fluorescence,2009,19(1):15l-157.
[14] Ma Y,Bai H,Yang X,et al.A sensitive method for the detection of proteins by high-efficiency fluorescence quenching[J].The Analyst,2005,130(3):283-285.
[15] Larsen R W,Omdal D,Jasuja H R,et al.Conformational modulation of electron transfer within electrostatic porphyrin cytochrome c complexes[J].Journal of Physical Chemistry B,1997,101(40):8012-8020.
[16] Croney J C,Helms M K,Jameson D M,et al.Temperature dependence of photoinduced electron transfer within self-assembled uroporphyrin-cytochrome c complexes[J].Journal of Physical Chemistry B,2000,104(5):973-977.
[17] Clark-Ferris K K,Fischer J.Topographical mimicry of the enzyme binding domain of cytochrome c[J].Journal of American Chemical Society,1985,107(17):5007-5008.
[18] Cesar A T L,Sivia M B C,David P,et al.Electron-transfer kinetics in sulfonated aluminum phthalocyanines/cytochrome c complexes[J].Journal of Physical Chemistry B,2004,108(22):7506-7514.
[19] Yamasaki K,Maruyama T,Kragh-Hansen U,et al.Characterization of site on human serum albumin:concept about the structure of a drug binding site[J].Biochimica et Biophysica Acta,1996,1295(2):147-157.
[20] Dockal M,Carter D C,Ruker F.Conformational transitions of the three recombinant domains of human serum al-bumin depending on pH[J].Journal of Biological Chemistry,2000,275(5):3042-3050.
[21] Hu Y,Liu Y,Zhao R,et al.Spectroscopic studies on the interaction between methylene blue and bovine serum albumin[J].Journal of Photochemistry and Photobiology A:Chemistry,2006,179(3):324-329.
[22] Zhou B,Qi Z D,Xiao Q,et al.Interaction of loratadine with serum albumins studied by fluorescence quenching method[J].Journal of Biochemical and Biophysical Methods,2007,70(5):743-747.
[23] Zhao D,He Z,Chan W H,et al.Synthesis and characterization of high-quality water-soluble near-infrared-emitting CdTe/CdS quantum dots capped by N-Acetyl-L-cysteine via hydrothermal method[J].Journal of Physical Chemistry C,2009,113(4):1293-1300.
[24] Yu W W,Qu L,Guo W,et al.Experimental determination of the extinction coefficient of CdTe,CdSe,and CdS nanocrystals[J].Chemical Materials,2003,15(14):2854-2860.
[25] Crosby G A,Demas J N.Measurement of photoluminescence quantum yields[J].Journal of Physical Chemistry,1971,75(8):991-1024.
[26] 吴晓春,陈文驹.半导体量子点电子结构理论研究的进展[J].物理,1995,24(4):218-223.Wu X C,Chen W J.Progress of the electronic structure theory of semiconductor quantum dots[J].Physics,1995,24(4):218-223.
[27] Lakowicz J R.Principles of Fluorescence Spectroscopy[M].Second Edition.New York:Springer,1999.248-249.
