香青兰总黄酮在大鼠体内的药代动力学研究
2014-01-02袁勇邢建国王立萍姚佳茗王新春
袁勇,邢建国,王立萍,姚佳茗,王新春,
(1石河子大学医学院第一附属医院,石河子 832002;2新疆维吾尔自治区药物研究所,乌鲁木齐 830004;3石河子大学药学院,石河子 832002)
香青兰Dracocephalum moldevica L.为唇形科青兰属植物,又名巴迪然吉布亚,味甘、苦,性凉,归肝、脾经,有泻火、清热、止血的功能,香青兰药理作用广泛,尤其对冠心病、高血压、动脉粥样硬化等心血管疾病具有较好的疗效[1-2]。香青兰主要含有挥发油、萜类、黄酮类、氨基酸、微量元素等多种化学成分,其中,黄酮类成分是其发挥药理作用的主要活性成分[3-4]。目前,香青兰总黄酮在大鼠体内的药动学研究还未见报道,因此,本研究以主要成分田蓟苷为指标,建立了测定大鼠血浆中田蓟苷浓度的高效液相色谱方法,测定大鼠灌胃给予香青兰总黄酮提取物后田蓟苷的血药浓度,研究香青兰总黄酮在大鼠体内的药代动力学特征,为其合理开发和应用提供药动学依据。
1 材料
1.1 仪器
LC-10AT高效液相色谱仪(日本岛津);超声波发生器(美国科学系统公司);CT-64电子分析天平(奥豪斯国际贸易有限公司);TGL-16C高速离心机(上海安亭科学仪器厂)。
1.2 试药
香青兰总黄酮提取物 (石河子大学实验室自制,批号20080310,总黄酮含量为57%);田蓟苷对照品 (新疆自治区药物研究所提供,经1H NMR、13C NMR 、MS、IR等方法鉴定结构。经HPLC测定,纯度大于 98%);PEG400(北京化学试剂公司);乙腈(天津市福晨化学试剂厂);水为重蒸水;其余试剂均为分析纯。
1.3 实验动物
实验动物SD大鼠,清洁Ⅱ级,体重(250~280)g,雌雄各半,由新疆医科大学实验动物中心提供,合格证号:新医动字第2003-0001号。
2 方法与结果
2.1 色谱条件
流动相: 乙腈-0.4%磷酸水 (34∶66); 色谱柱:AgilentC18(4.6×250 mm,5 μm);流速:1.0 mL/min;柱温:35℃;进样量:20 μL;检测波长 327 nm。
2.2 溶液的配制
2.2.1 对照品储备液的配制
精密称取田蓟苷对照品5 mg置于10 mL容量瓶,乙腈定容,作为田蓟苷的储备液。
2.2.2 口服给药供试液的配制
分别精密称取香青兰总黄酮提取物及CMC-Na适量放入研钵中,再加入适量超纯水,边加水边搅拌至CMC-Na为0.5%,继续研磨至香青兰总黄酮提取物粉末成悬浮状态即可。
2.3 血浆样品的处理[5]
精密吸取血浆样品200 μL,加入2 mL乙腈,涡旋3 min,然后置离心机中,12000 r/min离心10 min。分离有机层,N2吹干,残渣用100 μL乙腈复溶,离心,上样测定。
2.4 方法学验证
2.4.1 专属性试验
分别取空白血浆、加田蓟苷对照品的空白血浆、给药后的血浆样品,按2.3项下方法处理后,在上述色谱条件下各进样20 μL。色谱图见图1,结果表明,在本试验条件下,血浆中内源性物质不干扰样品的测定。
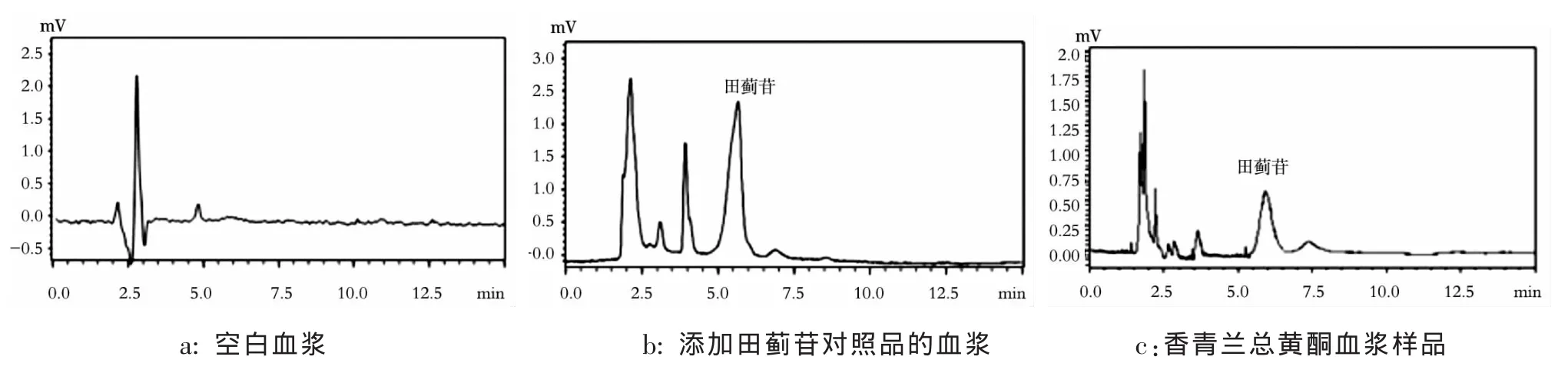
图1 田蓟苷血浆样品的HPLC图Fig.1 Chromatograms of Tilianin in plasma by HPLC
2.4.2 线性关系考察
精密吸取田蓟苷对照品储备液适量置于200 μL空白血浆中,按倍数稀释法配制田蓟苷浓度为0.031,0.124,0.248,1.984,3.968,19.840,39.680 μg/mL的血浆样品,按2.3项下处理。HPLC分析测定,以血浆中田蓟苷浓度对峰面积进行加权(1/X2)最小二乘法回归,得血浆中田蓟苷的标准曲线为:Y=34317.354X+1772.737,r=0.9990 (n=5), 线性范围0.031-39.68 μg/mL,定量限为 0.031 μg/mL。
2.4.3 准确度与精密度
按标准曲线项下方法,分别吸取不同体积的田蓟苷对照品溶液加入200 μL空白血浆中,得高、中、低 3 个浓度(39.680,3.968,0.031 μg/mL)的血浆样品,每个浓度制备5份,按2.3项下血浆样品处理方法处理后进样分析,计算本法的回收率和精密度。结果田蓟苷日内、日间精密度RSD均<10%,回收率为98.01%~103.23%,分别见表1和表2。
表1 田蓟苷血浆样品精密度 ±S,n=5Tab.1 The precision of tilianin in plasma
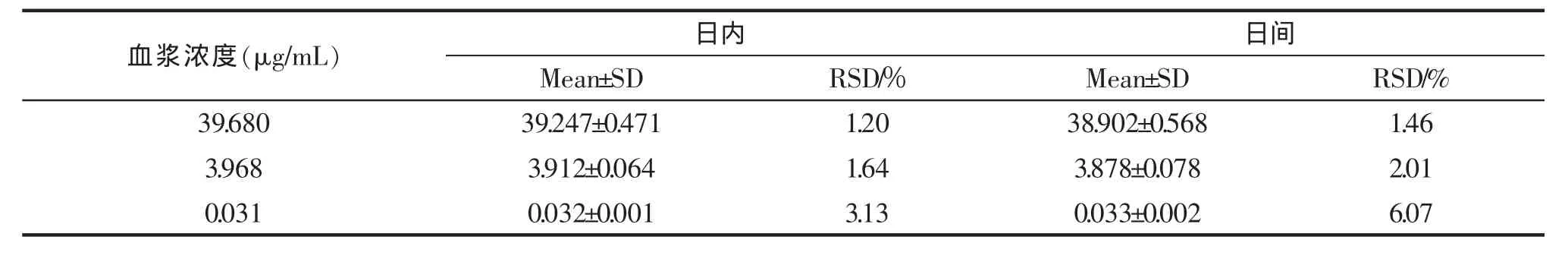
表1 田蓟苷血浆样品精密度 ±S,n=5Tab.1 The precision of tilianin in plasma
血浆浓度(μg/mL) Mean±SD RSD/% Mean±SD RSD/%日内 日间39.680 39.247±0.471 1.20 38.902±0.568 1.46 3.968 3.912±0.064 1.64 3.878±0.078 2.01 0.031 0.032±0.001 3.13 0.033±0.002 6.07
表2 田蓟苷血浆样品回收率Tab.2 The recovery of tilianin in plasma ±S,n=5
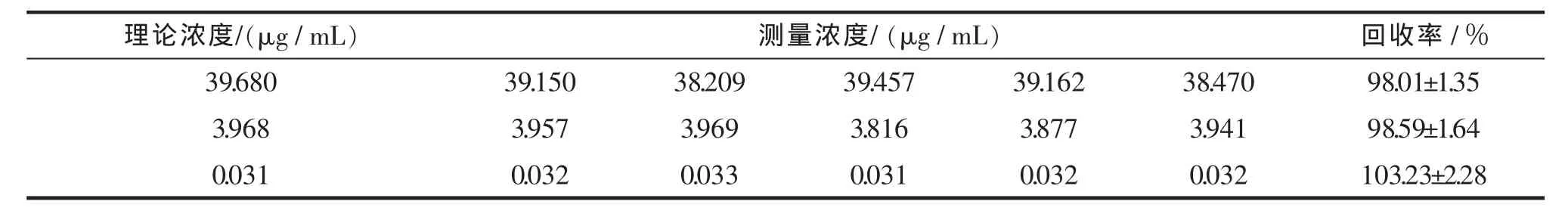
表2 田蓟苷血浆样品回收率Tab.2 The recovery of tilianin in plasma ±S,n=5
理论浓度/(μg/mL) 测量浓度/(μg/mL) 回收率/%39.680 39.150 38.209 39.457 39.162 38.470 98.01±1.35 3.968 3.957 3.969 3.816 3.877 3.941 98.59±1.64 0.031 0.032 0.033 0.031 0.032 0.032 103.23±2.28
2.4.4 提取回收率试验
配制高、中、低3个浓度的血浆样品,按2.3项下血浆样品处理方法处理后经HPLC测定,测得提取回收率在72.67%~90.35%之间,结果见表3。
表3 田蓟苷血浆样品提取回收率 ±S,n=5Tab.3 The extraction recovery of tilianin in plasma
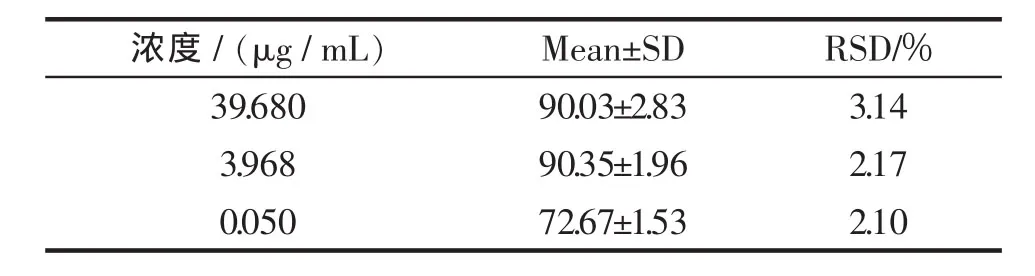
表3 田蓟苷血浆样品提取回收率 ±S,n=5Tab.3 The extraction recovery of tilianin in plasma
浓度 /(μg/mL)39.680 3.968 0.050 Mean±SD RSD/%90.03±2.83 3.14 90.35±1.96 2.17 72.67±1.53 2.10
2.5 大鼠体内药动学研究
2.5.1 样本的采集[6-7]
取SD大鼠24只,雌雄各半,随机分成4组,每组6只,禁食12 h(自由饮水)。前3组以高、中、低3个剂量(1200,600,300 mg/kg)灌胃香青兰总黄酮提取物,给药后 0.083,0.167,0.250,0.417,0.750,1,2,3,5,7,9 h 眼眶采血 0.5 mL,离心,分离血浆,-20℃保存待用。大鼠口服给药后,香青兰总黄酮中田蓟苷的药动学参数见表4,药时曲线见图2。
表4 大鼠灌胃香青兰总黄酮提取物后田蓟苷的药代动力学参数Tab.4 Pharmacokinetic parameters of Tilianin after oral administration of TFDM ±S,n=6
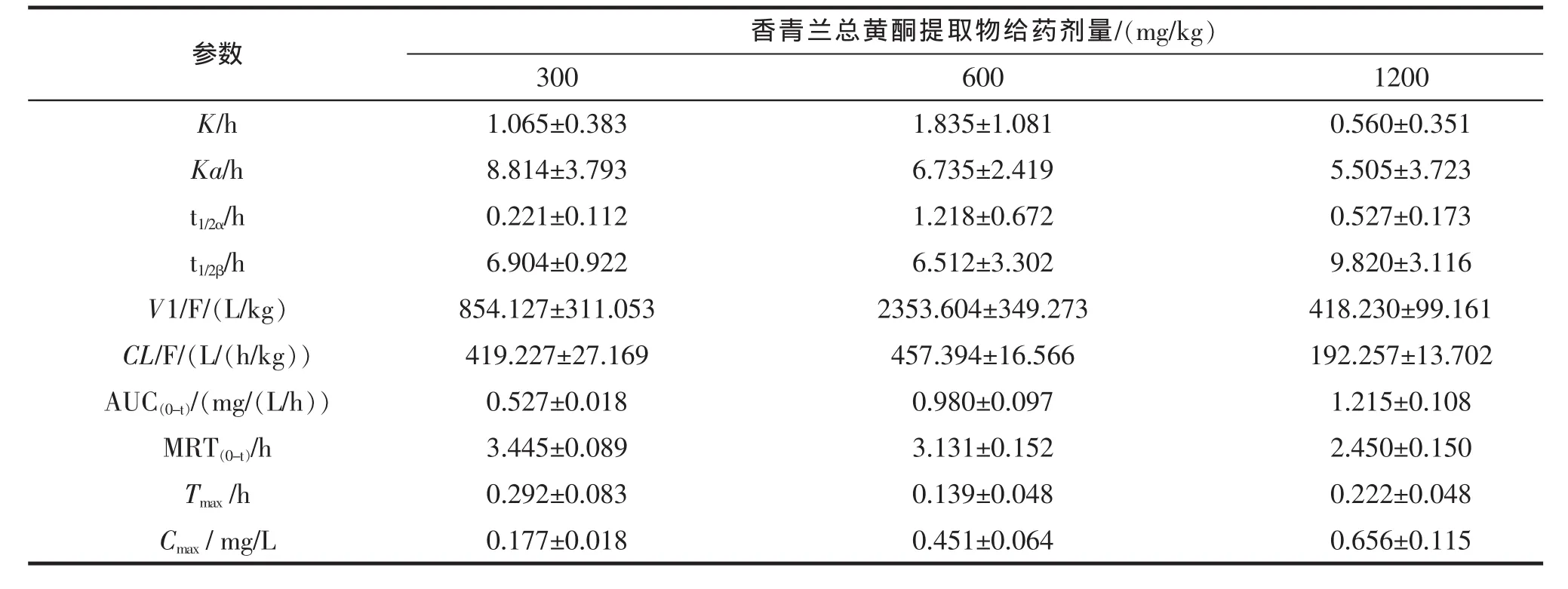
表4 大鼠灌胃香青兰总黄酮提取物后田蓟苷的药代动力学参数Tab.4 Pharmacokinetic parameters of Tilianin after oral administration of TFDM ±S,n=6
香青兰总黄酮提取物给药剂量/(mg/kg)300 600 1200 K/h 1.065±0.383 1.835±1.081 0.560±0.351 Ka/h 8.814±3.793 6.735±2.419 5.505±3.723 t1/2α/h 0.221±0.112 1.218±0.672 0.527±0.173 t1/2β/h 6.904±0.922 6.512±3.302 9.820±3.116参数V1/F/(L/kg) 854.127±311.053 2353.604±349.273 418.230±99.161 CL/F/(L/(h/kg)) 419.227±27.169 457.394±16.566 192.257±13.702 AUC(0-t)/(mg/(L/h)) 0.527±0.018 0.980±0.097 1.215±0.108 MRT(0-t)/h 3.445±0.089 3.131±0.152 2.450±0.150 T max/h 0.292±0.083 0.139±0.048 0.222±0.048 C max/mg/L 0.177±0.018 0.451±0.064 0.656±0.115
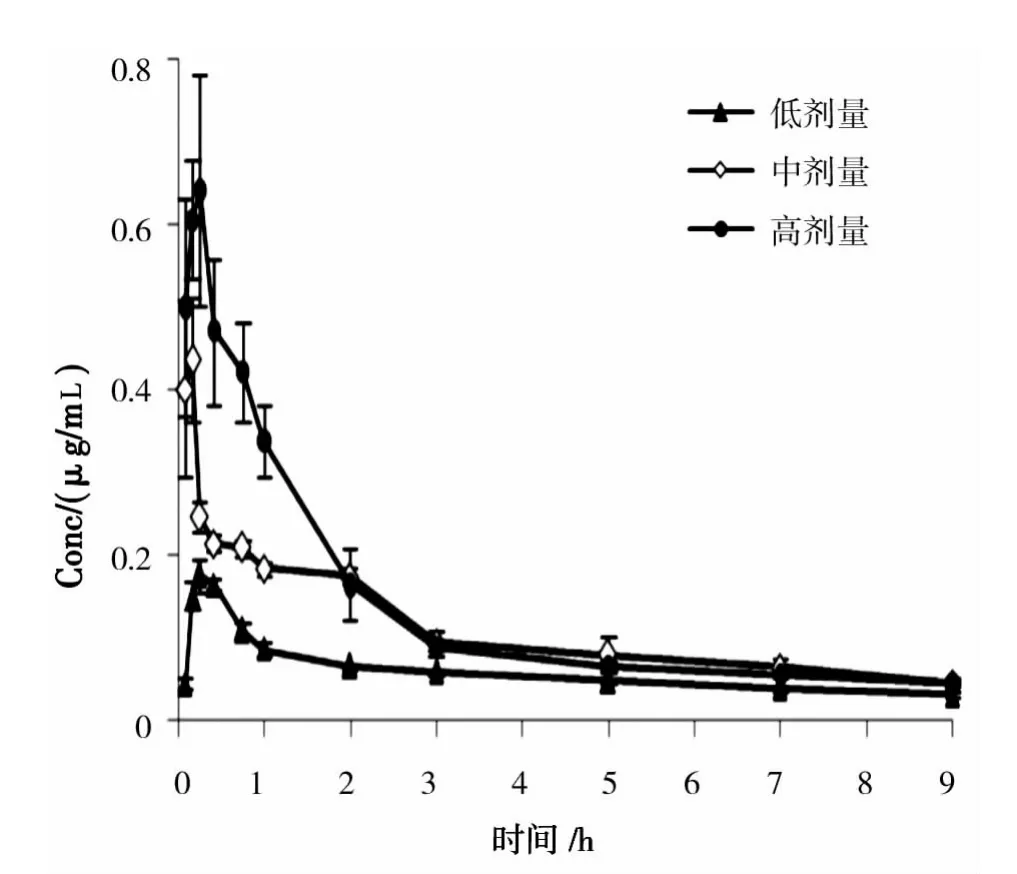
图2 大鼠灌胃香青兰总黄酮提取物后田蓟苷的药-时曲线Fig.2 The plasma concentration-time courses of Tilianin after oral administration of TFDM
3 讨论
本实验结果显示大鼠灌胃香青兰总黄酮后田蓟苷的药代动力学过程符合二室模型。口服吸收较迅速,Tmax为8-22 min,提示其在胃和小肠上部即被吸收。分布相半衰期t1/2α仅在0.218-1.218 h,说明其从中央室向周边室分布较快。在各给药剂量下K12均大于相应的K21,表明从中央室向周边室的转运速率大于药物从周边室向中央室的速率。
香青兰总黄酮由低剂量增加至中剂量时,大鼠血浆中田蓟苷的AUC(0-t)和Cmax逐渐增加,总消除速率常数K,清除率CL/F和消除相半衰期t1/2β无显著性变化,呈线性动力学特征。但当由中剂量增至高剂量时,AUC(0-t)和 Cmax增加较慢,K 和 CL/F 明显减少,t1/2β显著延长(P<0.05),药动学呈非线性动力学特征。这可能是由于香青兰总黄酮在体内涉及容量限制过程,当给药剂量及产生的血药浓度超过一定限度时,体内酶的催化能力和载体转运能力达到饱和,药动学呈现明显的剂量依赖。前期Caco-2细胞摄取实验结果表明田蓟苷是Na+依赖葡萄糖转运载体 1(SGLT1)和 P-糖蛋白(P-gp)的底物,这可能是其药动学呈非线性特征的重要原因[8]。
实验中还考察了高、中、低3个浓度的血浆样品在反复冻融3次、-20℃冷藏6 d和室温放置6 h条件下的稳定性,结果田蓟苷在各条件下均无显著浓度变化,说明样品在测定条件下是稳定的。
[1]曹文疆,王新春,邢建国,等.香青兰总黄酮对TNF-α诱导的大鼠血管平滑肌细胞增殖的影响[J].中国实验方剂学杂志,2011,17(21):159-161.
[2]杨彩玉,安希文,付伟,等.香青兰总黄酮对大鼠离体胸主动脉的舒张作用[J].生物物理学报,2010,26(4):334-340.
[3]杨丽娜,邢建国,何承辉,等.维药香青兰的化学成分与药理作用评价[J].世界临床药物,2013,34(4):226-231.
[4]冯长根,李琼.香青兰化学成分研究[J].中成药,2006,28(1):94-98.
[5]覃禹,仇峰,韦日伟,等.中药多组分药代动力学的研究进展[J].解放军药学学报,2011,27(6):548-552.
[6]王桂红,刘丹,吴杰,等.霉茶总黄酮在大鼠体内的药代动力学[J].时珍国医国药,2009,20(11):2882-2883.
[7]冯亮,蒋学华.三七总皂苷在大鼠体内的药物动力学研究[J].华西药学杂志,2010,25(1):46-49.
[8]黄志巧,邢建国,王新春,等.田蓟苷在Caco-2细胞模型中的吸收特性研究[J].中国中药杂志,2012,37(9):1315-1318.
