毕赤酵母表达Neuritin蛋白的纯化及鉴定
2014-01-02张云华朱井玲熊安英单莉娅朱美意郑艳郝慧星黄瑾
张云华,朱井玲,熊安英,单莉娅,朱美意,郑艳,郝慧星,黄瑾
(新疆地方与民族高发病教育部重点实验室/石河子大学医学院生物化学教研室,石河子 832002)
神经系统病变和损伤的治疗一直是困扰医学界的难题,目前临床上多用以神经营养因子为主的药物治理。神经营养因子是一类能够促进神经细胞存活、生长和分化的多肽或蛋白质,可以为神经再生提供良好的微环境,在防止神经细胞的退变和促进神经突起的生长等方面起着十分重要的作用[1-3]。因此关于神经营养因子神经再生和防止神经元退行性变的应用研究一直是研究领域中的热点。Neuritin是一种与神经可塑性相关的营养因子,1993年Nedivi等[4]在谷氨酸类似物红藻氨酸盐的诱导下从大鼠海马齿状回筛选到CPG15(candidate plasticity-related gene15)。1997年对CPG15研究显示,CPG15能够促进神经突起的快速生长,故将其命名为 Neuritin[5]。
Neuritin在胚胎发育期可维持神经元存活、抑制凋亡[6],调节神经祖细胞分化、移行和突触成熟[7];在成年期,能促进突起的生长[5],调节突触回路的形成[8],还介导了学习和记忆的突触重塑过程,可能是BDNF控制的突触可塑性和记忆巩固的效应器[9],另外它是一类新发现的血管生长因子,并作为潜在的癌症治疗靶点[10]。为获得大量Neuritin基因工程产物以进行生物学功能的研究,本实验利用前期构建重组GSll5/pPIC9K-Neuritin毕赤酵母工程菌,诱导表达重组的Neuritin蛋白并进行纯化和鉴定。
1 材料与方法
1.1 材料
1.1.1 菌株GS115/pPIC9K-Neuritin由本实验室构建并保存。
1.1.2 仪器与试剂AKTA purifier蛋白纯化系统购自GE公司;His-Trap Crud亲和层析预装柱购自GE公司;电泳仪购自BIO-RAD公司;离心超滤管购自Millipore公司。
酵母提取物和胰蛋白胨购自Oxide公司;酵母氮源(YNB)和 G418均购自 Invitrogen公司;YPD、BMGY和BMMY培养基配方见Invitrogen公司提供的毕赤酵母操作手册;NC膜购自Whatman公司;His抗体和羊抗鼠IgG-HRP购自Bio-Rad公司;化学发光试剂盒购置Pierce公司;透析袋购自spectrum labs公司;蛋白分子量marker购自Thermo公司;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 重组酵母菌的诱导表达挑取GSll5/pPIC9K-Neuritin工程菌的单克隆菌落,在YPD培养基中30℃ 220 r/min培养过夜。按照1∶50接种于1 L BMGY培养基,30℃ 220 r/min继续培养至OD600约4 h,5000 r/min离心 5 min, 弃上清,收集菌体重悬于1 L BMMY培养液中,加入终浓度为1%的甲醇。30℃ 220 r/min继续培养72 h,每隔24 h补加甲醇至终浓度为1%。
1.2.2 表达产物的盐析离心诱导表达的培养液14000 r/min 30 min 4℃,收集上清,用终浓度为65%的硫酸铵饱和沉淀,4℃过夜。过夜盐析后的溶液,14000 r/min 30 min 4℃离心沉淀。
1.2.3 亲和层析收集离心沉淀的蛋白,加start buffer溶解,0.22 μm滤器过滤,纯化过程参考GE Healthcare亲和层析纯化手册。其中start buffer(20 mmol/L sodium phosphate,0.5 mol/L NaCl,10 mmol/L imidazole,pH 7.4),elution buffer (20 mmol/L sodium phosphate,0.5mol/L NaCl,300 mmol/L imidazole,pH7.4), 采用线性梯度洗脱方 法,start buffer 和elution buffer分别以0%~100%的比例进柱,即咪唑浓度逐渐增加,分别收集蛋白流出液和洗脱蛋白液,并SDS-PAGE检测。
1.2.4 表达产物的SDS-PAGE鉴定
收集的蛋白行15%SDS-PAGE,恒压90V100min。电泳结束后考马斯亮蓝R-250染色。
1.2.5 Western-blot和生物质谱检测
1.2.5.1 Western-blot检测 蛋白经SDSPAGE后,23 V,45 min将蛋白转至硝酸纤维素膜(NC)上,膜以封闭液封闭过夜,加入1∶1000稀释的His抗体,37℃孵育4 h后,洗涤NC膜3次,辣根过氧化物酶标记的羊抗鼠IgG二抗(1:50000),37℃孵育2 h,洗涤NC膜3次,最后用ECL显色曝光。
1.2.5.2 生物质谱进行分子量和序列分析 纯化后的重组Neuritin蛋白制作冻干粉,MALDI-TOFMS由北京毅新兴业科技有限发展公司完成,获得Neuritin重组蛋白精确的分子量和肽质量指纹图谱(Peptide mass finger-priting,PMF)。应用 Mascot搜索引擎在蛋白质数据库中检索,结果的可靠性用序列覆盖率进行分析。
2 结果与分析
2.1 Neuritin蛋白的纯化结果
采用线性梯度洗脱,收集蛋白流出液和洗脱蛋白液(图 1)。
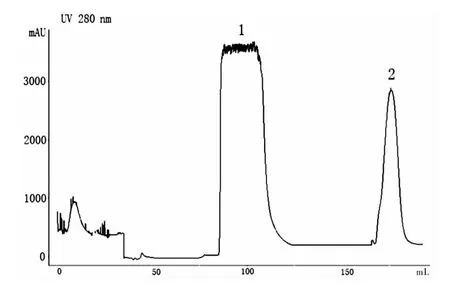
图1 Neuritin蛋白的亲和层析色谱图Fig.1 Affinity chromatography of Neuritin protein
SDS-PAGE检测所收集的蛋白(图2),分子量大约11 ku,与理论值(包括6个His插入序列,共计93个氨基酸,理论值11.16 ku)相符。
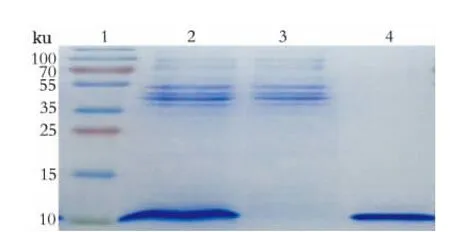
图2 15﹪SDS-PAGE分析纯化的融合蛋白Fig.2 SDS-PAGE analysis of identified Neuritin-His fusion protein
2.2 纯化后的Neuritin蛋白Western blot鉴定结果
纯化后的融合蛋白经SDS-PAGE分析后,利用His抗体对该蛋白行免疫印迹分析,由结果(图3)可见,有与His抗体特异结合的蛋白条带,分子量与理论值相符。

图3 表达产物的Western-blot鉴定结果Fig.3 Western-blot results of expression products of GS115/pPIC9K-neuritin
2.3 Neuritin重组蛋白的分子量测定结果
MALDI-TOF-MS测得的Neuritin重组蛋白的分子量结果见图4,横坐标显示质量电荷比(m/z),蛋白质分子离子化后通过质量分析器对其质量电荷比进行分析,结果得到样品的精确分子量为10965.6621 u。

图4 Neuritin重组蛋白的MALDI-TOF-MS分子质量质谱图Fig.4 Molecular mass spectrum of Neuritin recombination protein
2.4 Neuritin重组蛋白的肽指纹图谱测定结果分析
采用MALDI-TOF-MS,对酶解后的Neuritin重组蛋白肽段进行肽指纹图谱测定(图5)。
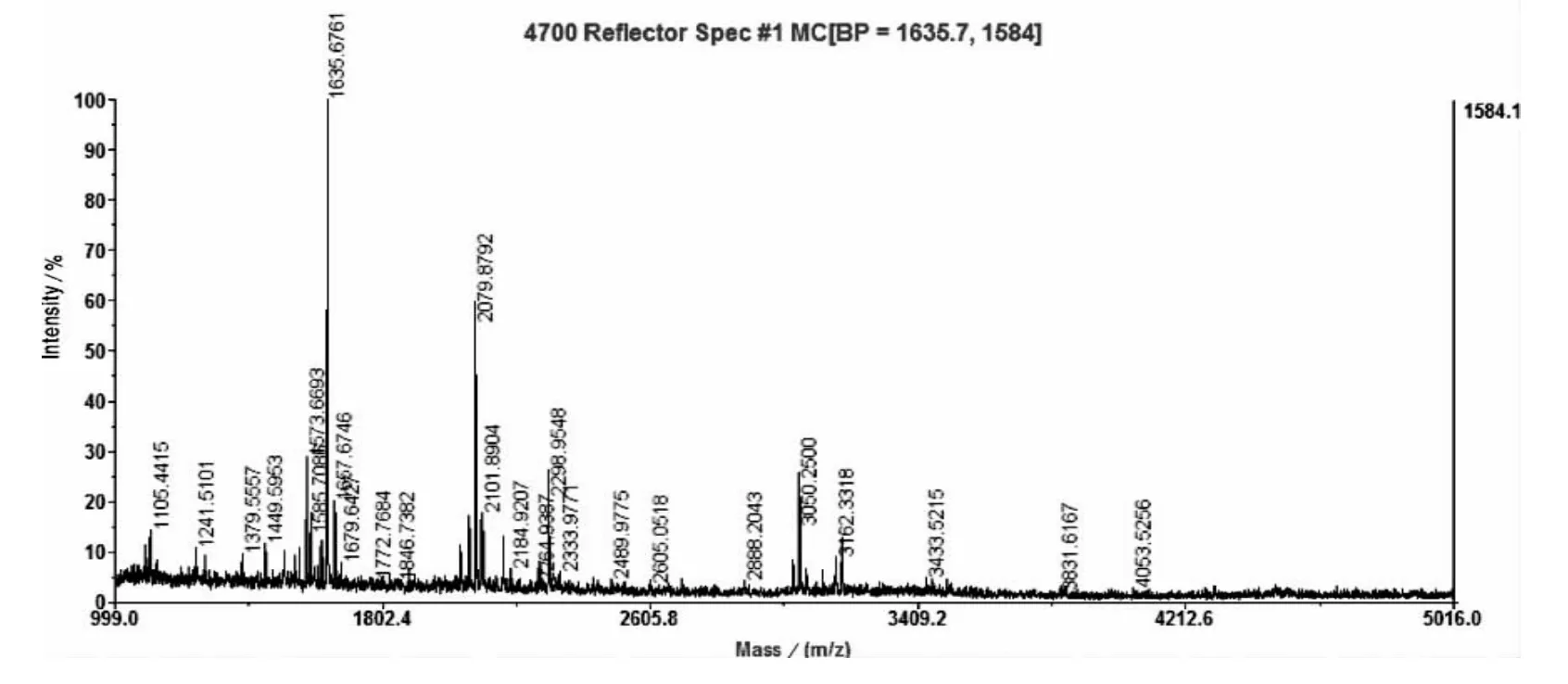
图5 Neuritin重组蛋白的MALDI-TOF-MS肽指纹图谱Fig.5 PMF of neuritin recombination protein
应用Mascot搜索引擎在SwissProt蛋白数据库 中输入Neuritin蛋白肽指纹图谱后检索肽段序列的覆盖率。红色标注为匹配片段(图6),其中HHHHHHAGK为蛋白第 1~9个氨基酸,LGDSMANYPQGLDDK为蛋白第 24~38个氨基酸,NLNIQGSLFELCGSG为蛋白第79~93个氨基酸,总覆盖率41.9%,提示纯化后的蛋白很可能是Neuritin重组蛋白。
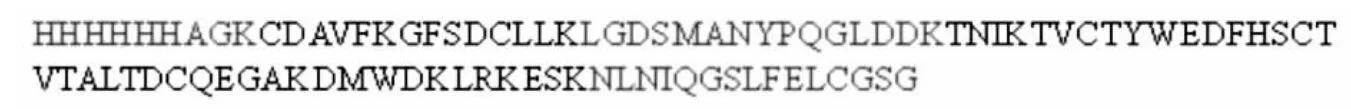
图6 应用SwissProt蛋白数据库检索PMFFig.6 Searcher for PMF in the SwissProt Databas
3 讨论
Neuritin是近年发现的神经营养因子,在研究和应用前景方面具有较明显的优势。首先,Neuritin能促进突起生长[5]、维持神经元存活[6]。其次,Neuritin为仅含一条肽链的蛋白质,可以利用基因工程方法制备人源性制品,克服了鼠源性神经营养因子无法避免的免疫原性弊端。第三,Neuritin基因工程产品可通过微生物发酵大量获取,利于研究及大规模应用。因此,开发Neuritin基因工程产品,有助于深入挖掘Neuritin功能,为神经损伤后的修复及再生奠定物质基础。
毕赤酵母表达系统是近年来发展很快的一个真核表达系统,非常适合于真核生物蛋白质的表达。由于该表达系统有很强的真核蛋白质修饰功能,重组蛋白能在菌体内得到正确折叠和糖基化修饰,因此广泛应用于基因工程产品的研制和开发。
本实验室构建的GSll5/pPIC9K-Neuritin毕赤酵母工程菌株中,Neuritin的N端插入6个组氨酸序列。6个组氨酸作为标签蛋白由于分子量小,一般不影响蛋白的折叠和干扰Neuritin蛋白的结构和功能;另外Ni2+与6×His融合蛋白的结合非常有效,因此允许融合蛋白Neuritin-His结合到Ni2+螯合表面上,操作简便快速,有利于蛋白的纯化并且在非变性条件下进行,保持了目的蛋白的生物学活性,纯化后的Neuritin蛋白可直接用于功能研究,所以本研究选用Ni2+螯合层析进行纯化。
氨基酸序列覆盖率分析发现,匹配的序列并不是很多,可能是Neuritin重组蛋白酶解后某些肽段的特征不明显,不能在数据库中检出。虽然测得的序列覆盖率可以说明纯化的蛋白很可能为Neuritin重组蛋白,但为了进一步确定其结构的准确性,我们将进行氨基酸序列测定。在目前的情况下,氨基酸全序列测定仍然比较困难,且费用昂贵,因此下一步决定通过EDMAN降解法测定纯化蛋白的N端和C端序列。
对Neuritin蛋白纯化的研究,可以得到较多较纯的Neuritin蛋白,为后续的关于神经方面的功能研究以及Neuritin蛋白的大规模纯化奠定基础,因此具有很好的意义。
[1]Bonnet D,Garcia M,Vecino E,et al.Brain-derived neurotrophic factor signalling in adult pig retinal ganglion cell neurite regeneration in vitro[J].Brain Research,2004,1007(12):142-151.
[2]Wirenfeldt M,Babcock A A,Ladeby R,et al.Reactive microgliosis engages distinct responses by microglial subpopulations after minor central nervous system injury[J].Neuroscience Research,2005,82(4):507-514.
[3]Lobner D,Ali C.Mechanisms of bFGF and NT-4 potentiation of necrotic neuronal death[J].Brain Research,2002,954(1):42-50.
[4]Nedive E,Hevroni D,Naot D,et al.Numerous candidate plasticity-related genes revealed by differential cDNA cloning[J].Nature,1993,363(24):718-722.
[5]Naeve G S,Ramakkrishnan M,Kramer R,et al.Neuritin:a gene induced by neural activity and neurotrophins that promotes neuritogenesis[J].Proc Natl Acad.Sci.USA Neurobiology,1997,94(6):2648-2653.
[6]Putz U,Harwell C,Nedivi E.Soluble CPG15 expressed during early development rescues cortical progenitors from apoptosis[J].Nature Neuroscience,2005,8(3):322-331
[7]Pahnke J,Mix E,Knoblich R,et al.Overexpression of glial cell line-derived neurotrophic factor induces genes regulating migration and differentiation of neuronal progenitor c ells[J].Experiment Cell Research,2004,297(2):484-494.
[8]Di Giovanni S,Faden A I,Yakovlev A,et al.Neuronal plasticity after spinal cord injury:identification of a gene cluster driving neurite outgrowth[J].The FASEB Journal,2005,19(1):153-154.
[9]Wibrand K,Messaoudi E,Havikel B,et al.Identification of genes co-upregulated with Arc during BDNF-induced long-term potentiation in adult rat dentate gyrus in vivo[J].European Journal of Neuroscience,2006,23(6):1501-1511.
[10]Han D,Qin B,Liu G,et al.Characterization of neuritin as a novel angiogenic factor[J].Biochemical and biophysical research communications,2011,415(4):608-612.
