新疆加工番茄品种抗早疫病测定及防治药剂筛选
2014-01-02李平王晓东张莉
李平,王晓东,张莉
(石河子大学农学院/新疆绿洲植保资源与农业病虫害治理与重点实验室,石河子 832003)
目前新疆加工番茄的种植面积约为7万hm2,是我国最大的加工番茄种植区域[1],但是随着新疆加工番茄种植面积扩大、特殊的栽培措施和生长特点、连片种植以及适于病害发生的气候条件[2],早疫病已成为新疆加工番茄最重要的病害之一,该病的发病率可达100%,产量损失10%~30%,因此有效控制早疫病是确保当前新疆加工番茄丰产、丰收的重要措施之一[3]。
目前,国内外对早疫病的防治主要集中在对抗病品种的筛选上,其次是化学药剂的防治。我国育成了一系列优良的番茄抗病品种,但是针对番茄抗早疫病的品种比较缺乏。到目前为止,虽然已有一些抗病或耐病品种的报道,但明确标明抗病的商品品种并不多见,而且具有高抗早疫病的番茄繁育品种和栽培品种就更未见报道[4]。近些年新疆加大了加工番茄的育种工作,目前生产上种植的品种有20余个,主要以常规种为主,主栽品种为里格尔87-5[5],还有新番系列、石番系列、石红系列、佳义系列等品种,这些加工番茄品种具有产量高,品质优良,适应性强等特点,但是对早疫病抗病性较差。因此本试验对北疆地区种植的主要加工番茄品种进行了田间抗性鉴定,同时对市场上和生产中防治加工番茄早疫病的杀菌剂进行筛选,旨在为新疆加工番茄早疫病的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试品种
供试品种有屯河17号、UC-82、里格尔87-5、早得、石红1号、石番98-1、硕源87-5、金红宝308、农康 87-5、日本 272、石番 28、日本 460、佳义 8号、石番15号、佳义6号。
1.1.2 供试药剂
75%百菌清WP(利民化工股份有限公司);70%甲基硫菌灵WP(山东澳得利化工有限公司);25%三唑酮WP(云大农化公司);15%络氨铜SC(上海沪联生物药业有限公司);250 g/L丙环唑SC(上海艾科思生物药业有限公司);10%苯醚甲环唑WP(山东澳得利化工有限公司);250 g/L嘧菌酯SC(美国先正达有限公司);70%代森锰锌WP(利民化工股份有限公司);1.8%辛菌胺醋酸盐SC(沁阳市新兴化工有限公司);25%乙嘧酚SC (正红股份有限公司);72%锰锌·霜脲氰WP(日本松井产业株式会社);58%甲霜锰锌WP(四川国光农化股份有限公司)。
1.2 方法
1.2.1 加工番茄品种抗早疫病测定
试验采用覆膜滴灌种植方式在石河子大学农学院试验田中进行,2013年4月13日播种,按常规的肥水进行管理,2013年7月底,在番茄早疫病进入自然发病高峰期,从试验地各品种小区随机抽取5个样点,每样点取3株,每株从上、中、下取2片复叶,共90片复叶,调查发病率和严重度,计算病情指数,评价供试品种对番茄早疫病的抗病性。
病情指数=∑(各级病叶数×相对级数值)/(调查叶片总数×最高病级数)×100%。
叶片病情分级记载标准。0级:无病斑;1级:病斑面积占羽状叶面积的0%~5%;2级:病斑面积占羽状叶面积的6%~10%;3级:病斑面积占羽状叶面积的11%~20%;4级:病斑面积占羽状叶面积的20%~50%;5级:病斑面积占羽状叶面积的50%以上。抗病性评价标准为[6]:免疫(I):病情指数为0;抗病(R):病情指数在 0.1~20;耐病(T):病情指数在20.1~40;感病(S):病情指数在 40.1~60;高感(HS):病情指数在60以上。
1.2.2 加工番茄早疫病的药剂筛选
1.2.2.1 室内药剂毒力试验
采用菌丝生长速率抑制法测定[7-8]。病原菌在PDA培养基上生长7 d,用打孔器(d=8 mm)从菌落边缘打取菌饼,接入预先制备好的7个不同浓度含药PDA平板上,置于26℃培养箱中培养,以添加无菌水的培养基平板为空白对照,每个处理重复3次,接种6 d后检查菌丝生长情况,并用十字交叉法测量供试菌株在不同浓度含药培养基上的菌落直径,与对照菌落直径比较,计算药剂的抑菌率。
抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
利用Excel软件求得不同杀菌剂对供试菌株的毒力回归方程y=a x+b,以及相关系数r2,EC50值由SPSS数据处理软件分析获得[7-8]。
1.2.2.2 小区药剂试验
试验地设在石河子大学农学院试验田,面积30 m2。加工番茄种植采用覆膜滴灌方式,管理水平同一般大田。栽培品种为里格尔87-5。试验设5个处理:72%锰锌·霜脲氰可湿性粉剂 135 g/666.7 m2;70%代森锰锌可湿性粉剂 200 g/666.7 m2;58%甲霜·锰锌可湿性粉剂 180 g/666.7 m2;10%苯醚甲环唑可湿性粉剂 80 g/666.7 m2;空白对照(CK)喷清水;每处理3次重复,随机排列。
试验于田间番茄早疫病发病初期进行常规喷药,分别在施药前(7月1日),第1次施药7 d后(7月9日)、11 d后(7月13日)调查叶片的病级,每个处理小区随机选取5点,每点调查20个叶片。计算病情指数和防治效果,并用DPS数据处理系统进行分析和差异显著性检验。
2 结果与分析
2.1 加工番茄品种抗病性鉴定结果
由表1可知:15个供试加工番茄品种田间均发病,但发病程度有差异,其中佳义6号、石番15号、佳义 8号的病情指数较高,分别为 70.9、66.7和60.1,屯河 17 号病情指数最低,为 24.8。依据番茄早疫病反应型划分标准,本试验鉴定的15个加工番茄品种中,无抗病品种;屯河17号、金红宝308等6个品种耐病,占鉴定总数的40.0%;硕源87-5、农康87-5等6个品种感病,占鉴定总数的40.0%,佳义8号、石番15等3个品种高感,占鉴定总数的20.0%。
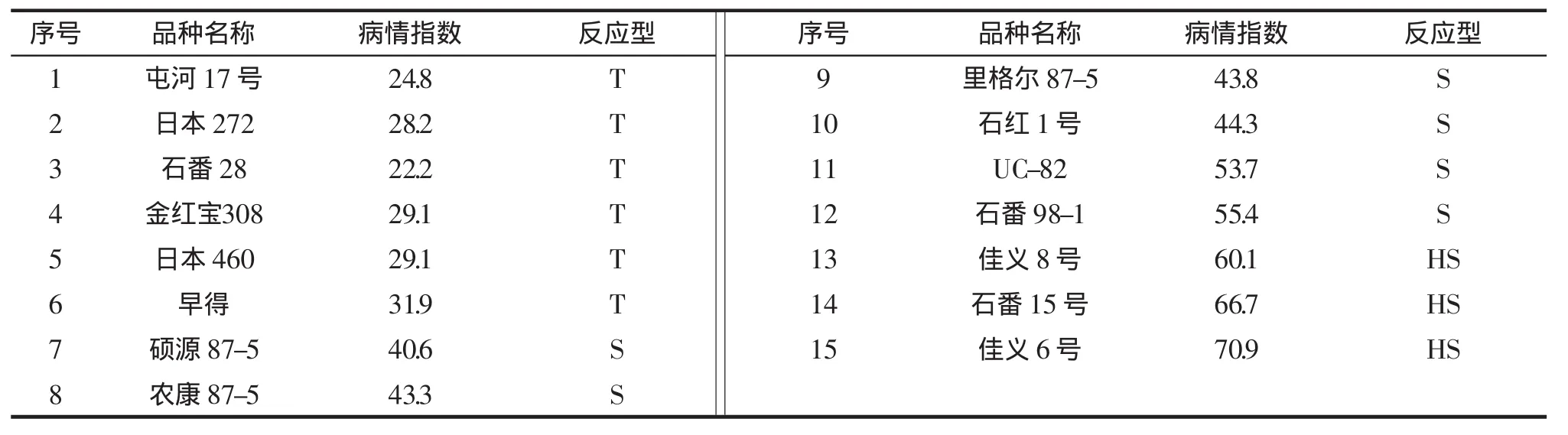
表1 加工番茄不同品种抗早疫病鉴定Tab.1 Identification for early blight resistance of processing tomato varieties
2.2 12种药剂对加工番茄早疫病菌的毒力测定
结果见表2。
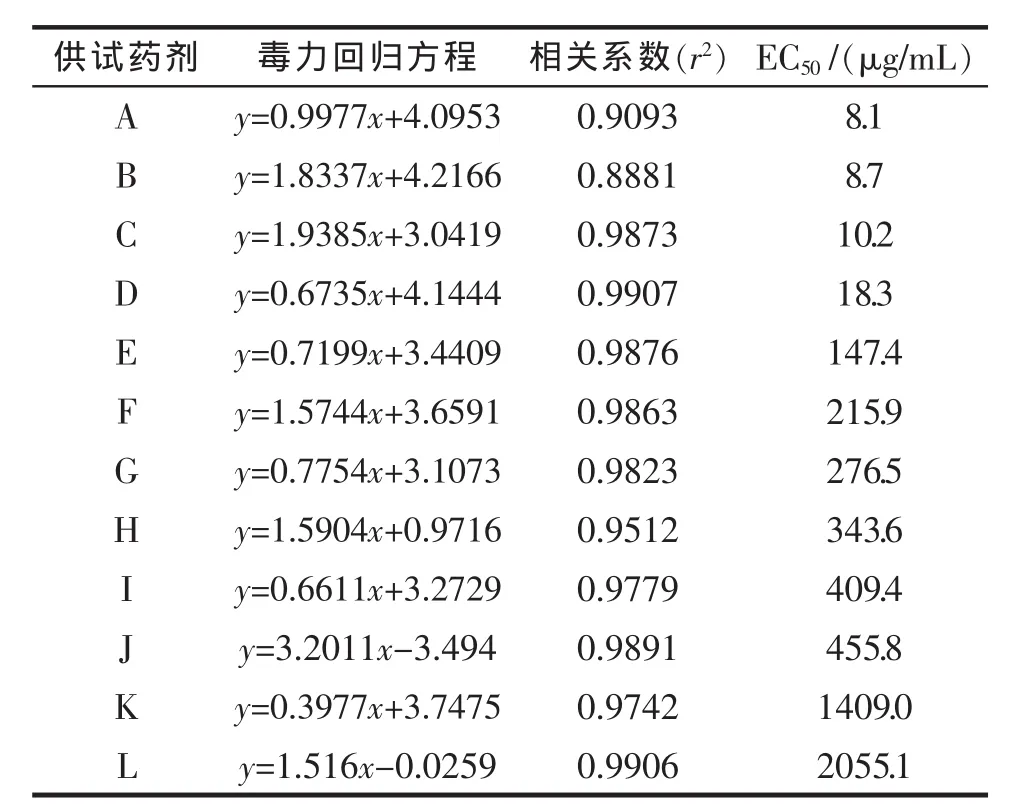
表2.12种供试药剂对早疫病菌的室内毒力测定Tab.2 The toxicity measurement of twelve fungicides to early blight of processing tomato
由表2可知:12种杀菌剂对菌丝生长均有一定的抑制效果,EC50值由小到大排序:72%锰锌·霜脲氰<70%代森锰锌<58%甲霜·锰锌<10%苯醚甲环唑<75%百菌清<250 g/L丙环唑<15%络氨铜<25%三唑酮<1.8%辛菌胺醋酸盐<25%乙嘧酚<250 g/L嘧菌酯<70%甲基硫菌灵。其中,72%锰锌·霜脲氰对早疫病菌的毒力最高,EC50值为 8.1 μg/mL,其次是70%代森锰锌和58%甲霜·锰锌,EC50值分别为8.71和 10.21 μg/mL,70%甲基硫菌灵对番茄早疫病菌生长的抑制效果最差,EC50值为 2055.1 μg/mL。
2.3 小区药效试验
由表3可见:4种供试药剂对加工番茄早疫病均有一定的防治效果,其中72%锰锌·霜脲氰对早疫病菌的防治效果最好,防效可达81.2%,其次是70%代森锰锌和10%苯醚甲环唑,防治效果分别为71.0%和 73.1%,58%甲霜·锰锌的防治效果相对较差,防治效果仅为61.0%。

表3 不同药剂对早疫病的小区防效试验Tab.3 The control effect of plot trials of different fungicides to early blight of processing tomato
3 讨论
本实验品种鉴定结果表明,供试的15个加工番茄中无抗病品种,耐病品种有6个,其余均为感病品种,与同类研究[3]对比发现,新疆加工番茄品种早疫病抗性逐渐在增强,耐病品种的比例有所提高,但是新疆加工番茄品种抗病性总体水平低,特别是主栽品种“里格尔87-5”抗病性较差。
利用抗病品种是一种既经济又有效的病害防治方法,抗病遗传的研究对育种工作者培育抗病品种是至关重要的,然而国内外对番茄抗早疫病遗传的研究并不十分深入,Thirthamallappa等[9]认为番茄对早疫病抗性的遗传特性是隐性多基因控制,Maiero等[10]研究表明番茄对早疫病的抗性受数量遗传控制,且鉴别出显著的加性遗传效应,在有的组合中还存在上位性作用,而国内未见有番茄对早疫病抗性遗传研究的报道。其次,开展抗病育种工作,需要有一套科学的评价种质材料和品种抗性的鉴定方法和评价标准,但是目前加工番茄抗早疫病的评价标准[3,6,9]较为混乱,存在多个标准,致使鉴定结果可比性和可用性较差,导致同一番茄品种在不同地区抗性不一致,从而加速了病害的传播和流行,因此建立统一的番茄早疫病抗性评价标准非常必要。
在加工番茄早疫病综合防治中,除充分考虑使用抗病品种外,化学药剂防治也显得尤为重要,本研究结果表明,72%锰锌·霜脲氰、10%苯醚甲环唑和70%代森锰锌等能有效地控制加工番茄早疫病,防病效能高、费用低,同时使用方便,因此在病害发病初期,建议首先考虑使用锰锌类杀菌剂。杨华[11]等田间试验研究发现,25%醚菌酯悬浮剂对番茄早疫病具有较好的防效,但在本实验中,由于醚菌酯对早疫病菌的室内毒力较低,其EC50值为1409.0 μg/mL,本研究未对醚菌酯开展田间防治试验,只对EC50较小的4种药剂做了田间防治试验。醚菌酯为甲氧基丙烯酸酯类杀菌剂,是新近开发的线粒体呼吸抑制剂,对病菌孢子萌发抑制活性较高,但由于在离体培养基平板上没有抑制病菌旁路呼吸代谢途径的物质,因此降低了其对菌丝生长的抑制活性,而在植物体内存在抑制旁路氧化酶 (AOX)的(类)黄酮类物质[12],因此在植物活体上的活性较高,因而在药剂筛选实验中,对一些新型药剂和新开发的药剂,不能完全依靠室内毒力测定的结果,还需进一步做田间防治试验,最终确定防病效果。现在已有报道,许多种病菌对甲氧基丙烯酸酯类药剂产生了抗性问题,尤其是同种病菌马铃薯早疫病菌已在美国出现了抗性问题[13],因此生产上使用这类药剂防治番茄早疫病时应该尽量与其它类型药剂轮换或交替使用。
[1]许文博,都业娟,黄家风.加工番茄CMV与ToMV的ELISA检测及其相关性分析[J].石河子大学学报:自然科学版,2009,27(2):199-201.
[2]崔燕华,向本春.新疆加工番茄顶端叶片黄化现象的初步研究[J].石河子大学学报:自然科学版,2011,29(4):425-431.
[3]丁成,彭晓玲,李国英,等.加工番茄不同品种对早疫病的抗病性鉴定[J].新疆农业科学,2006,43(1):43-46.
[4]Foolad M R,Ntahimpera N,Christ B J,et al.Comparison of field,greenhouse and detached-leaflet evaluations of tomato germ plasm for early blight resistance[J].Plant Desease,2000,84:967-972.
[5]吴奇峰,李艳.新疆加工番茄种子行业存在问题及对策分析[J].种子,2011,30(8):140-141
[6]张子君,邹庆道,李海涛,等.番茄早疫病抗病性鉴定研究[J].北方园艺,2005(1):53-55.
[7]王晓东,李国英.新疆哈密瓜蔓枯病菌的生物学特性及其室内药剂筛选试验[J].石河子大学学报:自然科学版,2004,22(4):301-304.
[8]Noubar J,Howard M A,Handman M,et a1.Toxicity of six novel fungicides and sulphur to Galendromus occidentalis[J].Experimental and Applied Acarology,2009,47(1):63-69.
[9]Thirthamallappa,Lohithaswa H C.Genetics of resistance to early blight(Alternaria solani Sorauer)in tomato(Lycopersicon esculentum L.)[J].Euphytica,2000,113(3):187-193.
[10]Mariero M,Ng T J,Barksdale T H.Inheritance of resistance in tomato breeding lines C1943 and NC EBR-2[J].Pytopathology,1990,80(12):1365-1368
[11]杨华,崔元玗,甘中祥,等.新药剂防治加工番茄早疫病药效的研究[J].新疆农业科学,2004,41(5):363-366.
[12]王海强,田家顺,严清平,等.番茄早疫病菌对7种杀菌剂的敏感性比较及其对苯醚甲环唑的敏感性基线建立[J].农药,2008,47(4):294-296.
[13]Pasche J S,Wharam C M,Gudmestad N C.Shift in sensitivity of Alternaria solani in response to QoI Fungicides[J].Plant Disease,2004,88(2):181-187.
