小花碱茅组织培养植株再生体系的建立
2014-01-02王雪芳王春梅张金林段丽婕王锁民
王雪芳,王春梅,张金林,段丽婕,王锁民*
(1.兰州大学草地农业科技学院 草地农业生态系统国家重点实验室,甘肃 兰州730020;2.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州730050)
*小花碱茅(Puccinelliatenuiflora)又名星星草,属多年生禾本科碱茅属草本植物,生长于草甸草原、盐渍化土壤碱斑周围[1],多分布于哈萨克斯坦、阿尔泰到亚库梯地区以及我国东北、内蒙古、华北、西北等地。由于其较强的耐盐碱性,小花碱茅常成为草原区盐化或碱化草甸的优势种,如今更逐渐成为改良和利用盐碱地草原草甸的建群种,我国从20世纪80年代开始利用小花碱茅改良盐碱地,取得了良好的效果。小花碱茅不仅可以绿化盐碱地、改善生态环境,而且还可以改善土壤的理化性质,为其他农作物和牧草栽培提供可生存的环境,这些优点使它成为了生物改良盐碱地的首选草种之一[2]。
近年来,科学家们对小花碱茅的生理生态特性、对土壤理化性质的影响、抗盐碱的解剖结构及离子吸收与分配的生理机制等方面进行了大量的研究[3-7],亦克隆和鉴定了与其耐盐性相关的一批基因[8-11],但要进一步深入分析这些基因在小花碱茅适应盐生境中的作用机制,尚亟待建立小花碱茅组织培养植株再生体系。本研究以小花碱茅成熟种子为外植体,成功建立了完整的小花碱茅组织培养植株再生体系,为进一步探究其耐盐碱的分子机制奠定了基础。
1 材料与方法
1.1 植物材料
小花碱茅成熟种子于2009年8月采自兰州大学榆中校区试验田,阴干后置于-20℃冰箱中,次年选取籽粒饱满的种子备用。
1.2 种子脱颖处理及消毒
选取成熟饱满的种子置于研钵中,轻研数下后得到脱颖的褐色种子,分别将脱颖和未脱颖的种子置于超净工作台中,用75%的酒精消毒3min,再用5%的次氯酸钠消毒10min,最后用无菌水冲洗3~5次。
1.3 愈伤组织的诱导
以 MS+3%蔗糖+0.7%琼脂(pH 7~8)为基本培养基,分别添加1)3mg/L 2,4-D;2)5mg/L 2,4-D;3)3 mg/L 2,4-D+0.1mg/L 6-BA;4)5mg/L 2,4-D+0.1mg/L 6-BA;5)7mg/L 2,4-D+0.1mg/L 6-BA;6)5 mg/L 2,4-D+0.3mg/L 6-BA作为愈伤组织的诱导培养基。然后将消毒后的种子接种于上述培养基上遮光培养,每个培养皿接种70粒种子,每种培养基10个重复。分别在2和4周后观察、统计愈伤组织生长情况,并选择生长良好的愈伤组织继代2次,继代周期为4周。
1.4 愈伤组织的分化
以 MS+3%蔗糖+0.7%琼脂(pH 7~8)为基本培养基,分别添加1)0.3mg/L 6-BA;2)0.5mg/L 6-BA;3)1.0mg/L 6-BA;4)1.0mg/L 6-BA+0.2mg/L NAA;5)1.0mg/L 6-BA+0.5mg/L NAA;6)3.0mg/L 6-BA+0.2mg/L NAA作为愈伤组织的分化培养基。选取直径约1cm左右生长良好的黄色颗粒状胚性愈伤组织接种于上述培养基上光照培养,每个培养皿转接10个愈伤组织块,每种培养基6个重复。分别在2和4周后观察、统计芽点分化情况。
1.5 生根培养与移栽
愈伤组织分化出芽点再经4周生长后,移植于1/2MS+1%蔗糖+0.7%琼脂的培养基上进行生根培养。待组培苗生长至10cm左右时,开盖后炼苗1周,然后将完整的再生植株移栽于营养土∶蛭石为3∶1的基质中,并保证温室湿度,隔天浇水。
1.6 培养条件
培养室温度恒定保持(25±1)℃,愈伤组织分化和植株再生阶段的光照强度为50μmol/(m2·s),光周期为16h/d。
1.7 统计分析方法
用SPSS 17.0进行方差分析和显著性分析,用 Microsoft Excel 2003制图。
2 结果与分析
2.1 种子脱颖处理
种子脱颖后,发芽率显著提高,由7.6%增至50.8%,且污染率也有显著降低(图1),由此可见种子脱颖对种子发芽以及愈伤组织的诱导是至关重要的。因此,本研究后续试验采用脱去颖壳的种子为外植体。
2.2 愈伤组织的诱导
将脱颖的小花碱茅种子接种于愈伤组织诱导培养基上,3~4d后发芽,2周后在纤细的胚芽基部可见白色的愈伤组织,4周后的愈伤组织直径约3mm左右,呈白色团状,经1次继代后,部分逐渐转化为黄色颗粒状。愈伤组织诱导率在一定范围内随着2,4-D浓度的增加而升高,当培养基中2,4-D浓度为5.0mg/L时,愈伤组织诱导率最高,达55.2%,此后,随着2,4-D浓度继续增加到7.0mg/L时,反而会抑制愈伤组织的诱导(表1),同时,在培养基中添加6-BA时,愈伤组织诱导率会下降,且水化状态加重、生长缓慢。结果表明,诱导小花碱茅愈伤组织最适的激素配比浓度为5.0 mg/L 2,4-D,不添加6-BA。

表1 不同浓度激素配比对愈伤组织诱导的影响Table 1 Effects of various hormone ratios on callus induction in P.tenuiflora
2.3 愈伤组织的分化
将小花碱茅胚性愈伤组织转接于分化培养基上光照培养,2周后开始出现绿色芽点,随着6-BA浓度的增加,愈伤组织分化率逐渐提高,当6-BA的浓度增加到1.0mg/L时,分化率最高,达33.3%,进一步提高6-BA浓度至3.0mg/L时,分化率明显下降(表2),由此可见促进胚性愈伤组织分化的最佳6-BA浓度为1.0mg/L。实验还发现在培养基中添加NAA后,分化率虽没有显著提高,但随着培养时间的延长,大部分胚性愈伤组织表面都会分化出许多毛状根(图2C),且NAA浓度越高,生根越明显,其中当NAA的浓度为0.5mg/L时,生根率达到了81.7%。结果表明,诱导分化的最适激素浓度配比为0.5mg/L NAA+1.0mg/L 6-BA。

表2 不同浓度激素配比对小花碱茅愈伤组织芽分化和生根的影响Table 2 Effects of various hormone ratios on bud differentiation and rooting from callus in P.tenuiflora
2.4 生根和移栽
将分化出芽点并带有根毛的愈伤组织移入1/2 MS+1%蔗糖+0.7%的培养基上,生根率达100%,且其根系发达(图2D)。待组培苗生长至10cm左右时,开盖炼苗1周,移栽后全部成活,生长良好(图2G)。
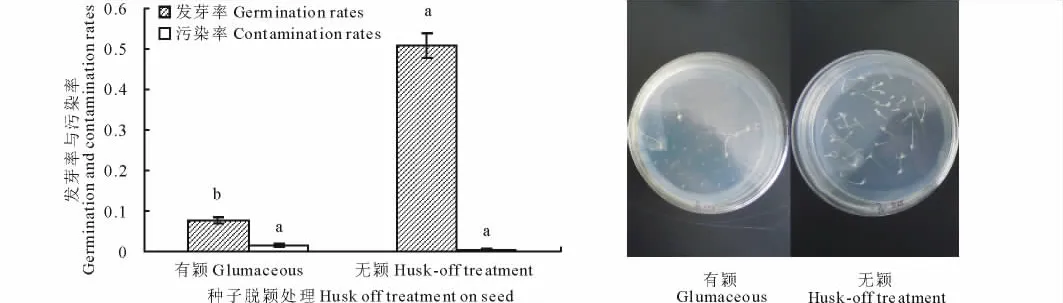
图1 小花碱茅种子脱颖处理对其发芽率和污染率的影响Fig.1 Effects of husk-off treatment on seed germination and contamination rates in P.tenuiflora

图2 小花碱茅组织培养植株再生体系Fig.2 Plant regeneration system via tissue culture in P.tenuiflora
3 讨论
3.1 种子脱颖处理对小花碱茅组织培养的影响
小花碱茅种子细小,呈纺锤形,外包被颖壳。颖壳显著影响小花碱茅种子的发芽率,脱去颖壳后,种子发芽率提高了43.2%,污染率也得到了显著降低(图1)。这可能是由于种子颖壳潜伏的微生物使种子消毒困难,颖壳中含有的某种抑制物或颖壳妨碍了种子的呼吸从而抑制了种子的萌发。赵昕等[12]研究发现种子颖壳、种皮透性以及种子内含有的发芽抑制物质是结缕草种子休眠的主要原因;马彩云等[13]研究发现,野生结缕草种子去颖后愈伤组织诱导率有显著提高;李晓玲等[14]在建立小花碱茅组织培养体系时也发现去颖处理能够得到较好的实验结果。由此可见,脱颖处理对以种子为外植体的禾本科植物种子萌发和愈伤组织培养具有显著的促进作用。
3.2 不同激素配比对小花碱茅愈伤组织诱导的影响
生长素类激素对禾本科植物的愈伤组织诱导、胚状体的产生以及试管苗的快繁和生根有很重要的作用[14],2,4-D是禾本科植物组织培养中公认的诱导愈伤组织效果最好的生长素类似物,这在高羊茅(Festucaarundinacea)、早熟禾(Poa)等[15-16]禾本科牧草及农作物大麦(Hordeumvulgare)[17]中都得到了证实,李晓玲等[14]的研究结果也表明,2,4-D在小花碱茅和朝鲜碱茅愈伤组织的诱导及继代培养中起着重要的作用。一般认为以成熟种子作为外植体诱导愈伤组织时需要较高浓度的2,4-D,且单子叶植物所需2,4-D的浓度是双子叶的10~20倍[18],本研究发现,当2,4-D浓度增至5.0mg/L时,小花碱茅种子的愈伤组织诱导率达55.2%,较李晓玲等[14]研究的愈伤诱导率高1.9%,在2,4-D浓度达到7.0mg/L时,愈伤组织诱导率反而降低到38.6%(表1)。钱海丰和薛庆中[19]的研究也发现,当2,4-D浓度高于12mg/L时,高羊茅种子愈伤组织的诱导会受到严重抑制,这可能是因为生长素浓度过高提高了植物组织内多酚氧化酶的活性,从而增加了愈伤组织的褐化、降低了愈伤组织的诱导[20]。在植物愈伤组织诱导中,一般配合使用低浓度的细胞分裂素可提高愈伤组织的质量和诱导率,本研究中却得到了相反的结果:0.1和0.3mg/L 6-BA均在一定程度上抑制了小花碱茅愈伤组织的诱导(表1)。李俊琴等[21]在研究新麦草(Psathyrostachysjuncea)幼胚愈伤组织诱导时也发现,添加6-BA反而会抑制其愈伤组织的形成。
3.3 不同激素配比对小花碱茅胚性愈伤组织分化和生根的影响
NAA是植物组织培养中常用的生长素类激素之一,在诱导愈伤组织分化时使用较多,其使用的浓度范围是0.1~1.0mg/L。有研究报道禾本科牧草高羊茅和黑麦草(Loliumperenne)在分化时所用NAA浓度均为0.5 mg/L[20,22],本研究中也发现当 NAA浓度为0.5mg/L时,小花碱茅分化率最高,达31.7%(表2)。也有研究报道NAA不仅有利于愈伤组织芽点的分化,同时还可促进组培苗生根[23],本研究中也发现当NAA浓度为0.5 mg/L时,生根率达到了81.7%。生长素浓度低于细胞分裂素浓度时会促进植物芽的形成,且细胞分裂素起主导作用,6-BA是促进植物细胞分裂分化的激素,在愈伤组织分化中起主导作用,其浓度使用范围为1.0~3.0 mg/L,本研究中发现0.5mg/L NAA+1.0mg/L 6-BA的激素配比是诱导小花碱茅愈伤组织分化与生根的最适激素配比,钱海丰和薛庆中[19]也在2.0mg/L 6-BA+0.5mg/L NAA的分化培养基上诱导了高羊茅芽的分化和生根,本研究与其结果基本一致。
许多植物组织培养的研究证实,无任何激素的1/2MS培养基是组培苗生根的最适培养基,它能很大程度地提高组培苗移栽的成活率,本研究结果与其一致,小花碱茅胚性愈伤组织在1/2MS培养基上的生根率为100%。
4 结论
小花碱茅组织培养体系以脱颖后的种子为外植体,诱导愈伤组织的最适培养基为:MS+5.0mg/L 2,4-D+3%蔗糖+0.7%琼脂;愈伤组织分化的最适培养基为:MS+0.5mg/L NAA+1.0mg/L 6-BA+3%蔗糖+0.7%琼脂,同时伴随大量毛状根的发生;生根培养基为:1/2MS+1%蔗糖+0.7%琼脂培养基,生根率可达100%,且移栽后全部成活。本研究建立的小花碱茅植株再生周期为16周左右。
[1]赵喜印,佟振宇,赵彬,等.星星草治理草原碱斑的效果与种植技术[J].草业科学,1992,9(5):61-62.
[2]周波,许志丹.星星草对盐碱草地的适应性及改良作用的研究现状[J].吉林师范大学学报(自然科学版),2005,11(4):30-31.
[3]郭立泉,陈建欣,崔景军,等.盐、碱胁迫下星星草有机酸代谢调节的比较研究[J].东北师范大学学报(自然科学版),2009,41(4):123-128.
[4]韦存虚,张军,王建军,等.星星草营养器官适应盐胁迫的结构特征[J].植物资源与环境学报,2006,15(1):51-56.
[5]王锁民,朱兴运,王增荣.渗透调节在碱茅(Puccinelliatenuiflora)幼苗适应盐逆境中的作用初探[J].草业学报,1993,2(3):40-46.
[6]王锁民,朱兴运,舒孝喜.碱茅离子吸收与分配特性研究[J].草业学报,1994,3(1):39-43.
[7]Wang S M,Zhao G Q,Gao Y S,etal.Puccinelliatenuifloraexhibits stronger selectivity for K+over Na+than wheat[J].Journal of Plant Nutrition,2004,27(10):1841-1857.
[8]Guo Q,Wang P,Ma Q,etal.Selective transport capacity for K+over Na+is linked to the expression levels ofPtSOS1in halophytePuccinelliatenuiflora[J].Functional Plant Biology,2014,39:1047-1057.
[9]Wang X,Yang R,Wang B C,etal.Functional characterization of a plasma membrane Na+/H+antiporter from alkali grass(Puccinelliatenuiflora)[J].Molecular Biology Reports,2011,38:4813-4822.
[10]Ardie S W,Xie L,Takahashi R,etal.Cloning of a high-affinity K+transporter genePutHKT2;1fromPuccinelliatenuifloraand its functional comparison withOsHKT2;1from rice in yeast andArabidopsis[J].Journal of Experimental Botany,2009,60:3491-3502.
[11]Ardie S W,Liu S,Takano T.Expression of the AKT1-type K+channel gene fromPuccinelliatenuiflora,PutAKT1,enhances salt tolerance inArabidopsis[J].Plant Cell Reports,2010,29:865-874.
[12]赵昕,李玉霖,张立新.两种结缕草种子休眠及萌发特性[J].西北植物学报,2003,23(11):2003-2006.
[13]马彩云,王栋,马金萍,等.野生结缕草成熟胚愈伤组织诱导及再生体系的研究[J].草业科学,2010,27(9):104-108.
[14]李晓玲,李克秀,于晓明.星星草和朝鲜碱茅组织培养体系的建立[J].中国草地学报,2010,11,32(6):90-93.
[15]唐小艳,易自力,蒋建雄,等.植物激素在高羊茅组织培养中的应用与进展[J].湖南农业科学,2006,(3):134-136.
[16]丁路明,龙瑞军,朱铁霞.2,4-D和6-BA对早熟禾愈伤组织诱导的影响[J].草原与草坪,2003,1:34-37.
[17]Bregitzer P,Campbell R D,Wu Y.Plant regeneration from barley callus:effects of 2,4-dichlorphenoxy acetic acid and phenylacetic acid[J].Plant Cell Tissue and Organ Culture,1995,43:229-235.
[18]孙在红,刘荣堂,梁慧敏,等.植物激素在草坪草组织培养及植株再生中的应用与进展[J].草原与草坪,2004,2:13-16.
[19]钱海丰,薛庆中.激素对高羊茅愈伤组织诱导及其分化的影响[J].中国草地,2002,1(1):46-60.
[20]朱晓花,孙吉雄,梁慧敏,等.低温预处理与植物生长调节剂对结缕草愈伤组织诱导的影响[J].草业科学,2009,26(4):121-126.
[21]李俊琴,云锦凤,云岚,等.新麦草幼胚愈伤组织诱导[J].中国草地学报,2008,30(2):39-42.
[22]徐定炎,何阳鹏.种胚处理不同激素浓度在暗培养条件下对多年生黑麦草愈伤组织诱导的影响[J].浙江林业科技,2003,23(2):16-19.
[23]余桂红,马鸿翔,余建明,等.草坪型高羊茅成熟种子胚性愈伤组织诱导及植株再生[J].江苏农业学报,2004,20(1):38-43.
