植物抗旱基因工程研究进展
2014-01-02徐立明张振葆梁晓玲卢文张辰路黄凤珠王雷张素芝
徐立明,张振葆,梁晓玲,卢文,张辰路,黄凤珠,王雷,张素芝*
(1.四川农业大学玉米所 农业部西南玉米生物学与遗传育种重点实验室,四川 成都611130;2.日照市五莲县农业局,山东 日照262300)
*在自然条件下生长的植物,经常会面临干旱、涝害、盐碱、高温、低温、冷害、营养匮乏、重金属污染等非生物胁迫,严重影响了植物的正常生长和发育。在这些逆境胁迫中,干旱是最为突出的限制因素之一[1-20]。近年来,基因工程的诞生使人类的农业生产史发生了巨大的变化。通过转基因技术提高植物抗旱性,具备并已展现了巨大的应用价值和经济价值,但其前提是必须了解植物抗旱的分子机制。植物受到干旱胁迫后会诱发植物体内其他多种不良反应,如活性氧爆炸、渗透压的变化等,因而植物必须迅速启动对这些不良反应的应答而存活下来(图1)。干旱通常能触发植物基因表达增强或减弱、代谢产物增加或减少、特异蛋白合成等应答活动[2,21-30]。此外,随着基因芯片、数字表达谱、转录组等分子生物学技术的发展,多个干旱应答基因已被鉴定。这些鉴定的基因中,一些为调节基因,如编码信号因子、转录因子的功能基因;一些为编码功能性蛋白和有机分子合成酶的基因,如编码合成调渗分子、多胺类分子,活性氧清除分子的功能基因;还有一些为编码microRNA的功能基因。将这些干旱应答基因根据其作用方式转化植物而增强抗旱性成为最佳策略[3-4,31-35]。本文着重从分子水平上阐述有关抗旱方面最前沿的研究,并且特别阐述了植物抗旱基因工程的发展近况。
1 信号分子
当逆境胁迫发生时,植物能通过各种不同的信号转导活动,如蛋白的磷酸化和去磷酸化、对Ca2+的感知、蛋白的降解等途径对胁迫进行应答[4,36-47]。尽管这些复杂的信号途径如何进行整体调控仍然不十分明确[5,48-63],但是已有研究证实一些信号分子能通过参与干旱胁迫相关的信号转导途径,来调控植物抗旱性。例如,烟草(Nicotianatabacum)促分裂原活化蛋白激酶的激酶基因NPK1能够调节干旱所诱发的氧化胁迫的信号转导活动。在干旱条件下,过量表达NPK1的转基因烟草比野生型生长状况更好[6]。
通过激活因子或抑制因子调控信号转导途径,是植物应答干旱胁迫的一种主要方式。例如,拟南芥(Arabidopsisthaliana)的法呢基转移酶ERA1作为负调节因子能抑制脱落酸(abscisic acid,ABA)信号转导,从而降低拟南芥对干旱胁迫的耐受性。相反,反义抑制ERA1的转基因拟南芥对ABA信号的应答增强,致使拟南芥的部分叶片气孔关闭、蒸腾作用减弱、水分蒸发减少,最终表现为拟南芥抗旱性增强[7]。另外,激活因子能通过蛋白激酶正调控植物的抗旱途径。在干旱条件下,拟南芥蛋白激酶SnRK2s(SNF1-related protein kinase 2)家族的9个成员(SRK2A-J/SnRK2.1-10)几乎都被诱导表达[8]。其中,在正常的生长条件下SRK2C(SnRK2.8)低水平表达,但在干旱条件下SRK2C(SnRK2.8)被诱导激活,表达量显著提高,拟南芥抗旱性增强[9]。此外,拟南芥中类SOS3的Ca2+结合蛋白CBL(SOS3-like calcium-binding protein)与蛋白激酶CIPK/PKS能相互作用形成活性复合体,调控干旱、盐或冷胁迫条件下的信号转导活动。CBL1是CBL蛋白家族成员,在干旱条件下被诱导激活。转基因拟南芥过量表达CBL1时,一些胁迫应答基因上调表达,拟南芥的抗旱性随之增强[10]。
最近的研究发现一些信号调节因子通常参与多个信号转导途径的调控,如AtMPK6至少调节MKK2-MPK6和MKK4/MKK5-MPK6这2个不同的MAPK信号级联活动,并且每个信号级联活动都能够传递或转导不同的胁迫应答信息[11],这说明了信号转导网络的复杂性。

图1 在干旱胁迫下的遗传路径Fig.1 A genetic pathway under drought stress
2 转录因子
转录组分析发现,AP2、bZIP、NAC、MYB、Cys2/His2锌指等不同类型的转录因子都能调控植物应答干旱胁迫(表1)[22-25,64-71],这些转录因子通过激活或抑制下游干旱应答基因的表达,来调节植物的抗旱性[4,12,14,16]。
植物的bZIP转录因子能通过参与ABA信号转导途径调控植物对干旱胁迫的反应。在干旱条件下,植物体内ABA水平会有所增加,ABA信号转导活动增强,一些干旱胁迫应答基因也被ABA诱导激活[13]。Fujita等[14]发现与 ABA顺式作用元件 ABRE(ABA-responsive element)结合的蛋白 AREB(ABA-responsive element binding protein)属于bZIP转录因子家族。这类基因如AREB1/ABF2、AREB2/ABF4和ABF3/DPBF5,能在干旱、ABA和盐胁迫的诱导下增强表达,在拟南芥中过量表达时提高了植株对这些胁迫的耐受性[12,14]。

表1 应用转录因子的抗旱基因工程Table 1 Engineering of drought tolerance using transcription factors
R2R3-MYB类转录因子也参与了植物对干旱胁迫的调控。例如,MYB15在拟南芥中过量表达时,ABA合成相关的基因ABA1上调表达,拟南芥抗旱性随之增强[15]。AtMYB60也是一个R2R3-MYB类转录因子,在拟南芥中能调控气孔的开合。AtMYB60基因在拟南芥叶片保卫细胞中特异性表达,并在干旱条件下其表达受到抑制[16]。在干旱条件下,其功能缺失性突变体的部分气孔关闭,蒸腾作用减弱,抗旱性增强。
水稻42个APETELA2(AP2)类转录因子分属于6个亚家族(I-VI),能被不同的胁迫条件和ABA所诱导激活,其中亚家族I的AP37和亚家族Ⅱ的AP59能被干旱和高盐胁迫诱导激活。启动子OsCc1驱动AP37和AP59基因在水稻中过量表达时,对干旱胁迫表现出比野生型更强的耐受性。在严重的干旱条件下,过量表达AP37的转基因水稻比过量表达AP59的转基因水稻产量提高了16%~57%[17]。此外,DREB1/CBF(dehydration-responsive element-binding factors 1)也属于 AP2类转录因子[18-19]。在干旱、盐、冷的胁迫条件下,拟南芥DREB1/CBF上调表达,致使拟南芥对这些胁迫的耐受性增强[19]。用胁迫诱导型启动子Atrd29A驱动At-DREB1A/CBF基因表达的转基因花生(Arachishypogaea),能比野生型合成更多的抗氧化酶(antioxidant enzymes)和脯氨酸,表现出更强的抗旱性[20]。Dubouzet等[21]从水稻中也分离出4个与拟南芥DREB1A/CBF同源的水稻基因OsDREB1A、OsDREB1B、OsDREB1C和OsDREB1D。在水稻中过量表达OsDREB1时,转基因株系对干旱、盐和冷胁迫耐受性增强。
NAC类蛋白是植物中另一类重要的转录因子,能调控植物的生长发育和增强植物对胁迫环境的适应能力。ANAC019、ANAC055和ANAC072是从拟南芥中分离到的3个不同的NAC基因,在干旱条件下这些基因被诱导激活。在拟南芥中过量表达这些基因时,转基因株系的抗旱性增强[22]。在水稻中也分离到NAC类型的转录因子,如SNAC1能被干旱胁迫所诱导,过量表达SNAC1的转基因水稻抗旱性比野生型明显地增强[23]。
除此之外,一些锌指转录因子(如STZ)能通过负调控基因表达而增强植物抗旱性。在拟南芥中,受干旱、高盐、冷等胁迫条件的诱导,编码C2H2型锌指转录因子的STZ基因上调表达。同时,过量表达STZ基因的转基因拟南芥抗旱性增强[24]。此外,在拟南芥中过量表达STZ的直系同源基因CAZFP1时,除了能增强拟南芥抗旱性之外,抵御病原菌侵染的能力也增强[25]。
3 渗透调节小分子物质
在水分匮乏的情况下,植物为抵御干旱胁迫,细胞内可以大量合成甜菜碱(glycine betaine,GB)、脯氨酸(proline)、海藻糖(trehalose)、甘露醇(mannitol)等渗透性的有机小分子物质,增加细胞的渗透势,缩小与周围环境的渗透势差,从而使植物避免因高渗透势差导致细胞过度失水死亡[26](表2)。
植物可通过大量合成甜菜碱来应答干旱胁迫[27]。在高等植物里,胆碱单加氧酶(choline monooxygenase,CMO)和甜菜碱醛基脱氢酶(betaine aldehyde dehydrogenase,BADH)是GB生物合成的2个关键酶。在烟草中过量表达COM基因时,能导致甜菜碱高水平的积累和烟草抗旱性的提高[28]。
与GB类似,脯氨酸也是一种重要的渗透调节分子。脯氨酸是水溶性很强的氨基酸,它的疏水端与蛋白质联结而亲水端与水分子结合,从而使得蛋白通过脯氨酸能束缚更多的水分子,因此提高脯氨酸的合成能力能够增强植物的抗旱性。吡咯啉-5-羧酸盐还原酶(pyrroline-5-carboxylate synthetase,P5CR)是脯氨酸生物合成的一个关键酶[29]。P5CR基因在大豆(Glycinemax)、矮牵牛(Petuniahybrida)和烟草里已经被鉴定,并且发现几乎所有的转化P5CR基因的植物都表现出脯氨酸的过量积累并伴随其抗旱性的增强[30-31]。
海藻糖也是一个重要的渗透调节因子,转化海藻糖生物合成的关键酶基因能提高植物的抗旱性。例如,转化大肠杆菌海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase)TPS1基因能使海藻糖在转基因烟草体内大量积累,同时伴随其抗旱性的增强。转基因烟草还呈现出植株矮小、叶片呈柳叶刀型等抗旱性表型[32]。此外,过量表达酵母TPS1-TPS2融合基因的烟草比野生型的抗旱性更强,而且比仅过量表达TPS1的烟草在干旱条件下表现出更好的生长状况[33-34]。另外,用胁迫诱导型启动子rd29A驱动大肠杆菌海藻糖合成的调控基因otsA、otsB与海藻糖-6-磷酸合成酶的磷酸化酶(trehalose-6-phosphate synthase phosphatase)基因TPSP在水稻中融合过量表达时,此融合基因otsA-otsB-TPSP仅在胁迫条件下被诱导激活,随后转基因水稻体内的海藻糖能大量积累,对干旱、高盐等非生物胁迫的耐受性也随之提高[35-36]。
甘露醇也参与了渗透调节干旱胁迫。小麦的甘露醇-1-磷酸脱氢酶(mannitol-1-phosphate dehydrogenase)基因mt1D过量表达时,转基因小麦体内的甘露醇含量增加,对干旱和盐胁迫的耐受性增强[37]。然而,将大肠杆菌的mt1D基因导入烟草时,虽然在转基因烟草体内甘露醇也有积累,但转基因烟草对胁迫的耐受性并未随之提高[38]。据此,在通过转化甘露醇生物合成相关基因提高植物的抗旱等胁迫的基因工程开始前,需首先确定这些基因是否与干旱等胁迫耐受性相关。
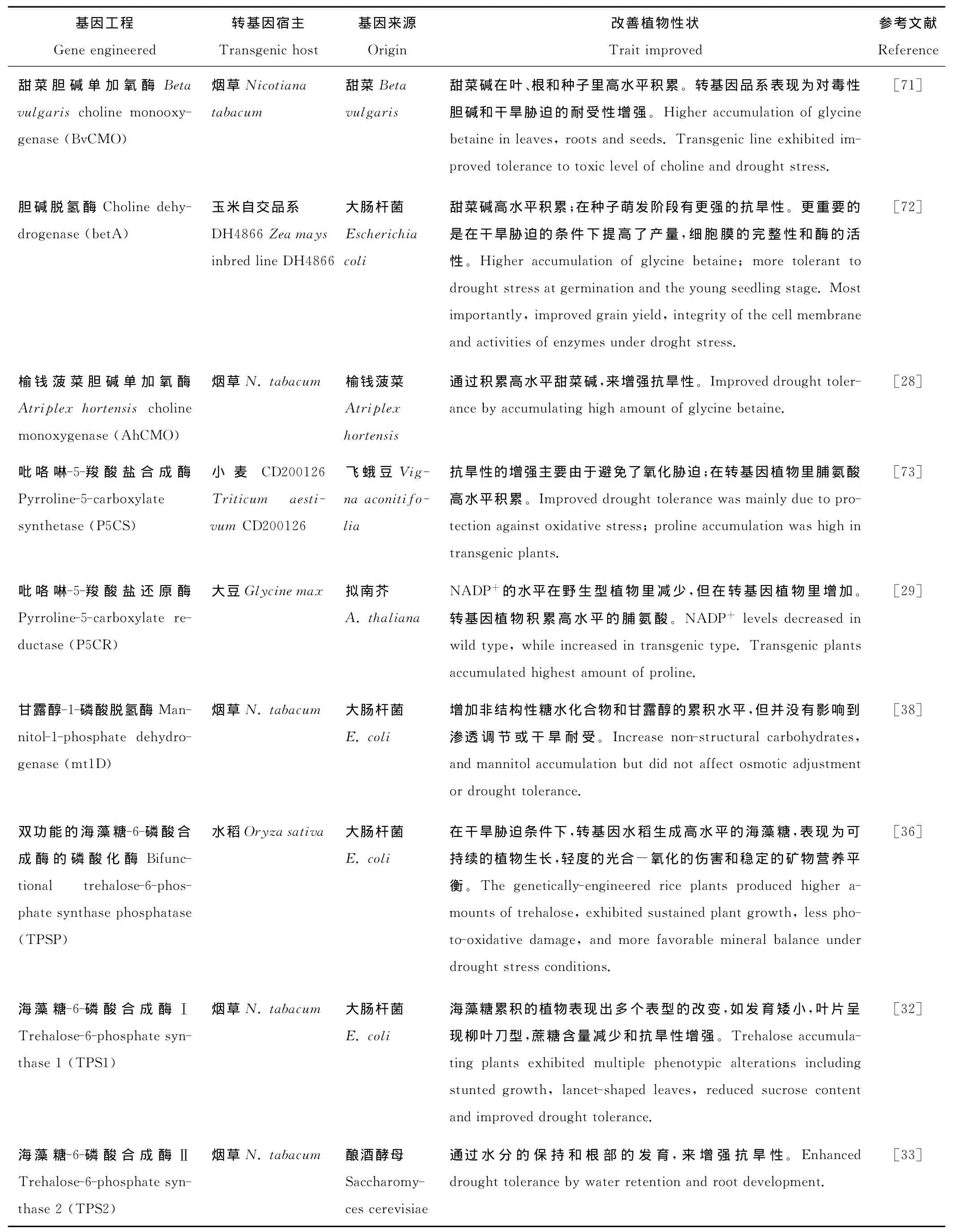
表2 应用有机渗透分子的抗旱基因工程Table 2 Engineering of drought tolerance using organic osmolytes
4 活性氧清除分子
经研究发现,干旱通常会导致植物体内活性氧(reactive oxygen species,ROS)如 O22-、O、H2O2、OH-等过量积累。高等植物具有ROS的清除系统,包括一些抗氧化酶,如超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸超氧化酶(ascorbic acid oxidase,APX)、过氧化氢酶(catalase,CAT)和一些抗氧化的小分子,如抗坏血酸(ascorbic acid,AsA)、谷胱甘肽(glutathione,GSH)、维生素 E等[39,42]。通常植物体内 ROS清除系统能将ROS转换为无氧化活性的化合物,使ROS得以清除,从而避免细胞膜脂的过氧化、新陈代谢酶类的氧化失活。
在干旱条件下,植物过量表达SOD和APX基因时,对干旱诱发生成的过量H2O2和O22-清除能力增强,转基因植物表现出抗旱性增强。例如,过量表达叶绿体MnSOD基因的转基因水稻比野生型表现出更强的抗旱性[41]。受干旱条件诱导,豌豆APX基因的转录水平提高,此时豌豆体内的APX含量和活性都有所增加,呈现出抗旱性增强的表型[42]。此外,用胁迫诱导型启动子rd29A驱动高羊茅(Festucaarundinacea)的APX-Cu/Zn-SOD融合基因在叶绿体里过量表达时,能有效地减轻干旱等胁迫条件所导致的氧化损伤,致使高羊茅抗干旱等胁迫的能力增强[43]。
植物体内CAT活性的强弱与植物受胁迫的程度相关。Luna等[44]研究发现,在轻度的干旱胁迫条件下,烟草CAT的活性很低,但是在严重的干旱条件下CAT的活性增强。一些研究发现在严重干旱条件下,过量表达大肠杆菌CAT基因的转基因烟草比野生型具有更强的抗旱性[45]。而且,研究还发现APX和CAT缺失的双突变体烟草能通过抑制光合作用和提高参与磷酸戊糖途径的基因、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase)基因的表达水平,来缓解和降低干旱诱导的过量ROS对其造成的伤害,从而增强其抗旱性[46]。
抗氧化小分子的积累也能提高植物的抗旱性。例如,拟南芥和结缕草(Zoysia)能通过积累AsA/GSH和维生素E,清除体内的OH-和O22-,减轻ROS所造成的损伤,使其在干旱条件下能够正常的生长和发育[47-48]。此外,西瓜(Citrullus)还能通过积累瓜氨酸和金属硫蛋白来调节体内的OH-和O22-的水平,使体内的蛋白和DNA免受ROS的氧化损伤,使西瓜的抗旱性增强[49-50]。
5 多胺类分子
植物能通过积累多胺类化合物(polyamines,PAs),如腐胺(putrescine,Put)、亚精胺(spermidine,Spd)、精胺(spermine,Spm),来应答干旱、冷、热、重金属等逆境胁迫。然而,这些PAs应答胁迫的分子机制仍然不明确,因此分析增加的PAs的水平是胁迫诱导的结果或胁迫应答的结果十分必要[51-52]。
最近,通过对功能获得性和功能缺失性突变体的研究,证实了PAs具有应答干旱等非生物胁迫的功能[53]。通过对不同植物调控PAs合成的基因ADC、SAMDC等进行异源表达,发现这些基因能响应干旱等非生物胁迫。拟南芥S-腺苷甲硫氨酸脱羧酶(S-Adenosyl methionine decaboxylase)SAMDC1基因过量表达时,转基因株系体内的Spm水平升高,对干旱、盐等非生物胁迫的耐受性增强。同时,SAMDC1基因过量表达时,还能使ABA生物合成基因NCED3(9-cis-epoxycarotenoid dioxygenase)上调表达,转基因株系体内的ABA水平增加,ABA信号转导途径增强,抗旱性也随之显著增强,说明Spm能与ABA协同提高植物对干旱的耐受性,但Spm合成水平是否与ABA信号途径有关尚无报道[54]。此外,在拟南芥中过量表达ADC2(arginine decarboxylase 2)基因时转基因株系体内的Put水平增加,拟南芥的抗旱性也随之增强[55]。另外,对调控PAs生物合成相关基因的功能缺失性突变体进行研究,也证实了PAs调控植物应答干旱等非生物胁迫的功能。例如,拟南芥T-DNA插入突变体adc2对干旱高度敏感[56],突变体acl5/spms(不能合成Spm)对干旱和盐胁迫高度敏感。但是,在施加外源的PAs时,这些突变体对逆境胁迫的敏感表型能部分恢复。
6 小RNA分子
植物能编码、剪切和积累21~24个核苷酸左右的小RNAs[57],基于不同的生成机制可将其分类为miRNAs(microRNAs),ta-siRNAs(trans-acting siRNAs),nat-siRNAs(natural antisense siRNAs)和ra-siRNAs(repeatassociated siRNAs)。这些小RNAs通过对目的mRNA的降解、翻译活动的抑制和染色质的修饰,调控目的基因的表达[58]。
通过高通量的生物技术(如基因芯片)对干旱条件下植物进行转录组分析,除发现了大量的差异表达基因,还发现miRNAs的表达也存在差异[58-60]。例如,在干旱条件下,拟南芥通过上调表达miR157、miR167、miR168、miR171、miR408、miR393、miR396、miR319和 miR397应答干旱胁迫[58,61]。但是,三角叶杨(Populustrichocarpa)miR1446a-e、miR1444a、miR1447和 miR1450在干旱条件下表达水平下调,并且 miR1711-a、miR482.2、miR530a、miR827、miR1445和miR1448的表达也轻度下调来应答干旱胁迫[62]。此外,在干旱、盐等非生物胁迫条件下,菜豆(Phaseolusvulgaris)能通过轻度上调表达miR2118,适度上调表达miR159.2、miR393和miR1514应答干旱等非生物胁迫[59-60]。这些研究表明,在干旱胁迫下,植物能通过上调或下调表达特异的miRNAs而增强对干旱等胁迫的耐受性。
7 展望
目前,一些应答干旱胁迫的基因已经被鉴定,一些重要的基因已经通过转基因技术成功地改善了植物的耐旱性。基因芯片、数字表达谱、转录组等高通量生物技术的应用使得抗旱相关的候选基因的鉴定进一步加快,这为植物抗旱基因工程的研究提供了强大的技术支持。同样,运用最前沿的基因工程技术转化抗旱性的基因,这对于发现新的抗旱相关的基因,并且研究其功能具有重要意义[4]。然而,目前植物抗旱基因工程的研究仅仅是一个开始,在植物抗旱性的研究中还存在很多的问题[5,12,26]。抗旱是由多基因控制的数量性状,其生理生化过程是各基因间以及基因和环境间相互作用、共同调节的结果。植物抗旱分子机制十分复杂,了解还不够全面深入,基因转化获得抗旱性植株还有很大的盲目性,因而必须加强对抗旱分子机制的研究。植物转入单基因提高植物的抗旱性对有的基因和植物有效,对有的基因和植物却无效,然而植物转入复合基因能够更好地提高植物的抗旱性,但这方面的研究在先前的报道中很少,可能是多个外源基因的渗入给植物带来比较多的副作用[26]。为了避免给植物生长和发育带来影响,了解候选基因在植物生长不同的时期和不同的部位表达也是转基因技术中一个必须考虑的因素。转基因的过量表达体系中普遍应用的组成型表达启动子,如CaMV35S启动子,并不适用于每一个物种,并且消耗太多的植物能量而影响植物生长和发育。对于植物应答胁迫而不消耗太多的植物能量,胁迫诱导特异型启动子是一个不错的选择。转基因植物的研究,通常在实验室受控的环境条件下,而田间的生长环境多样性,植物可能要在多种胁迫的环境条件下生存,成功地在田间运用转基因技术增强植物对多种胁迫环境的抗性还需要进一步的研究。因此,深入研究各种胁迫之间的相互关系是非常重要而且必要的[26,63]。
最近的研究常常关注一些调节因子响应胁迫应答的机制。一些重要的胁迫应答调节因子,通常彼此之间相互作用并且具有内在的相互关系,如一些信号因子和转录因子能够广泛地调控植物应答胁迫[63],但其之间的相互关系十分复杂。近来,分子系统学和基因组学的分析已使复杂的基因调节网络变得更加清晰,并且辅助发现了一些新的胁迫应答因子和胁迫应答调节机制,这些进步使得利用基因工程技术改善植物抗旱性能获得更好的结果。此外,一些新的基因工程的研究领域,如功能性蛋白、调控元件和RNA调节,在未来也将凸显出它的重要性[4-5]。因此,根据不同的植物生长发育周期和环境条件,运用基因工程技术改善植物抗旱性将拥有越来越好的前景。
[1]Boyer J S.Plant productivity and environment[J].Science,1982,218:443-448.
[2]Ramachandra Reddy A,Chaitanya K V,Vivekanandan M.Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants[J].Journal of Plant Physiology,2004,161:1189-1202.
[3]Shinozaki K,Yamaguchi-Shinozaki K,Seki M.Regulatory network of gene expression in the drought and cold stress responses[J].Current Opinion In Plant Biology,2003,6:410-417.
[4]Umezawa T,Fujita M,Fujitam Y,etal.Engineering drought tolerance in plants:discovering and tailoring genes to unlock the future[J].Current Opinion in Biotechnology,2006,17:113-122.
[5]Vinocur B,Altman A.Recent advances in engineering plant tolerance to abiotic stress:achievements and limitations[J].Cur-rent Opinion in Biotechnology,2005,16:123-132.
[6]Shou H,Bordallo P,Wang K.Expression of the Nicotiana protein kinase(NPK1)enhanced drought tolerance in transgenic maize[J].Journal of Experimental Botany,2004,55:1013-1019.
[7]Cutler S,Ghassemian M,Bonetta D,etal.A protein farnesyl transferase involved in abscisic acid signal transduction inArabidopsis[J].Science,1996,273:1239-1241.
[8]Boudsocq M,Barbier-Brygoo H,Laurière C.Identification of nine sucrose nonfermenting 1-related protein kinases 2activated by hyperosmotic and saline stresses inArabidopsisthaliana[J].Journal of Biological Chemistry,2004,279:41758-41766.
[9]Umezawa T,Yoshida R,Maruyama K,etal.SRK2C,a SNF1-related protein kinase 2,improves drought tolerance by controlling stress-responsive gene expression inArabidopsisthaliana[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101:17306-17311.
[10]Cheong Y H,Kim K N,Pandey G K,etal.CBL1,a calcium sensor that differentially regulates salt,drought,and cold responses inArabidopsis[J/OL].The Plant Cell Online,2003,15:1833-1845.
[11]Posas F,Saito H.Osmotic activation of the HOG MAPK pathway via Ste11p MAPKKK:scaffold role of Pbs2p MAPKK[J].Science,1997,276:1702-1705.
[12]Bartels D,Sunkar R.Drought and salt tolerance in plants[J].Critical Reviews in Plant Sciences,2005,24:23-58.
[13]Finkelstein R R,Gampala S S,Rock C D.Abscisic acid signaling in seeds and seedlings[J].Plant Cell,2002,14(Suppl):15-45.
[14]Fujita Y,Fujita M,Satoh R,etal.AREB1is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance inArabidopsis[J/OL].The Plant Cell Online,2005,17:3470-3488.
[15]Ding Z,Li S,An X,etal.Transgenic expression of MYB15confers enhanced sensitivity to abscisic acid and improved drought tolerance inArabidopsisthaliana[J].Journal of Genetics and Genomics,2009,36:17-29.
[16]Cominelli E,Galbiati M,Vavasseur A,etal.A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J].Current Biology,2005,15:1196-1200.
[17]Oh S J,Kim Y S,Kwon C W,etal.Overexpression of the transcription factor AP37in rice improves grain yield under drought conditions[J].Plant Physiology,2009,150:1368-1379.
[18]王舟,刘建秀.DREB/CBF类转录因子研究进展及其在草坪草和牧草抗逆基因工程中的应用[J].草业学报,2011,20(1):222-236.
[19]Liu Q,Kasuga M,Sakuma Y,etal.Two transcription factors,DREB1and DREB2,with an EREBP/AP2DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,inArabidopsis[J/OL].The Plant Cell Online,1998,10:1391-1406.
[20]Bhatnagar-Mathur P,Devi M J,Vadez V,etal.Differential antioxidative responses in transgenic peanut bear no relationship to their superior transpiration efficiency under drought stress[J].Journal of Plant Physiology,2009,166:1207-1217.
[21]Dubouzet J G,Sakuma Y,Ito Y,etal.OsDREB genes in rice,OryzasativaL.,encode transcription activators that function in drought-,high-salt-and cold-responsive gene expression[J].The Plant Journal,2003,33:751-763.
[22]Tran L S P,Nakashima K,Sakuma Y,etal.Isolation and functional analysis ofArabidopsisstress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1promoter[J/OL].The Plant Cell Online,2004,16:2481-2498.
[23]Hu H,Dai M,Yao J,etal.Overexpressing a NAM,ATAF,and CUC(NAC)transcription factor enhances drought resistance and salt tolerance in rice[J].Proceedings of the National Academy of Sciences,2006,103:12987-12992.
[24]Sakamoto H,Maruyama K,Sakuma Y,etal.ArabidopsisCys2/His2-type zinc-finger proteins function as transcription repressors under drought,cold,and high-salinity stress conditions[J].Plant Physiology,2004,136:2734-2746.
[25]Kim S,Hong J,Lee S,etal.CAZFP1,Cys2/His2-type zinc-finger transcription factor gene functions as a pathogen-induced early-defense gene inCapsicumannuum[J].Plant Molecular Biology,2004,55:883-904.
[26]Ashraf M.Inducing drought tolerance in plants:recent advances[J].Biotechnology Advances,2010,28:169-183.
[27]Ashraf M,Foolad M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance[J].Environmental and Experimental Botany,2007,59:206-216.
[28]Shen Y G,Du B X,Zhang W K,etal.AhCMO,regulated by stresses inAtriplexhortensis,can improve drought tolerance in transgenic tobacco[J].Theoretical and Applied Genetics,2002,105:815-821.
[29]De Ronde J A,Cress W A,Krüger G H J,etal.Photosynthetic response of transgenic soybean plants,containing anArabidopsisP5CR gene,during heat and drought stress[J].Journal of Plant Physiology,2004,161:1211-1224.
[30]GubišJ,VaňkováR,ČervenáV,etal.Transformed tobacco plants with increased tolerance to drought[J].South African Journal of Botany,2007,73:505-511.
[31]Yamada M,Morishita H,Urano K,etal.Effects of free proline accumulation in petunias under drought stress[J].Journal of Experimental Botany,2005,56:1975-1981.
[32]Romero C,Bellés J M,VayáJ L,etal.Expression of the yeast trehalose-6-phosphate synthase gene in transgenic tobacco plants:pleiotropic phenotypes include drought tolerance[J].Planta,1997,201:293-297.
[33]Miranda J,Avonce N,Suárez R,etal.A bifunctional TPS-TPP enzyme from yeast confers tolerance to multiple and extreme abiotic-stress conditions in transgenicArabidopsis[J].Planta,2007,226:1411-1421.
[34]Karim S,Aronsson H,Ericson H,etal.Improved drought tolerance without undesired side effects in transgenic plants producing trehalose[J].Plant Molecular Biology,2007,64:371-386.
[35]Jang I C,Oh S J,Seo J S,etal.Expression of a bifunctional fusion of theEscherichiacoligenes for trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase in transgenic rice plants increases trehalose accumulation and abiotic stress tolerance without stunting growth[J].Plant Physiology,2003,131:516-524.
[36]Wu R,Garg A.Engineering rice plants with trehalose-producing genes improves tolerance to drought,salt,and low temperature[R].ISB News Report,2003.
[37]Abebe T,Guenzi A C,Martin B,etal.Tolerance of mannitol-accumulating transgenic wheat to water stress and salinity[J].Plant Physiology,2003,131:1748-1755.
[38]Karakas B,Ozias-Akins P,Stushnoff C,etal.Salinity and drought tolerance of mannitol-accumulating transgenic tobacco[J].Plant,Cell & Environment,1997,20:609-616.
[39]Wojtaszek P.Oxidative burst:an early plant response to pathogen infection[J].Biochemical Journal,1997,322:681-692.
[40]贾学静,董立花,丁春邦,等.干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响[J].草业学报,2013,22(5):248-255.
[41]Wang F Z,Wang Q B,Kwon S Y,etal.Enhanced drought tolerance of transgenic rice plants expressing apea manganese superoxide dismutase[J].Journal of Plant Physiology,2005,162:465-472.
[42]Mittler R,Zilinskas B A.Regulation of pea cytosolic ascorbate peroxidase and other antioxidant enzymes during the progression of drought stress and following recovery from drought[J].The Plant Journal,1994,5:397-405.
[43]Lee S H,Ahsan N,Lee K W,etal.Simultaneous overexpression of both Cu/Zn superoxide dismutase and ascorbate peroxidase in transgenic tall fescue plants confers increased tolerance to a wide range of abiotic stresses[J].Journal of Plant Physiology,2007,164:1626-1638.
[44]Luna C M,Pastori G M,Driscoll S,etal.Drought controls on H2O2accumulation,catalase(CAT)activity and CAT gene expression in wheat[J].Journal of Experimental Botany,2005,56:417-423.
[45]Shikanai T,Takeda T,Yamauchi H,etal.Inhibition of ascorbate peroxidase under oxidative stress in tobacco having bacterial catalase in chloroplasts[J].FEBS Letters,1998,428:47-51.
[46]Rizhsky L,Hallak-Herr E,Van Breusegem F,etal.Double antisense plants lacking ascorbate peroxidase and catalase are less sensitive to oxidative stress than single antisense plants lacking ascorbate peroxidase or catalase[J].The Plant Journal,2002,32:329-342.
[47]Munne-Bosch S.The role ofα-tocopherol in plant stress tolerance[J].Journal of Plant Physiology,2005,162:743-748.
[48]俞乐,刘拥海,周丽萍,等.干旱胁迫下结缕草叶片抗坏血酸与相关生理指标变化的品种差异研究[J].草业学报,2013,22(4):106-115.
[49]Akashi K,Miyake C,Yokota A.Citrulline,a novel compatible solute in drought-tolerant wild watermelon leaves,is an effi-cient hydroxyl radical scavenger[J].FEBS Letters,2001,508:438-442.
[50]Kusvuran S,Dasgan H Y,Abak K.Citrulline is an important biochemical indicator in tolerance to saline and drought stresses in melon[J].The Scientific World Journal,2013,8:11-55.
[51]Groppa M D,Benavides M P.Polyamines and abiotic stress:recent advances[J].Amino Acids,2008,34:35-45.
[52]刘义,张春梅,谢晓蓉,等.干旱胁迫对紫花苜蓿叶片和根系多胺代谢的影响[J].草业学报,2012,21(6):102-107.
[53]Alcázar R,Altabella T,Marco F,etal.Polyamines:molecules with regulatory functions in plant abiotic stress tolerance[J].Planta,2010,231:1237-1249.
[54]Alcázar R,Marco F,Cuevas J C,etal.Involvement of polyamines in plant response to abiotic stress[J].Biotechnology Letters,2006,28:1867-1876.
[55]Kasukabe Y,He L,Nada K,etal.Overexpression of spermidine synthase enhances tolerance to multiple environmental stresses and up-regulates the expression of various stress-regulated genes in transgenicArabidopsisthaliana[J].Plant and Cell Physiology,2004,45:712-722.
[56]Urano K,Yoshiba Y,Nanjo T,etal.Arabidopsisstress-inducible gene for arginine decarboxylase AtADC2is required for accumulation of putrescine in salt tolerance[J].Biochemical and Biophysical Research Communications,2004,313:369-375.
[57]Vaucheret H.Post-transcriptional small RNA pathways in plants:mechanisms and regulations[J].Genes & Development,2006,20:759-771.
[58]Sunkar R,Zhu J K.Novel and stress-regulated microRNAs and other small RNAs fromArabidopsis[J].Plant Cell,2004,16:2001-2019.
[59]Jones-Rhoades M W,Bartel D P.Computational identification of plant microRNAs and their targets,including a stress-induced miRNA[J].Molecular Cell,2004,14:787-799.
[60]Arenas-Huertero C,Perez B,Rabanal F,etal.Conserved and novel miRNAs in the legumePhaseolusvulgarisin response to stress[J].Plant Molecular Biology Reporter,2009,70:385-401.
[61]Liu H H,Tian X,Li Y J,etal.Microarray-based analysis of stress-regulated microRNAs inArabidopsisthaliana[J].RNA,2008,14:836-843.
[62]Lu S,Sun Y H,Chiang V L.Stress-responsive microRNAs in Populus[J].Plant Journal,2008,55:131-151.
[63]Yamaguchi-Shinozaki K,Shinozaki K.Organization of cis-acting regulatory elements in osmotic-and cold-stress-responsive promoters[J].Trends in Plant Science,2005,10:88-94.
[64]Wang W,Vinocur B,Altman A.Plant responses to drought,salinity and extreme temperatures:towards genetic engineering for stress tolerance[J].Planta,2003,218:1-14.
[65]Qin F,Sakuma Y,Li J,etal.Cloning and functional analysis of a novel DREB1/CBF transcription factor involved in cold-responsive gene expression inZeamaysL[J].Plant and Cell Physiology,2004,45:1042-1052.
[66]Novillo F,Alonso J M,Ecker J R,etal.CBF2/DREB1Cis a negative regulator of CBF1/DREB1Band CBF3/DREB1Aexpression and plays a central role in stress tolerance inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101:3985-3990.
[67]Pellegrineschi A,Reynolds M,Pacheco M,etal.Stress-induced expression in wheat of theArabidopsisthalianaDREB1A gene delays water stress symptoms under greenhouse conditions[J].Genome,2004,47:493-500.
[68]Oh S J,Song S I,Kim Y S,etal.ArabidopsisCBF3/DREB1AandABF3in transgenic rice increased tolerance to abiotic stress without stunting growth[J].Plant Physiology,2005,138:341-351.
[69]Aharoni A,Dixit S,Jetter R,etal.The SHINE clade of AP2domain transcription factors activates wax biosynthesis,alters cuticle properties,and confers drought tolerance when overexpressed inArabidopsis[J/OL].The Plant Cell Online,2004,16:2463-2480.
[70]Zhang J Y,Broeckling C D,Blancaflor E B,etal.Overexpression of WXP1,aputativeMedicagotruncatulaAP2domaincontaining transcription factor gene,increases cuticular wax accumulation and enhances drought tolerance in transgenic alfalfa(Medicagosativa)[J].The Plant Journal,2005,42:689-707.
[71]Guo Q,Zhang J,Gao Q,etal.Drought tolerance through overexpression of monoubiquitin in transgenic tobacco[J].Journal of Plant Physiology,2008,165:1745-1755.
[72]Quan R,Shang M,Zhang H,etal.Engineering of enhanced glycine betaine synthesis improves drought tolerance in maize[J].Plant Biotechnology Journal,2004,2:477-486.
[73]Vendruscolo E C G,Schuster I,Pileggi M,etal.Stress-induced synthesis of proline confers tolerance to water deficit in transgenic wheat[J].Journal of Plant Physiology,2007,164:1367-1376.
