加拿大一枝黄花水提液对玉米幼苗生长的化感作用及其机理
2014-01-02叶小齐吴明邵学新梁雷
叶小齐,吴明,邵学新,梁雷
(国家林业局杭州湾湿地生态系统定位研究站 中国林业科学研究院亚热带林业研究所,浙江 富阳311400)
化感物质对邻近植物生长的影响取决于其浓度。自然条件下,化感物质释放到土壤中后经微生物分解转化,浓度会逐渐降低[1],其化感作用强度会发生显著改变。因此有必要研究不同化感物质浓度对其他植物的影响。“低促高抑”(hormesis)效应是指某种有毒物质在高浓度时会抑制/毒害生物的生长,而在低浓度时却会起到促进的现象[2]。化感物质对植物生长的“低促高抑”效应是植物化感作用研究中经常观测到的现象[3]。有学者提出化感作用是外来植物物种入侵的“化学武器”[4]。但是仍然缺乏足够多的实验证据表明土壤中的化感物质达到了抑制其他植物生长的浓度阈值[4-5]。因此,研究入侵植物化感物质不同浓度对土著植物生长的影响具有重要意义。一些研究者发现在华东地区危害严重的入侵植物加拿大一枝黄花(Solidagocanadensis)具有较强的化感活性[6],其提取物对土著植物种子萌发和幼苗生长都表现出了显著的抑制作用[7-9]。进一步研究表明,加拿大一枝黄花提取物对土著植物生长在低的浓度范围内表现出促进作用,而在较高的浓度范围内则表现出抑制作用[10],这说明加拿大一枝黄花对土著植物生长的影响和其化感物质浓度紧密相关。
前人从不同角度对植物化感物质的“低促高抑”效应的机理进行了初步探索。Prithiviraj等[11]表明低剂量儿茶素(±)-catechin能够适度激发拟南芥(Arabidopsisthaliana)分生组织活性氧的产生从而刺激植物加速生长,因为活性氧是植物细胞伸展必不可缺的作用物质[12],而另外一些研究发现植物提取液处理能显著影响受体植物保护酶活性[10,13-14],因此保护酶活性的变化也可能是“低促高抑”的机制之一。与植物化感物质类似,除草剂草甘膦对一些植物生长也具有“低促高抑”效应,这是因为低浓度草甘膦能抑制植物莽草酸代谢途径,减少细胞壁中木质素的合成,增加植物细胞壁的伸展性,因而能促进植物的生长[15]。还有一些研究试图从光合能力的角度对“低促高抑”做出解释,Wiedman和Appleby[16]发现光合气体交换并不能解释几种除草剂低剂量处理对黄瓜(Cucumissativus)的生长促进作用;而Cedergreen和Olesen[17]却发现低剂量草甘膦在促进大麦(Hordeumvulgare)生长的同时,的确也刺激了其光合能力的提高。这些不同发现是不同角度不同层次研究的结果,彼此不一定相互矛盾。从构成植物的生长速率的要素来看,相对生长速率(relative growth rate,RGR)同时取决于单位叶面积净同化速率(net assimilation rate,NAR)和对叶面积形成的资源投入(leaf area ratio,LAR)。前者主要取决于植物单位叶面积的光合能力,是内在的生理因素,而后者则指植物形成所有具有光合能力叶片面积所投入的资源比例,是植物对光合器官(叶)生物量分配(leaf mass ratio,LMR)和单位叶生物量所能建造的叶面积(specific leaf area,SLA)的共同作用的结果[18],因此低浓度下较快的生长既可能是较高的光合速率的结果,也可能是光合组织资源分配增加的结果。
Zhang等[10]报道了加拿大一枝黄花地下茎提取物的“低促高抑”现象,对其机理做了初步探讨,但没有从光合生产的角度解释该效应。本文于2011年研究了加拿大一枝黄花提取物对受体植物生长、光合能力和对叶的资源分配的变化,拟明确加拿大一枝黄花水提液对受体植物生长的影响与光合能力还是与叶资源分配相关。在加拿大一枝黄花危害严重的华东地区,弃荒地生长的加拿大一枝黄花往往严重抑制和影响玉米等后续作物的生长和产量[19],因此本研究以玉米(Zeamays)幼苗为受体植物材料。
1 材料与方法
1.1 加拿大一枝黄花水提液制备
野外采集加拿大一枝黄花的枝条,去掉花序后,剪成8mm的小段,按照1g枝条∶4mL纯净水,置于烧杯中提取。整个提取过程室温下进行,提取时间48h。
1.2 玉米幼苗培养和提取液添加处理
所用玉米品种是美玉(加甜糯)8号,在9mm培养皿中萌发。萌发14d后,选取长势基本一致的玉米幼苗(含1片子叶和2片展开的真叶),移栽到容积为180mL塑料杯中,每个塑料杯定植1棵,生长基质为150~180 μm粒径的石英砂。培养7d后,开始进行添加加拿大一枝黄花水提液的处理。
实验采用随机区组设计,共设置12个水提液浓度处理,分别是0.00,0.02,0.04,0.06,0.09,0.11,0.13,0.15,0.18,0.20,0.22和0.25g/mL,每个浓度处理重复6次。培养期间每隔3d更换1次营养液和水提液,营养液按照1倍浓度的Hoagland营养液配方进行配制[20],种子萌发、幼苗培养和水提液处理均在智能光照培养箱中进行,日照/黑夜时间分别是12h/12h,白天温度24℃,黑夜温度18℃。培养期间,玉米幼苗生长良好。
1.3 光合作用测定和光合响应曲线模拟
观察和初步测量发现,0.02g/mL浓度处理对玉米幼苗生长的促进效应最大,而0.20g/mL浓度处理对玉米幼苗生长的抑制效应最大,因此,这2种浓度可以分别作为促进生长和抑制生长的浓度处理的代表,与水提液浓度为0.00g/mL的对照处理作比较,研究其光合特性的变化。在开始处理后的第1~3天后,用LI-6400便携式光合仪测定0.00,0.02和0.20g/mL三种浓度处理下的玉米幼苗光合光响应曲线。使用红蓝光源和开路系统测定叶片的净光合速率,空气流速为0.5L/min。测定从2000μmol/(m2·s)开始,依次降为1800,1500,1000,500,300,100,50,0,每个浓度处理每天测定3株,每株测定倒数第1片完全展开叶。测定之前每株玉米苗在2000μmol/(m2·s)光强下活化15min。参照Lewis等[21]的方法,采用下列模型进行光合作用的光响应曲线的模拟:
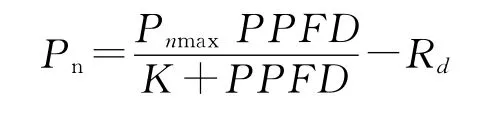
光合响应曲线用SPSS统计软件中的Nonlinear模型拟合。其中Pn是每个测量光强下的净光合速率;Pnmax是最大净光合速率;PPFD是光合有效辐射强度;K是光饱和常数,其值为光合速率为1/2Pnmax时所对应的光合有效辐射强度;表观量子效率(apparent quantum efficiency,AQY)是光响应曲线起始斜率(光强为0~300μmol/m2·s);Rd是暗呼吸速率。
1.4 玉米幼苗生长和生物量分配测定
处理结束后,收获所有玉米幼苗,用水洗净根部。用直尺测量植株的高度,用Microtek扫描仪分别扫描每棵植株的叶子和根部,用根系分析软件WinRHIZO Pro分析总叶长、总叶面积和总根长。测定完毕后,分别称量每个植株的总鲜重以及根、茎和叶各自的鲜重。水提液对玉米幼苗生长的促进或者抑制效应的计算方法是:[(某浓度下的玉米生长指标平均值-对照处理玉米生长指标的平均值)/对照处理玉米生长指标的平均值]×100%。如果该值为正值,表明该浓度处理对玉米生长起到了促进作用,反之则为抑制作用。参照Hunt和Cornelissen[22]的方法计算LMR,SLA和LAR:
LMR=单株总叶生物量/单株总生物量
SLA=单株总叶面积/单株总叶生物量
LAR=单株总叶面积/单株总生物量
1.5 数据分析
取每个处理6个重复植株测量值的平均值代表该处理的结果,以水提液浓度作为自变量,玉米幼苗生长和光合特性的各个指标作为变量,进行单因素方差分析和多重比较,以分析水提液浓度对玉米幼苗生长和光合作用各个指标的影响。同时用玉米全株生物量作为自变量,LMR,SLA和LAR分别作为因变量,分别对玉米全株生物量及LMR,SLA和LAR进行回归分析,检验回归分析的显著性。所有的统计分析均在SPSS中进行。
2 结果与分析
结果表明,加拿大一枝黄花水提液对玉米幼苗的生长和生物量都有影响(图1和图2),其中对玉米幼苗的株高(P<0.001)、总叶长(P=0.01)、总叶面积(P<0.05)和总根长(P<0.001)的影响达到了显著水平,而对玉米各器官生物量和总生物量没有达到显著水平(P>0.05)。不同水提液浓度对玉米幼苗的生长影响不同。总体而言,水提液浓度在0.02~0.11g/mL范围内都对玉米各生长指标起到了促进作用,即相应的生长指标要高于不添加水提液的对照处理;而水提液浓度在0.13~0.25g/mL范围内都对玉米各生长指标起到了抑制作用,即相应的生长指标值都要低于对照(图1和图2)。进一步分析发现,水提液对玉米幼苗的总根长和根生物量的促进或者抑制作用最大,最高分别达到了29.4%,20.5%和49.5%,18.2%,其次是总叶面积,最高达到了20.8%和30.8%。水提液处理对LAR和SLA有显著影响(P<0.05),并且LAR和SLA随着水提液浓度变化同样表现出“低促高抑”效应(图3),而LMR随着浓度变化则没有明显的变化规律(P>0.05,图3)。回归分析表明,处理结束时玉米幼苗总生物量同LAR和SLA之间存在着显著的相关关系(P<0.001,图4),而和LMR相关关系不显著(P>0.05,图4)。
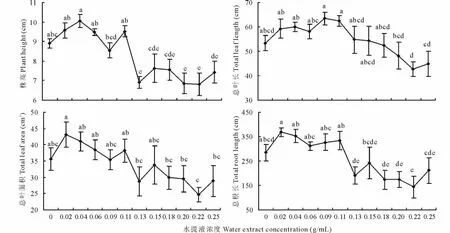
图1 不同浓度加拿大一枝黄花水提液处理后玉米幼苗的株高、总叶长、总叶面积和总根长Fig.1 Plant height,total leaf length,total leaf area and total root length of the maize seedlings treated with different concentration of water extract from S. canadensis

图2 不同浓度加拿大一枝黄花水提液处理下玉米幼苗茎、叶、根和全株鲜重生物量Fig.2 Biomass(fresh weight)of stem,leaf,root,and whole plant of the maize seedling treated with different concentration of water extract from S. canadensis

图3 不同加拿大一枝黄花水提液浓度处理下玉米幼苗的叶生物量分配、比叶面积和叶面积率Fig.3 SLA,LMR and LAR of the maize seedling treated with different concentration S. canadensis water extract
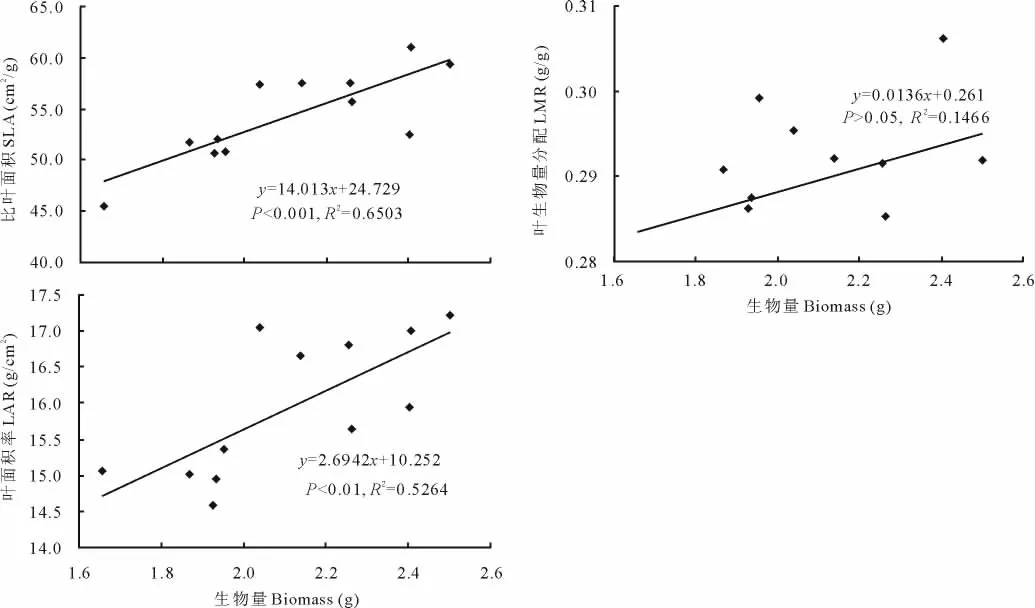
图4 比叶面积(SLA)、叶生物量分配(LMR)和叶面积率(LAR)与玉米幼苗生物量的回归分析Fig.4 Regression of LMR,SLA and LAR against the biomass of the maize seedlings treated with different concentrations of water extract from S. canadensis

图5 不同浓度水提液处理后1~3d玉米幼苗的光合特性Fig.5 Photosynthesis characteristic of the maize seedling treated with three water extract concentration from S. canadensis
对0.00,0.02,0.20g/mL三种浓度处理的玉米幼苗的光合-光响应曲线进行分析,不同水提液浓度对Pnmax和AQY没有显著影响(P>0.05),而对Rd有显著影响(P<0.05)。Pnmax和AQY在开始处理的1~3d内先上升后下降,但各处理之间没有显著差异(P>0.05,图5);Rd则呈下降趋势,0.02g/mL浓度处理的玉米幼苗的Rd高于0.20g/mL浓度处理和对照处理,但没有显著差异(图5)。
3 讨论
本研究结果表明,加拿大一枝黄花水提液对玉米幼苗生长表现出了“低促高抑”作用,即在较低的浓度范围内会促进其生长,而在较高的浓度范围内会抑制其生长;这种浓度效应和玉米幼苗对叶生长的资源分配有关,而与植物单位叶面积的光合能力无关。低浓度处理的玉米幼苗LAR和SLA较高,这表明有更多的资源分配给叶,增加了植株总的光合面积与总生物量的比例,促进了植株总体同化效率的提高[23]。提高植物单位叶面积的光合能力也能促进植物的生长,但本实验中不同浓度处理之间的Pnmax和AQY没有显著差异,说明不同处理玉米叶片对不同强度的光合有效辐射的利用能力接近。植物的单位叶面积光合能力主要和叶片氮含量和Rubsico酶(1,5-二磷酸核酮糖羧化酶/加氧酶)的活性有关[24],而较高的氮含量和Rubsico酶需要消耗更多能量,不利于植物生长。低浓度处理的玉米幼苗并没有减少其呼吸消耗,反而比对照植株和高浓度处理植株具有更高的Rd,这和低浓度草甘膦增加大麦暗呼吸速率的结果一致[17],可能与低浓度处理下其更强的生长活性有关。但是与本研究结果不同,一些研究表明化感物质能显著影响植物的光合能力[25],说明不同化感物质作用方式不尽相同。
化感物质对植物生长的促进可能和细胞,特别是和叶肉组织细胞的伸展性改变有关。Niemann等[26]发现生长速率较快的单子叶物种半纤维素、纤维素和木质素等细胞壁物质较少,因而细胞壁更容易扩展。草甘膦对植物生长也具有“低促高抑”效应,可能是因为在低浓度下草甘膦能抑制莽草酸途径,并进一步抑制木质素的合成,从而使植物细胞壁具有更大的伸展性[15]。也有研究认为活性氧分子是实现植物细胞伸展的必要因子[12],而低浓度的化感物质可能激发了适量活性氧分子的产生[11],因而促进了植物细胞的伸展。实验结果也表明在低浓度水提液处理条件下,玉米幼苗叶片SLA较大,叶片较薄,可能是木质素等细胞壁物质含量减少,因而生长速率提高。
加拿大一枝黄花水提液的“低促高抑”效应的生态学意义目前还并不清楚。有研究者认为在低水平有毒物质作用下,植物体不可能所有性状都会表现出促进效应,因此,植物体总的适合性不大可能会得到提高[27],但是“低促高抑”效应至少在植物生活史的某一阶段的某一适应性方面具有重要的生态学意义。化感作用是植物种间相互作用的重要途径[3],土壤中化感物质的浓度可能是受体植物感知施加者胁迫能力的一种信号[28]。低浓度的化感物质可能意味着化感作用施加者胁迫能力较弱,受体植物对此作出适应性的反应:通过增加对光合叶面积的相对投入提高生长速率,并增强竞争能力;高浓度的化感物质可能表明化感作用施加者胁迫能力较强,因此受体植物会减缓生长速率,降低生长消耗,提高其存活率。植物竞争的重要资源之一是光照,而光竞争的表现形式之一是相邻植株之间互相遮阴[29]。与低浓度的化感物质作用相似,遮阴也能增加对地上部分光合器官的投入,增加比叶面积,从而保持一定的光合效率[30]。植物对化感物质的响应是否与对邻株遮阴的响应具有相似的机理还需要进一步研究。
4 结论
加拿大一枝黄花不同浓度水提液对玉米幼苗生长的影响和对叶的资源分配有紧密关系,而与单位叶面积光合能力无关。低浓度水提液提高玉米幼苗叶的SLA和植株的LAR,在保持单位叶面积光合能力不变的条件下促进了植株的生长,而高浓度水提液对玉米幼苗SLA和LAR的影响相反,从而抑制了植株的生物量积累。综合本研究和其他研究的结果来看,化感物质对受体植物生长的“低促高抑”效应具有普遍性,因此可能在种间相互作用过程中具有一定的生态学意义。
[1]Teasdale J R,Rice C P,Cai G,etal.Expression of allelopathy in the soil environment:soil concentration and activity of benzoxazinoid compounds released by rye cover crop residue[J].Plant Ecology,2012,213(12):1893-1905.
[2]Calabrese E J,Baldwin L A.U-Shaped dose-responses in biology,toxicology and public health[J].Annual Review of Public Health,2001,22(1):15-33.
[3]孔垂华,胡飞.植物化感(相生相克)作用及其应用[M].北京:中国农业出版社,2001.
[4]Duke S O,Blair A C,Dayan F E,etal.Is(-)-Catechin a novel weapon of spotted knapweed(Centaureastoebe)?[J].Journal of Chemical Ecology,2009,35(2):141-153.
[5]Thorpe A S,Thelen G C,Diaconu A,etal.Root exudate is allelopathic in invaded community but not in native community:field evidence for the novel weapons hypothesis[J].Journal of Ecology,2009,97(4):641-645.
[6]沈荔花.外来植物加拿大一枝黄花(SolidagocanadensisL.)入侵的化感作用机制研究[D].福州:福建农林大学,2007.
[7]方芳,郭水良,黄林兵.入侵杂草加拿大一枝黄花的化感作用[J].生态科学,2004,23(4):331-334.
[8]梅玲笑,陈欣,唐建军.外来杂草加拿大一枝黄花对入侵地植物的化感效应[J].应用生态学报,2005,16(12):2379-2382.
[9]郭琼霞,陈颖,沈荔花,等.加拿大一枝黄花对豆类和蔬菜的化感作用研究[J].检验检疫科学,2006,16(6):10-12.
[10]Zhang S S,Wang B,Zhang L,etal.Hormetic-like dose response relationships of allelochemicals of invasiveSolidagocanadensisL.[J].Allelopathy Journal,2012,29(1):151-160.
[11]Prithiviraj B,Perry L G,Badri D V,etal.Chemical facilitation and induced pathogen resistance mediated by a root-secreted phytotoxin[J].New Phytologist,2007,173(4):852-860.
[12]Rodríguez A A,Grunberg K A,Taleisnik E L.Reactive oxygen species in the elongation zone of maize leaves are necessary for leaf extension[J].Plant Physiology,2002,129(4):1627-1632.
[13]张志忠,石秋香,孙志浩,等.入侵植物空心莲子草对生菜和萝卜的化感效应[J].草业学报,2013,22(1):288-293.
[14]胡远彬,陈俊,肖天昊,等.劲直黄芪水浸提液化感作用研究[J].草业学报,2013,22(6):136-142.
[15]Duke S O,Cedergreen N,Velini E D,etal.Hormesis:is it an important factor in herbicide use and allelopathy?[J].Outlooks on Pest Management,2006,17(1):29-33.
[16]Wiedman S J,Appleby A P.Plant growth stimulation by sublethal concentrations of herbicides[J].Weed Research,1972,12(1):65-74.
[17]Cedergreen N,Olesen C F.Can glyphosate stimulate photosynthesis?[J].Pesticide Biochemistry and Physiology,2010,96(3):140-148.
[18]Poorter H.Interspecific variation in relative growth rate:on ecological causes and physiological consequences[A].In:Lambers H,Cambridge M L,Konings H,etal.Causes and Consequences of Variation in Growth Rate and Productivity of Higher Plants[M].Dordrecht(the Netherlands):SPB Academic,1990:45-68.
[19]柳福春,李涛,管丽琴,等.加拿大一枝黄花与玉米互作影响的研究[J].上海农业学报,2010,26(4):80-82.
[20]武维华.植物生理学(第2版)[M].北京:科学出版社,2008.
[21]Lewis J D,Olszyk D,Tingey D T.Seasonal patterns of photosynthetic light response in Douglas-fir seedlings subjected to elevated atmospheric CO2and temperature[J].Tree Physiology,1999,19(4-5):243-252.
[22]Hunt R,Cornelissen J H C.Components of relative growth rate and their interrelations in 59temperate plant species[J].New Phytologist,1997,135(3):395-417.
[23]Poorter L.Growth responses of 15rain-forest tree species to a light gradient:the relative importance of morphological and physiological traits[J].Functional Ecology,1999,13(3):396-410.
[24]Evans J R.Photosynthesis and nitrogen relationships in leaves of C3plants[J].Oecologia,1989,78(1):9-19.
[25]李羿桥,李西,胡庭兴.巨桉凋落叶分解对假俭草生长及光合特性的影响[J].草业学报,2013,22(3):169-176.
[26]Niemann G J,Pureveen J B M,Eijkel G B,etal.Differential chemical allocation and plant adaptation:a Py-MS study of 24 species differing in relative growth rate[J].Plant and Soil,1995,175(2):275-289.
[27]Forbes V E.Is hormesis an evolutionary expectation?[J].Functional Ecology,2000,14:12-24.
[28]孔垂华,胡飞.植物化学通讯研究进展[J].植物生态学报,2003,27(4):561-566.
[29]Craine J M,Dybzinski R.Mechanisms of plant competition for nutrients,water and light[J].Functional Ecology,2013,27(4):833-840.
[30]Niinemets.A review of light interception in plant stands from leaf to canopy in different plant functional types and in species with varying shade tolerance[J].Ecological Research,2010,25(4):693-714.
