单播与混播下紫花苜蓿与无芒雀麦生物量对氮肥的响应
2014-01-02谢开云李向林何峰万里强王栋秦燕余群
谢开云,李向林*,何峰,万里强,王栋,秦燕,余群
(1.中国农业科学院北京畜牧兽医研究所,北京100193;2.兰州大学草地农业科技学院,甘肃 兰州730020)
豆科和禾本科牧草的混播草地,以其较高的生产力、较好的营养搭配和经济有效的氮素来源而长期受到人们的重视。多年生禾本科和豆科牧草的混播人工草地,不仅可以提高单位面积的产草量和蛋白质含量[1-4],还能增加土壤中的氮素养分,提高土壤肥力[5-7],减少工业氮肥的施用[8],使得生产成本降低[9],环境污染更少。更重要的是,豆科植物可以通过自身根瘤菌固定空气中的氮素,其固定的氮素除了一部分供自身生长需要,还可以为混播草地中伴生的禾本科牧草提供氮素营养。尽管豆-禾混播草地表现出众多优越性,但这种优越性能否在生产实践中持续存在,是豆-禾混播草地能否发挥优良生产性能和生态稳定性的基础。禾草与豆科牧草之间存在着养分、水分、光照和空间等资源方面的竞争,竞争的结果将出现一方逐渐消退,另一方逐渐占据优势的现象[10]。在豆禾混播草地中,氮素在平衡禾本科牧草和豆科牧草竞争力中发挥重要作用[11]。2种牧草混播时,随着土壤有效氮的变化,在豆禾混播草地中豆禾牧草生物量也随之发生变化[12]。目前,现有的文献已经证明了禾草生物量与土壤有效氮含量具有正相关关系[12],但是仍然不能确定豆科牧草的生物量是否和氮肥梯度之间具有一致性和同步性。在国内对混播草地的研究主要集中在混播草地品种搭配、混播比例、种植方式以及混播的群落特征等方面的研究上[13-14],而关于混播中豆科和禾本科牧草对氮素的响应机制的研究甚少。因此,本实验通过温室大棚栽培试验,采用了在整个牧草生育期内动态取样的方法,研究不同氮肥梯度下无芒雀麦(Bromusinermis)与紫花苜蓿(Medicagosativa)在单播和混播模式下的地上和地下生物量响应机制,以便为今后牧草栽培提供理论参考。
1 材料与方法
1.1 试验材料
供试材料为无芒雀麦和紫花苜蓿(三得利品种),由北京百绿公司提供。试验所采用的容器为塑料桶,直径29cm,高度35cm,装风干土22kg/盆。
供试土壤为粘土,取自北京郊区废弃地0~35cm,土壤田间持水量为26.04%,容重为1.28g/cm3。理化性质为:土壤有机质9.18g/kg,pH 值为7.68,全氮0.778g/kg,碱解氮57.25mg/kg,硝态氮24.89mg/kg,铵态氮5.04mg/kg,全磷0.69g/kg,速效磷11.70mg/kg,全钾18.96g/kg,速效钾113.32mg/kg。
供试肥料:磷肥为化学纯过磷酸钙(P2O5为14%~15%),用量3.52g/盆;钾肥为分析纯硫酸钾(K2SO4≥99.0%),用量1.21g/盆;磷肥和钾肥均在播种之前与基质土混匀。微肥施用硼砂(计2.5kg B/hm2),硫酸锌(1 kg Zn/hm2),钼酸铵(0.2kg Mo/hm2),配成溶液均匀地淋撒在基质土壤中。氮肥为标记15N 尿素(购于上海化工研究院)。用分析天平称Xg丰度为10% 的15N标记尿素CO(15NH2)2并溶于100mL无离子水中,将此溶液浇到花盆基质上,混合均匀,使其标记肥渗入土壤。每盆用黑色的塑料纸附在表面避免氮素的挥发。
1.2 实验设计
实验采用二因素完全随机区组设计,氮肥因素设置0,75,150kg N/hm2三个水平,分别记作N0、N75、N150。播种方式为无芒雀麦单播,紫花苜蓿单播,紫花苜蓿和无芒雀麦混播,记作G-G,L-L,G-L,共9个处理。设置12个重复区组。每盆定4株,单播时等距分布,混播时豆禾1∶1保持对角分布。
利用土壤含水量测定仪(WET Sensor HH2)测定混播中的土壤表层8cm的体积含水量,均值低于15%时,对所有处理浇1500mL自来水。对每盆内杂草和病虫害进行严格控制。
1.3 测定指标与方法
生物量测定:分4次刈割(2013年4月5日,5月25日,7月6日和8月17日),称其鲜重,混播时分离无芒雀麦和紫花苜蓿,并在65℃烘箱内烘至恒重,测定紫花苜蓿和无芒雀麦地上干物质重量;然后在每次刈割后随机取3个重复区组(取样3次,分别在4月5日,5月25日和8月17日,其中7月6日未取根),分离每盆中无芒雀麦和紫花苜蓿的根系,用水冲洗干净,在65℃下烘箱内烘至恒重,测无芒雀麦和紫花苜蓿的地下干物质重量。
1.4 数据统计与分析
采用GraphPad Prism 5软件作图,SAS 9.0软件进行统计分析。用单因素方差分析法分析3个氮肥梯度对无芒雀麦和紫花苜蓿单播和混播下地上和地下单株生物量和总生物量的差异显著性。用配对法T检验来分析混播与单播下无芒雀麦单株生物量和总生物量以及紫花苜蓿的单株生物量和总生物量差异显著性。
2 结果与分析
2.1 施氮对地上生物量的影响
不论是单播还是混播,无芒雀麦的单株地上生物量都随着施氮量的增加而极显著增大(P<0.0001,图1和表1)。但紫花苜蓿与之不同,在相同的条件下,随着施氮量的增加,除在混播下第2次取样的紫花苜蓿单株地上生物量显著减低(P<0.05,图1和表1)之外,其他3次刈割时紫花苜蓿的单株地上生物量单播和混播无显著差异(P>0.05,图1和表1)。在混播中紫花苜蓿的单株地上生物量随着施氮量增加显著减低的原因是因为无芒雀麦的单株地上生物量显著的增加(图1),在空间和养分的获取上具有竞争优势。就混播来讲,在整个取样过程中,随着生育期的推进,无芒雀麦的单株地上生物量逐渐下降,且施肥量越大,单株地上生物量也越大。相反,紫花苜蓿的单株地上生物量逐渐增加,施肥量越大,其值越小(图1)。
除最后1次(P>0.05)刈割外,无芒雀麦单株地上生物量在混播时显著高于单播(P<0.05)。相反,紫花苜蓿的单株地上生物量单播显著高于混播(P<0.05,图1和表2)。
在3个氮肥梯度下,G-G地上总的生物量4次取样平均值分别为36.26,53.36,62.30g/盆;L-L分别为62.96,66.51,66.25g/盆;G-L分别为51.62,59.49,66.62g/盆;显而易见,G-L总的生物量介于 G-G和L-L生物量之间,但高于G-G和L-L的平均生物量(分别为49.61,59.94,64.27g/盆)。另外,G-G,G-L和L-L的总生物量的相对大小在整个生育期总是处于动态的变化中。如,在第1次取样时,G-G总的地上生物量和G-L总的地上生物量极显著地高于L-L总的生物量(P<0.01)。在随后的4次取样中,L-L总的生物量显著高于G-L总的生物量(P<0.01),也显著高于G-G总的生物量(P<0.01,图2和表2)。

图1 不同施氮量对单播与混播模式下无芒雀麦和紫花苜蓿单株地上生物量的影响Fig.1 The effect of different N application rate on smooth brome and alfalfa single plant above-biomass in monoculture and mixture
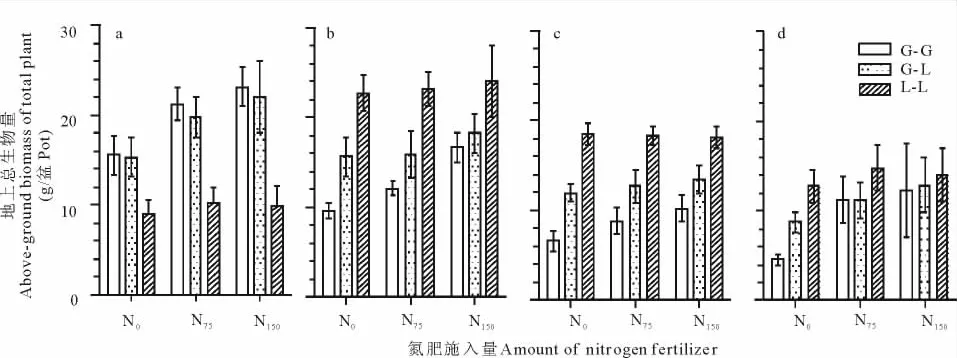
图2 不同施氮量对单播与混播模式下无芒雀麦和紫花苜蓿总地上生物量的影响Fig.2 Effect of different N application rate on total above-biomass of smooth brome and alfalfa in monoculture and mixture
2.2 施氮对地下生物量的影响
单播时,随着氮肥施入量的增加,无芒雀麦的单株地下生物量在第1次取样时极显著增加(P<0.01),而第2次(P>0.05)和第3次取样差异不显著(P>0.05)。混播时均无显著差异(P>0.05)。而对紫花苜蓿来讲,不论是单播还是混播,随着施氮量的增加,紫花苜蓿的根系生物量无显著差异(P>0.05,图3和表3)。

表1 单播与混播下地上生物量方差检验Table 1 The results of variance analysis of above-ground biomass in monoculture and mixture

表2 单播与混播下地上生物量的 T检验Table 2 T-test results of above-ground biomass in monoculture and mixture
前2次取样时,无芒雀麦单株地下生物量混播时显著高于单播(P<0.001),而第3次取样单播与混播下单株地下生物量均无显著差异(P>0.05,图3和表4)。主要原因可能是:1)由于植物对土壤氮素的消耗,土壤中氮素逐渐减少,无芒雀麦没有了竞争优势。2)由于紫花苜蓿的地下生物量增加挤占了无芒雀麦的空间,导致无芒雀麦的地下生物量下降。与无芒雀麦不同的是,紫花苜蓿的单株地下生物量单播显著高于混播(P<0.01)。

图3 不同施氮量对单播与混播模式下无芒雀麦和紫花苜蓿单株地下生物量的影响t of different N application rate on smooth brome and alfalfa single plant below-biomass in monoculture and mixture

表3 单播与混播中地下生物量方差分析检验Table 3 Results of variance analysis of below-ground biomass in monoculture and mixture
从3次取样来看,G-G的总地下生物量与G-L的总地下生物量无显著差异(P>0.05)。但L-L的总地下生物量极显著低于G-G总的地下生物量(P<0.001),也极显著低于G-L的总地下生物量(P<0.001,图4和表4)。
3 讨论
在草地生态系统中,氮素是牧草产量的一个重要的限制因子。而氮肥的施用是提高牧草产量的有效手段之一,有关氮肥对牧草产量影响的报道已有很多。一般来说,土壤中有效氮的含量总是不能满足禾本科牧草高产需要的,即使土壤中有机态N的含量较高或很高,但往往受到微生物的分解和矿化作用的限制,有效氮仍感不足。因而,要获得禾草的高的生物量和氮产量,在牧草生长期施氮肥是非常必要的。另外,禾草对有效氮的竞争胜过豆科植物[15],施氮能显著的增加禾本科牧草的产量,这一结论在本实验中也得到了验证。很多关于施氮肥对紫花苜蓿的影响的研究得出不同的结论。争议的焦点主要集中在三方面:一方面认为苜蓿在幼苗阶段或刈割以后,根瘤菌的固氮作用比较弱,苜蓿需要从土壤中吸收大量的矿质氮以满足其生理需求,此时施入氮肥会显著提高苜蓿的产量[16-17]。另一方面则认为,苜蓿具有共生根瘤菌,能固定空气中的氮素足以满足自身需求,因此不需要施入氮肥[18-19]。施氮对苜蓿产量不但没有增产作用,反而会抑制其生长[20-22],理由为对苜蓿草地施入氮肥,增大了对氮肥敏感的禾草类杂草入侵的机会。第三方面认为施氮肥对苜蓿无显著效应,通常是由于土壤供氮能力、pH值、根瘤的有效性、杂草防治等方面的差异所致[23]。Jenkins和Bottomley[16]开展的苜蓿施氮肥试验,分别在播种时、第1次刈割和第2次刈割后分3次施入230kg/hm2氮肥,结果显示第1茬和第2茬刈割产量施氮与不施氮无显著差异,而第3茬刈割产量差异显著。主要是因为土壤氮和根瘤固氮能够满足苜蓿前2茬的生长需求,而第3茬草生长时根瘤固氮能力减弱,需要额外施加氮肥。而郭海明等[24]对苜蓿与禾草混播草地进行氮肥试验,研究指出施氮肥只能增加禾草的产量,而不能增加苜蓿的产量,施入过多的氮肥,可能促进禾草的竞争力,导致混播草地中苜蓿的生物量下降,这与本实验结论一致。
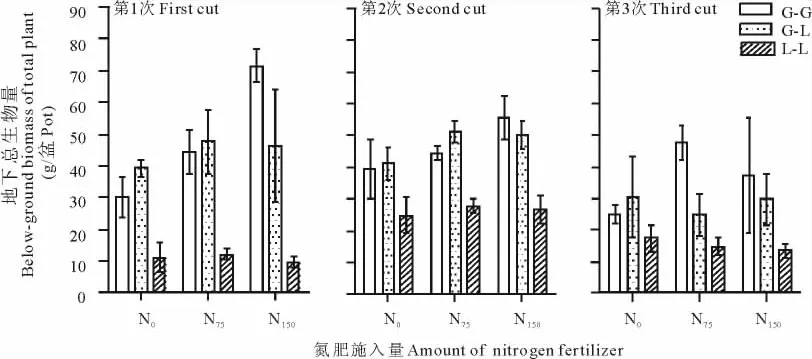
图4 不同施氮量对单播与混播模式下无芒雀麦和紫花苜蓿总的地下生物量的影响ect of different N application rate on total below-biomass of smooth brome and alfalfa in monoculture and mixture

表4 单播与混播下地下生物量T检验Table 4 T-test results of below-ground biomass in monoculture and mixture
氮肥对豆禾混播系统的影响是一个复杂的过程。在养分竞争方面,禾草需氮/豆科供氮这一关系与其他因子的竞争关系不同,禾本科牧草和豆科牧草对氮素没有明显的竞争性[25]。把每盆中4株植物与盆内土壤的组合看作是一个微小的生态系统,在无芒雀麦或者紫花苜蓿的单播中只有种内的竞争,而在无芒雀麦和紫花苜蓿的混播中不但有种内的竞争也存在种间竞争。无芒雀麦的单株地上生物量在单播时平均为3.18g/株,在混播时平均为5.25g/株,在混播中是单播中的1.65倍;而紫花苜蓿单株地上生物量在混播中平均为2.16g/株,在单播中平均为4.08g/株,混播只有单播的53%。另外,无芒雀麦的根系干物质重量在单播时平均为10.96g/株,而在混播中平均为17.85g/株,是单播的1.69倍;相反,紫花苜蓿的根系干物质重量在单播系统中平均为4.35g/株,在混播中平均为2.15g/株,仅为单播的49.4%。总之,无芒雀麦的单株生物量在混播模式下显著高于单播,而紫花苜蓿的单株生物量在混播模式下显著低于单播。这是因为豆科和禾本科牧草生态位具有差异[26]。在一定的生长空间内,它们之间的竞争优势主要表现为根系对土壤养分和空间的竞争。混播效应的主要有3种结果:积极的促进作用,消极的抑制作用,无效应[27-28]。在这个系统中对于无芒雀麦而言,混播效应表现为积极的促进作用。而紫花苜蓿却相反,种间竞争要大于种内竞争,混播效应表现为消极的抑制作用。但是在这一过程中无芒雀麦的混播优势是否得益于:1)无芒雀麦在与紫花苜蓿的混播中具有较强的竞争力。2)在与紫花苜蓿的混播中是否得益于紫花苜蓿的生物固氮及转移,这需要再进一步的研究。但是,可以确定的是紫花苜蓿的生物量在单播中显著高于混播是由于在混播中无芒雀麦对其的抑制作用要大于它的种内抑制。
豆科植物和非豆科植物间作时,豆科植物的生长和产量都将增加,豆禾间作的生产力要高于两种豆科或者2种非豆科间作[29]。但Sturludóttir[30]研究表明,大多数的混播产量都达到了单播平均值的1.7倍,高产单播种的0.88倍。正如Trenbeith[31]报道的混播草地的产量一般都位于2种单播模式产量的均值之上,本研究结果为混播的产量都会小于高产单播的产量,但是会高于2种牧草单播的平均值,这和Cardinale等[32]分析了44个混播实验得出的结论一致。相比较单播的草地,有豆科参与的混播草地在资源利用上的互补性增加了总的生物量,尤其是根系生物量[33]。本研究结果为无芒雀麦的根系生物量在混播中比单播中要高,但是紫花苜蓿却相反,它表现为在单播中的生物量要比混播中高。另外,研究中发现,紫花苜蓿对氮肥没有强烈的竞争,但也有研究认为紫花苜蓿对氮具有强烈的竞争[34-35]。
从整个取样的过程来看,土壤中矿质氮肥的施入促进了混播中无芒雀麦的生物量的增加,并竞争有效资源(包括养分和空间)限制了紫花苜蓿的生长[12,36-39]。随着生育期的推进,土壤中的氮素逐渐减少,混播中的无芒雀麦的竞争优势逐渐下降,而紫花苜蓿的生物量逐渐增加[11],这一现象在图1中可以得到证实。由此可见,在无芒雀麦和紫花苜蓿的混播中,无芒雀麦和紫花苜蓿的生长处于动态的消长中,这种变化是通过土壤无机氮的水平来调控。土壤中高的无机氮含量增强了无芒雀麦牧草的竞争力,间接地抑制了紫花苜蓿的生长,在图1中可见;相反,土壤中无机氮含量低,禾本科牧草没有了竞争优势,豆科牧草会在混播草地中占优势。
4 结论
1)在单播时,无芒雀麦对氮肥的响应较敏感,施入氮肥显著的提高无芒雀麦的生物量,而对紫花苜蓿的生物量无显著的影响。在混播时,无芒雀麦对有效氮的竞争胜过紫花苜蓿,施氮能显著的增加混播中无芒雀麦牧草的生物量,间接的抑制了紫花苜蓿的生物量的发展。
2)在混播系统中,无芒雀麦混播效应表现为积极的促进作用。而紫花苜蓿却相反,混播效应表现为消极的抑制作用。
3)无芒雀麦和紫花苜蓿混播的生物量介于它们单播时生物量之间,却高于它们单播时生物量的平均值。
4)在无芒雀麦和紫花苜蓿的混播中,无芒雀麦和紫花苜蓿的生长处于动态的变化中,这种变化由土壤无机氮的水平来调控。
[1]Bowren K,Cooke D,Downey R.Yield of dry matter and nitrogen from tops and roots of sweetclover,alfalfa and red clover at five stages of growth[J].Canadian Journal of Plant Science,1969,49(1):61-68.
[2]Dilz K,Mulder E.Effect of associated growth on yield and nitrogen content of legume and grass plants[J].Plant and Soil,1962,16(2):229-237.
[3]Kilcher M,Heinrichs D.The performance of three grasses when grown alone,in mixture with alfalfa,and in alternate rows with alfalfa[J].Canadian Journal of Plant Science,1958,38(2):252-259.
[4]McCloud D E,Mott G O.Influence of association upon the forage yield of legume-grass mixtures[J].Agronomy Journal,1953,45(2):61-65.
[5]Agboola A A,Fayemi A A.Fixation and excretion of nitrogen by tropical legumes[J].Agronomy Journal,1972,64(4):409-412.
[6]Eaglesham A,Ayanaba A,Rao V R,etal.Improving the nitrogen nutrition of maize by intercropping with cowpea[J].Soil Biology &Biochemistry,1981,13(2):169.
[7]Hamilton R,Scholl J,Pope A.Performance of three grass species grown alone and with alfalfa under intensive pasture management:Animal and plant response[J].Agronomy Journal,1969,61(3):357-361.
[8]Whitehead D C.Grassland Nitrogen[M].Cab International,1995.
[9]TEKEL IS,Ate爦E.Yield potential and mineral composition of white clover(TrifoliumrepensL.)-tall fescue(Festuca arundinaceaSchreb.)mixtures[J].Journal of Central European Agriculture,2005,6(1):27-34
[10]谢开云,赵云,李向林,等.豆-禾混播草地种间关系研究进展[J].草业学报,2013,22(3):284-296.
[11]Ledgard S F,Steele K W.Biological nitrogen fixation in mixed legume/grass pastures[J].Plant and Soil,1992,141(1):137-153.
[12]Schipanski M E,Drinkwater L E.Nitrogen fixation in annual and perennial legume-grass mixtures across a fertility gradient[J].Plant and Soil,2012,357(1-2):147-159.
[13]张鲜花,朱进忠,穆肖芸,等.豆科,禾本科5种牧草异行混播草地当年建植效果研究[J].新疆农业科学,2012,49(6):1142-1147.
[14]韩德梁,何胜江,陈超,等.豆禾混播草地群落稳定性的比较[J].生态环境,2008,17(5):1974-1979.
[15]H gh-Jensen H,Schjoerring J.Interactions between white clover and ryegrass under contrasting nitrogen availability:N2fixation,N fertilizer recovery,N transfer and water use efficiency[J].Plant and Soil,1997,197(2):187-199.
[16]Jenkins M,Bottomley P.Seasonal response of uninoculated alfalfa to N fertilizer:soil N,nodule turnover,and symbiotic effectiveness ofRhizobiummeliloti[J].Agronomy Journal,1984,76(6):959-963.
[17]Raun W R,Johnson G V,Phillips S B,etal.Alfalfa yield response to nitrogen applied after each cutting[J].Soil Science Society of America Journal,1999,63:1237-1243.
[18]蔡国军,张仁陟,柴春山.半干旱黄土丘陵区施肥对退耕地紫花苜蓿生物量的影响[J].草业学报,2012,21(5):204-212.
[19]姜慧新,刘栋,翟桂玉,等.氮,磷,钾配合施肥对紫花苜蓿产草量的影响[J].草业科学,2012,29(9):1441-1445.
[20]范富,徐寿军,张庆国,等.氮,磷,钾肥配施对紫花苜蓿产量及营养物质含量的影响[J].中国土壤与肥料,2011,(2):51-56.
[21]Fishbeck K A,Phillips D A.Combined nitrogen and vegetative regrowth of symbiotically-grown alfalfa[J].Agronomy Journal,1981,73(6):975-978.
[22]马霞,王丽丽,李卫军,等.不同施氮水平下接种根瘤菌对苜蓿固氮效能及种子生产的影响[J].草业学报,2013,22(1):95-102.
[23]Peters E,Stritzke J.Herbicides and nitrogen fertilizer for the establishment of three varieties of spring-sown alfalfa[J].Agronomy Journal,1970,62(2):259-262.
[24]郭海明,于磊,林祥群.施肥对绿洲区苜蓿与无芒雀麦混播草地生产性能的影响[J].石河子大学学报(自然科学版),2009,27(1):46-50.
[25]Haynes R.Competitive aspects of the grass-legume association[J].Advances in Agronomy,1980,33:227-261.
[26]Wit C D,Van den Bergh J.Competition between herbage plants[J].Netherlands Journal of Agricultural Science,1965,13:212-221.
[27]Hector A,Schmid B,Beierkuhnlein C,etal.Plant diversity and productivity experiments inEuropeangrasslands[J].Science,1999,286:1123-1127.
[28]Hector A,Bazeley-White E,Loreau M,etal.Over yielding in grassland communities:testing the sampling effect hypothesis with replicated biodiversity experiments[J].Ecology Letters,2002,5(4):502-511.
[29]Herridge D F,Peoples M B,Boddey R M.Global inputs of biological nitrogen fixation in agricultural systems[J].Plant and Soil,2008,311(1-2):1-18.
[30]Sturludóttir E.Forage Quality and Yield in Grass-Legume Mixtures in Northern Europe and Canada[D].University of Iceland,Reykiavik,2011.
[31]Trenbeith B.Biomass productivity of mixtures[J].Advances in Agronomy,1975,26:177.
[32]Cardinale B J,Wright J P,Cadotte M W,etal.Impacts of plant diversity on biomass production increase through time because of species complementarity[J].Proceedings of the National Academy of Sciences,2007,104(46):18123-18128.
[33]Fornara D,Tilman D.Plant functional composition influences rates of soil carbon and nitrogen accumulation[J].Journal of Ecology,2008,96(2):314-322.
[34]Haby V A,Stout S A,Hons F M,etal.Nitrogen fixation and transfer in a mixed stand of alfalfa and bermuda grass[J].Agronomy Journal,2006,98(4):890-898.
[35]Tomm G O,Walley F L,van Kessel C,etal.Nitrogen cycling in an alfalfa and bromegrass sward via litterfall and harvest losses[J].Agronomy Journal,1995,87(6):1078-1085.
[36]Vitousek P M,Cassman K,Cleveland C,etal.Towards an ecological understanding of biological nitrogen fixation[J].Biogeochemistry,2002,57(1):1-45.
[37]Carlsson G,Palmborg C,Jumpponen A,etal.N2fixation in three perennialTrifoliumspecies in experimental grasslands of varied plant species richness and composition[J].Plant Ecology,2009,205(1):87-104.
[38]Nesheim L,Boller B.Nitrogen fixation by white clover when competing with grasses at moderately low temperatures[J].Plant and Soil,1991,133(1):47-56.
[39]Woledge J,Davidson K,Dennis W.Growth and photosynthesis of tall and short cultivars of white clover with tall and short grasses[J].Grass and Forage Science,1992,47(3):230-238.
