H2O2胁迫下豌豆初生根及抗氧化酶系统对外源Ca2+的响应
2014-11-07刘会杰李胜马绍英张品南时振振杨晓明
刘会杰,李胜*,马绍英,张品南,时振振,杨晓明
(1.甘肃省干旱生境作物学重点实验室 甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省农业科学院作物研究所,甘肃 兰州 730070)
豌豆(Pisumsativum)属豆科(Fabaceae)蝶形花亚科(Faboideae)豌豆属(Pisum)一年生攀缘草本植物[1]。它是粮菜饲兼用作物,小杂粮中主要的食用豆,具有极大的农业潜在价值。豌豆还具有很高的生物固氮能力,有助于富集土壤中的营养肥料减少生产成本,所以对可持续农业的发展起着重要的作用[2]。然而,我国西北地区淡水资源缺乏,土壤盐渍化日趋严重[3-4],并且伴随着采矿、冶金以及镉(Cd)处理等工业的发展,我国农业土壤Cd污染问题也不断加剧。Cd是毒性最强的重金属元素之一,被植物吸收后大部分富集在根部,从而抑制根系的正常生长[5],限制豆科植物与根瘤菌共生关系的建立,导致作物产量和品质急剧降低,威胁着农业生产和生态环境,因此对盐渍土及Cd污染土壤的治理已经引起国内外的广泛重视[6]。
随着生物膜理论和研究技术的发展,越来越多的研究证实了生物膜在植物逆境胁迫中的重要性。研究表明膜伤害与植物低温胁迫、水分胁迫、盐胁迫和环境污染物胁迫(重金属污染如Cd)有密切关系[7]。王芳等[8]研究指出100 mg/L的Cd处理使膜脂过氧化产物丙二醛(MDA)含量增加,质膜透性增大,Cd又能导致拟南芥(Arabidopsisthaliana)根尖H2O2的积累[9],发生膜脂过氧化伤害,同时盐胁迫导致黄瓜(Cucumissativus)根系MDA含量和电解质渗漏率增加,生物膜受到伤害[10]。大量实验表明,各种逆境胁迫对植物的伤害首先表现为生物膜的伤害,而胁迫中产生的羟基自由基(·OH)是造成膜脂过氧化作用的主要因素。植物在逆境胁迫过程中会产生大量的活性氧(ROS)[11-12],主要是H2O2能通过Harber-weiss反应产生更活跃、毒性更强的羟基自由基(·OH)[13],当其产生速度超出细胞抗氧化防御系统的清除能力时,就会引发一系列毒性效应,造成对细胞的“氧化胁迫”,从而引发或加剧膜脂过氧化作用,造成细胞膜系统的损伤,严重时导致细胞衰老或死亡。因此可以认为植物细胞内H2O2的累积是植物逆境胁迫过程中发挥作用的重要因素,减缓植物细胞内H2O2积累降低质膜伤害程度是研究植物抗逆性的首要任务。那么施加外源H2O2就相当于对植物细胞进行直接的过氧化胁迫也是对高盐高镉胁迫的模拟,对外源H2O2胁迫产生缓解效应的物质则能直接缓解各种逆境胁迫对植物的伤害。
本试验初期发现外源H2O2胁迫抑制了豌豆初生根的正常向地性生长并导致水平弯曲,机理尚不明确,猜想可能是高浓度H2O2对豌豆根系生物膜产生了氧化迫害。Demidchik等[14]研究发现外源H2O2处理可导致拟南芥根部Ca2+瞬间大量涌入。张春平等[15]指出外源Ca2+可提高紫苏(Perillafrutescens)幼苗叶片中抗氧化物酶的活性,减轻氧化损伤,并显著缓解盐胁迫对紫苏生长的抑制作用,从而提高植株的耐盐性。也有研究表明外源加入Ca2+可拮抗Cd对毛状根生长的抑制或毒害,减少毛状根对Cd的吸收和吸附[16]。但关于外源Ca2+对H2O2胁迫下豌豆初生根生长的相关研究报道甚少。本研究以豌豆“陇豌一号”为材料,在高浓度H2O2胁迫下施加不同浓度的外源Ca2+,测定了外源Ca2+对H2O2胁迫下的豌豆初生根膜脂过氧化指标及相关的抗氧化酶系统变化,探讨不同浓度Ca2+对H2O2胁迫下初生根膜脂过氧化的缓解效应,寻求Ca2+对H2O2胁迫的缓解调节机制,以期为抗逆境胁迫的调控方法提供理论依据,同时为盐渍土及镉污染土壤的改良提供方法。
1 材料与方法
1.1 试验材料
试验于2013年4-7月在甘肃农业大学植物细胞工程实验室进行。供试材料为早熟、矮茎、半无叶型豌豆新品种“陇豌一号”,由甘肃省农业科学院作物所提供。H2O2和Ca2+的供体分别为30% H2O2和CaCl2,2种供体均为国产分析纯(天津光复精细化工研究所)。
1.2 试验处理
挑选籽粒饱满、均匀一致的豌豆种子,消毒后用蒸馏水冲洗3~4次,然后用吸水纸吸干。将处理好的种子放入直径为15 cm且底部铺有纱布的大培养皿中,于培养箱中(26±2)℃下进行培养,光照时间为24 h,光照强度为2000 lx。每个培养皿60粒种子,3次重复,每12 h更换处理液,处理液浓度如表1,CK组只加蒸馏水。以上所有的豌豆种子均水平放置在培养皿的底部,即胚根的方向与培养皿的底面相平行。胁迫所用的H2O2浓度为预试验得出的80 mmol/L的适宜浓度。
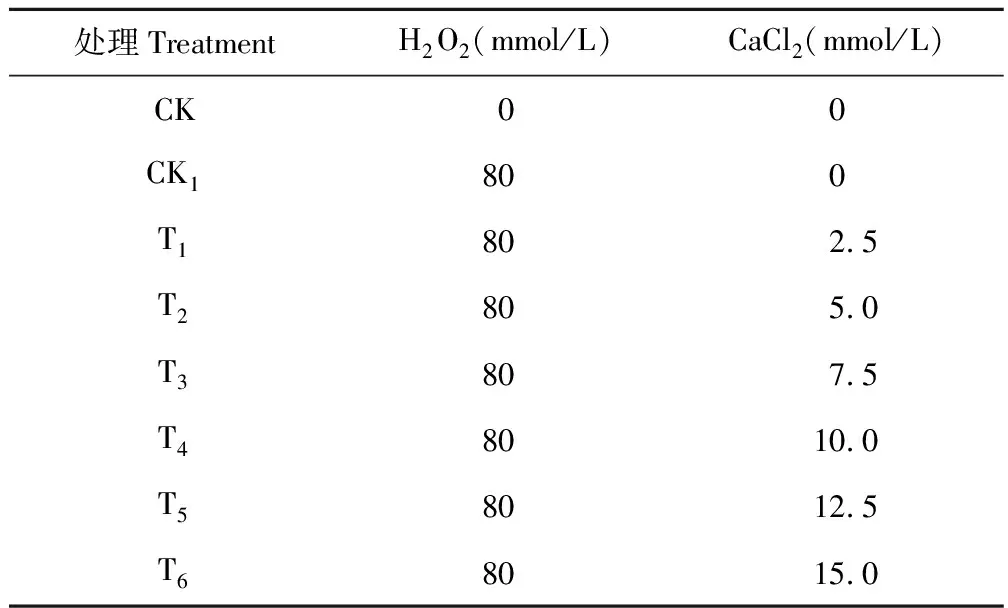
表1 试验处理Table 1 Treatments of the experiment
1.3 幼根相关生理指标的测定
豌豆种子萌发72 h后拍照,进行数据统计后将幼苗从培养皿中取出,根部用蒸馏水清洗,测定不同处理下初生根的各项生理指标。
用TTC法测定初生根根系活力[17],双酶法[18]测定初生根内源H2O2含量。丙二醛(MDA)含量参照Velikova等[19]的硫代巴比妥酸(TBA)法检测。相对电导率的测定参照李合生[20]的方法。
酶液的制备:分别取各处理的初生根液氮研磨后,加入5 mL 50 mmol/L预冷的磷酸缓冲液(pH 7.8),转入离心管中在4℃下离心20 min,上清液即为待测酶液。
超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)法检测[21],以抑制NBT光化还原50%所需的酶量为1个酶活力单位(U)。过氧化氢酶(CAT)活性检测采用钼酸铵比色法进行测定[22]。借鉴陆晓民等[23]的方法测定过氧化物酶(POD)活性,以每分钟OD值变化0.01为1个酶活性单位(U)。抗坏血酸过氧化物酶(APX)的测定参照Mishra等[24]的方法。每种指标每个处理重复3次。
1.4 数据处理
用Excel软件处理数据和绘图,SPSS 19.0软件进行统计分析,用Duncan’s新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 不同处理对豌豆初生根生长的影响

图1 不同处理对豌豆初生根发生水平弯曲的效应Fig.1 Effect of different treatments on horizontal bending of pea primary roots
图2 不同处理对豌豆初生根弯曲率的影响Fig.2 Effects of different treatments on curving rate of pea primary roots 不同小写字母代表差异显著(P<0.05),下同。Different small letters indicate statistically significant differences according to test (P<0.05). The same below.

图3 不同处理对豌豆初生根内源H2O2的影响Fig.3 Effects of different treatments on endogenous H2O2 of pea primary roots
将清洗干净的豌豆种子水平放置在盛有蒸馏水的培养皿中培养24 h时,豌豆种子开始萌发,胚根开始突破种皮,由于重力作用,豌豆的初生根开始沿着重力的方向发生向地性弯曲(图1,CK)。然而,如果将豌豆种子同样水平放置在盛有H2O2的培养皿中,则向地性生长完全受到抑制,而发生水平方向的弯曲,这种弯曲的方式,不同于向地性的生长。试验中用高浓度(80 mmol/L)H2O2处理的豌豆种子,初生根72 h后水平弯曲弧度大于360度(图1,CK1)。若在施加外源H2O2(80 mmol/L)的前提下同时加入不同浓度的Ca2+,这种水平弯曲的现象将会得到缓解,并且随着Ca2+浓度的增加缓解效应越明显(图1)。
试验中以弯曲大于90度以上的初生根数量占初生根总数的百分比计算初生根的弯曲率。结合图2更能说明Ca2+可以缓解外源H2O2诱导的豌豆初生根水平弯曲的现象。从图2中可知,在CK1处理下,72 h后初生根弯曲率高达79.13%,随着外源Ca2+浓度的增加,初生根的弯曲率显著降低。Ca2+浓度增加到10 mmol/L时(T4),初生根弯曲率降低为14.74%,是外源H2O2胁迫下(CK1,79.13%)的1/5。在Ca2+浓度大于10 mmol/L后缓解趋势减弱,差异不显著。
2.2 不同处理对豌豆初生根内源H2O2的影响
在正常的状态下,清除系统会保持植物细胞内H2O2产生和清除的一种动态平衡。但是,当遇到环境的胁迫时如盐、干旱、低温等,H2O2的含量会快速升高[25]。为了研究外源H2O2处理后,是否引起了豌豆初生根细胞内H2O2水平的变化,采用双酶法定量检测了 H2O2含量。结果发现,与CK组相比,CK1处理内源的H2O2含量显著降低,即CK1初生根的内源H2O2含量(1.034 mmol/L·g)明显低于CK(1.4913 mmol/L·g)。但是豌豆种子浸泡在施加了外源Ca2+的培养皿中72 h后,因施加浓度的不同变化也各有差异。当施加的外源Ca2+浓度从2.5 mmol/L到7.5 mmol/L的处理中初生根的内源H2O2水平无显著差异,但显著低于其他处理。当Ca2+浓度大于10 mmol/L时,初生根内源H2O2含量则显著高于CK1和低浓度Ca2+处理,较CK差异不显著。试验结果说明,外施Ca2+能缓解H2O2胁迫下造成的内源H2O2含量的降低,当外施Ca2+达到一定浓度时,初生根内源H2O2的产生可恢复至正常生长水平(图3)。
2.3 不同处理对豌豆初生根根系活力的影响
众所周知,在正常的植物生长代谢中,H2O2作为代谢的副产物会源源不断地产生,因此内源H2O2的产生与植物组织器官的代谢和生长活力紧密相关。有些实验表明,当植物在遭受外界因子的胁迫或者刺激时,内源H2O2水平会迅速的升高,转换成信号进行细胞调节[26]。为什么在本试验中外源H2O2处理后内源H2O2水平会降低,而在施加一定高浓度的外源Ca2+后又重新升高呢,为了阐明这一问题,用TTC法测定了初生根的根活力。根的活力是一种能够反映植物生长代谢旺盛程度的一个重要指标。无色的TTC在接受细胞中线粒体上脱氢酶传递的电子后转变为粉红色的TF[27-28]。因此根的活力与初生根的TF染色程度或者TF的含量呈正相关。

图4 不同处理对豌豆初生根根系活力的影响Fig.4 Effects of different treatments on root activity of pea primary roots A:不同处理下初生根根系活力值;B:不同处理下初生根TTC法染色效果。 A:Values of primary root activity under different treatments; B:Dyeing effect of TTC on pea primary root under different treatments.
检测结果如图4所示,外源H2O2降低豌豆初生根的根系活力,而同时施加外源Ca2+时根系活力又随着Ca2+浓度的增加而增强,体现了其缓解效应,如图4A,而染色反应也印证了这一结果(图4B)。从图4A可看出,正常生长情况下(CK)初生根的根系活力达到219.225 μg/(g·h),是H2O2处理63.429 μg/(g·h)的3.45倍。当Ca2+浓度为2.5 mmol/L时豌豆初生根根系活力并没有得到显著提高,随着外源Ca2+浓度的增加根系活力逐渐恢复,当Ca2+浓度增大至10 mmol/L时(T4)初生根的根系活力达到194.849 μg/(g·h),但与T3相比并不明显,也显著低于CK。当Ca2+浓度大于10 mmol/L时,根系活力又显著降低,在Ca2+浓度为15 mmol/L (T6)时根系活力降低为135.779 μg/(g·h),虽然高于CK1,但显著低于CK、T3和T4。
图4B中可以观察到,CK培养的豌豆种子初生根活力最强,整个初生根几乎都被染成了TF的粉红色。当用H2O2处理72 h后,初生根的根系活力明显下降,即染色非常浅或者染不上色(图4B,CK1)。在施加高浓度的Ca2+后,初生根又能够被TTC染上色,这表明根系活力得到恢复,但结合图4A的数据分析仍明显低于CK。在植物的正常生长代谢中,H2O2作为信号因子不断地产生,参与植物组织器官的代谢。本试验结果表明,正常处理的豌豆初生根生长过程中,根的活力强,代谢旺盛,H2O2作为信号因子产生参与细胞的调控,因此内源的H2O2含量高(图3);反之,外源H2O2处理后,初生根活力明显受到抑制,因而使初生根自身内源H2O2产生含量降低,恢复后根的活力又明显地反弹。TTC染色的实验结果与定量检测的结果一致(图4B)。
2.4 不同处理对豌豆初生根膜脂过氧化和质膜透性的影响
膜脂过氧化产物 MDA 含量及相对膜透性是细胞膜受损伤程度的重要指标。由图5可知,不论是在单独H2O2处理下或者同时施加Ca2+处理,培养72 h后的豌豆初生根中MDA含量和相对电导率均比同期CK组升高,但是外施Ca2+降低了MDA含量和相对电导率的增加幅度。
图5A显示,CK1处理豌豆初生根MDA含量较之CK提高了97.40%,同时施加外源Ca2+后初生根MDA含量与CK1相比显著降低,但仍高于CK组,且差异显著。在T5处理下即Ca2+浓度为12.5 mmol/L时初生根MDA含量降低至与CK组无显著差异,降低至CK1组的61.36%,为0.6732 μmol/(L·g),Ca2+浓度增加至15 mmol/L时,MDA含量又有所升高,为0.8086 μmol/(L·g)。
从图5B可以看出,各处理组相对膜透性的变化趋势与MDA含量的变化趋势相似,CK1的相对膜透性(31.94%)是CK (14.16%)的2.25倍,且与低浓度Ca2+处理T1无显著差异。之后,随着外源Ca2+浓度的增加相对膜透性逐渐降低,但仍高于CK,T5与T6组则差异不显著。
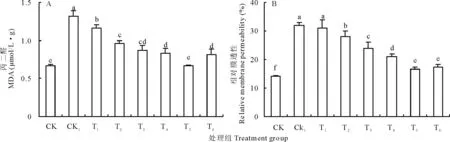
图5 不同处理对豌豆初生根MDA(A)和相对膜透性(B)的影响Fig.5 Effects of different treatments on MDA (A) and relative membrane permeability (B) of pea primary roots
2.5 不同处理对豌豆初生根抗氧化物酶活性的影响
本试验研究发现,与CK相比,CK1使豌豆初生根内的POD (图6A)、SOD(图6B)和CAT(图6C)的活性显著降低,APX活性(图6D)则与CK无显著差异。H2O2胁迫下,POD、SOD和CAT的活性均随着外施Ca2+浓度的增大显著增加,且在T4达到最大值后随之降低,APX活性则在T4、T5和T6处理无显著差异。
如图6所示,CK1的POD和CAT活性显著低于CK。CK1豌豆初生根的POD活性降低为CK组的55.19%(图6A),CAT的活性降低为CK的37.29%,降低幅度比POD更大(图6C)。同时施加Ca2+处理后,POD和CAT的活性显著提高,在T4处理下均达最大值,分别为51.946 U/(mg·min)和1.9739 mmol/(L·g·min),是对应CK1的3.22和2.99倍。T4处理下POD活性相对于CK组的增加幅度比CAT更大,T4组POD活性比CK增加了78.28%,CAT活性则增加了13.87%,T5和T6处理下POD和CAT活性均有明显降低,但都高于CK1(图6A,C)。
SOD是一种重要的抗氧化酶类,能保护植物细胞受到氧化伤害。如图6B所示,CK1组SOD活性比CK组降低了9.828%,随着施加外源Ca2+浓度的增加,SOD活性随之显著增加,在T4处理下活性达到865.174 U/g FW,比CK和CK1分别高出101.06和172.026 U/g,均差异显著。T5、T6处理下,酶活性降低,但是仍高于CK1,与CK组相比差异不大。
APX是清除细胞内H2O2的主要酶类。如图6D所示,在CK1处理下APX活性并没有像其他抗氧化酶类一样降低,却与CK无显著差异。但施加外源Ca2+后酶活性又有显著的提高,当Ca2+浓度增加到10 mmol/L (T4)达到稳定,与T5、T6无显著差异。
3 讨论
3.1 外源Ca2+对H2O2胁迫下豌豆初生根生长的缓解效应
大量研究表明,施加低浓度外源H2O2对植物的生长发育有着积极的作用,例如能够促进种子萌发、增强很多植物的抗干旱、抗低温、耐盐等能力[29-31]。本试验中发现,对豌豆外施高浓度(80 mmol/L)H2O2能抑制初生根正常向地性生长并发生水平弯曲现象(图1,CK1)。众所周知,向地性生长与细胞内的H2O2信号有关,也许是外源的H2O2扰乱了细胞内的氧化还原平衡,加剧了膜脂过氧化作用,造成细胞膜系统的伤害,从而导致了一系列的反应,使对重力的刺激信号无法向下传递。试验结果表明,外源施加Ca2+能明显的缓解H2O2对豌豆初生根的伤害,使其恢复正常生长。

图6 不同处理对豌豆初生根POD(A),SOD(B),CAT(C)和APX(D)活性的影响Fig.6 Effects of different treatments on POD(A), SOD (B), CAT(C) and APX(D) activity of pea primary roots
根系活力是根生长或者代谢旺盛程度的一个重要指标,根系活力的测定发现,初生根的活力也明显受到了外施H2O2的抑制(图4),这表明根细胞的正常代谢也受到了外源的H2O2抑制。施加外源Ca2+能够有效地缓解H2O2诱导的水平弯曲生长,使根系生长趋于正常,根系活力得到恢复(图4)。
一般认为,外源H2O2是一种特殊的化学物质,对植物的根产生胁迫。当植物受到逆境胁迫后,内源的H2O2水平会明显的升高从而产生信号。但本研究结果与这一结论恰恰相反,在检测了细胞内的H2O2水平后发现,H2O2胁迫下初生根内源H2O2(CK1)水平明显低于正常处理下(CK)初生根内源H2O2水平(图3)。因此认为,面对持续的外源H2O2处理,豌豆的种子或胚发生了自发的调节和反馈的抑制,抑制了自身的生长和代谢。植物根系通过呼吸作用产生的H2O2是其主要来源之一,本试验中H2O2胁迫使初生根代谢降低,呼吸作用减弱,产生的H2O2也随之减少。施加一定浓度的外源Ca2+后根系活力及代谢得以恢复,内源H2O2含量也随之升高。
3.2 外源Ca2+对H2O2胁迫下豌豆初生根膜脂过氧化和抗氧化酶系统的缓解
有研究表明高盐胁迫使植物的生长受到严重的阻碍,生物膜受到伤害[32]。王贺正等[33]指出水稻结实期随水分胁迫加剧,细胞膜脂过氧化加剧。目前有关铝诱导大豆的氧化胁迫也有报道,结果显示高铝胁迫使大豆根系质膜透性增大,使植株抵抗逆境的能力下降受到伤害[34]。当豌豆初生根受到胁迫时,首先受到伤害的是细胞膜,这很大程度上是通过破坏细胞生物膜的生理功能引起的,主要表现在细胞膜结构的破坏和功能的紊乱以及膜透性发生变化,而细胞膜的破坏将加速整个细胞的伤害。而当植物体受到逆境胁迫时,体内的MDA含量会升高,并且氧化程度越高,含量越高。
本研究中豌豆初生根的相对膜透性及MDA含量在不同的处理下均有不同程度的变化。H2O2处理导致初生根MDA含量的积累,相对膜透性增加。施加外源Ca2+后结果显示,外施Ca2+有效减缓了初生根中MDA的升高,同时降低了细胞膜的相对透性,对细胞膜具有较好的修复和保护作用,从而减轻了外源H2O2对豌豆初生根细胞膜系统的伤害。
在遭受长时间各种逆境胁迫后植物的抗氧化系统包括SOD、 CAT、APX、ASC、GSH、GPX、POD等一些抗氧化的酶或者抗氧化剂均会降低或者减少。本试验检测了 CAT、SOD、POD和APX的活性,与大多数的研究结果一致,发现在外源H2O2处理下4种酶活性均明显的降低(图6)。柳斌等[35]曾报道施加外源钙能缓解NaCl对苜蓿(Medicagosativa)幼苗根系的伤害。10 mmol/L的Ca2+能有效防护盐胁迫导致的氧化损伤,抑制脂质过氧化作用[36]。同时,外源Ca2+能通过维持高的总抗氧化能力和抗氧化物质含量等途径来增强黑藻对Cd胁迫的抗性[37]。本研究结果表明,外源Ca2+对CAT、SOD、POD和APX等酶活性具有明显的促进作用,外施Ca2+后4种抗氧化酶活性持续升高。这个结果解释了为什么内源H2O2水平会降低,同时也证明强大的清除系统缓解了逆境胁迫下产生的过量ROS造成的氧化胁迫,降低初生根的膜脂过氧化程度,保护初生根不被伤害。
4 结论
直接施加外源H2O2使豌豆初生根内MDA含量增加,相对膜透性增强,抗氧化物酶活性降低,对初生根造成膜脂过氧化伤害从而影响根系的正常生长。而同时施加10 mmol/L外源Ca2+能有效地缓解H2O2对豌豆初生根造成的氧化胁迫,减轻对细胞膜的伤害,降低质膜透性及MDA含量,增强初生根系抗氧化物酶活性,因此施加外源Ca2+能有效地缓解逆境胁迫对植物造成的氧化伤害。同时对农业生产中盐渍及污染土壤的改良除了调整作物品种和改变耕作制度的方法外,外源施加一定浓度的Ca2+也是一种有效的技术手段。
