西藏不同饲草全混合日粮发酵品质和有氧稳定性的研究
2014-01-02王勇原现军郭刚闻爱友王坚肖慎华余成群巴桑邵涛
王勇,原现军,郭刚,2,闻爱友,王坚,肖慎华,余成群,巴桑,邵涛*
(1.南京农业大学动物科学技术学院饲草调制加工与贮藏研究所,江苏 南京210095;2.山西农业大学动物科学技术学院,山西 太谷0308012;3.中国科学院地理科学与资源研究所,北京100101;4.西藏日喀则地区草原工作站,西藏 日喀则857000)
畜牧业是西藏农牧业的重要组成部分,在农业经济中占有重要地位[1]。近年来,过度放牧导致天然草地退化和沙化,加剧了草畜矛盾,进而严重影响了高寒草地的生态平衡以及畜牧业的可持续发展。由于西藏特殊的高寒气候条件,植物生长周期短,产量低,饲料资源相对匮乏,导致西藏家畜尤其是西藏改良奶牛生产性能低,营养不均衡[2],因此充分利用西藏饲草及秸秆资源是维持畜牧业健康稳步发展的重要途径。小麦(Triticumaestivum)和青稞(Hordeumvulgare)均是西藏主要粮食作物,种植面积广,分别约占粮食总产量的30%和65%,其秸秆资源相对丰富,但因农作物秸秆粗纤维含量高,适口性差,营养价值低,单独饲喂不能满足家畜的营养需要。全株玉米(Zeamays)因鲜嫩多汁,适口性好,营养价值高,是内地规模化牧场奶牛的主要优质粗饲料,西藏也有种植用于改良奶牛的青绿饲料。近年来,燕麦(Avenasativa)在西藏地区快速推广,已成为西藏农牧区冬季主要抗灾饲草。紫花苜蓿因粗蛋白含量较高,可为家畜提供优质蛋白质。
全混合日粮(total mixed ration,TMR)是根据奶牛不同生长发育阶段的营养需求,将粗料、精料、矿物质和维生素等按适当比例配制成营养均衡的全价饲料,TMR具有改善适口性,提高干物质采食量,促使奶牛均衡采食,维护瘤胃健康,减少奶牛发病率,提高产奶量等特点[3]。但TMR因营养成分含量高,好氧性微生物活跃易腐败变质,不利于长期贮存和商品化运输。而发酵TMR(fermentation TMR,FTMR)通过发酵方式不仅延长了TMR保存时间,还可将饲料中的抗营养因子降解转化,从而提高饲料安全性,同时可以改变原料理化性状,提高饲料利用率。20世纪90年代日本率先开发出发酵TMR技术并应用到生产实践中,有效地解决了TMR饲料不宜长期保存的难题。目前,许多研究者[4-5]将啤酒糟、咖啡渣、蘑菇渣、绿茶渣等食品副产物用于FTMR生产中,获得了发酵品质优、有氧稳定性好、营养价值均衡的全价饲料。Weinberg等[6]将含有玉米酒糟的发酵TMR保存140d后,其发酵品质和有氧稳定性均良好。Sepp l 等[7]将啤酒糟添加到饲草型TMR中,并分别添加2,4和6g/kg的丙酸(铵)和甲酸(铵)组合,有效提高了发酵TMR有氧稳定性,并发现有氧稳定性与添加量呈线性相关。
西藏地区酥油和奶酪需求量大,且随着生活水平的不断提高对牛奶的需求不断扩大。目前西藏地区广泛地开展改良奶牛的推广工作,但因饲料营养成分不均衡限制了改良奶牛的生长发育与生产性能的发挥,因此在西藏地区因地制宜地将农作物秸秆、全株玉米、栽培牧草和精料合理设计配制成全混合日粮,实现营养均衡供给,提高改良奶牛的生产性能势在必行。
本试验在当地奶牛场采用的全株玉米和青稞秸秆为主要粗饲料的TMR配方基础上,用苜蓿(Medicagosativa)、全株燕麦和小麦秸秆逐步替代TMR中的全株玉米,研究不同替代水平对TMR发酵品质、营养品质和有氧稳定性的影响,从而为西藏地区优质发酵TMR饲料的生产提供技术支撑,促进当地奶牛业的可持续发展。
1 材料与方法
1.1 试验原料
全株玉米、紫花苜蓿、全株燕麦、青稞秸秆和小麦秸秆均来自于西藏日喀则地区草原工作站。2012年9月25日刈割时,全株玉米处于乳熟期,紫花苜蓿处于第2茬初花期,全株燕麦处于乳熟期,青稞秸秆和小麦秸秆均为去除籽实的秸秆部分;精料由玉米、全棉籽、菜籽粕、玉米酒糟、维生素和矿物质等组成的预混料,由南京农业大学饲草调制加工与贮藏研究所和日喀则奶牛场配制(表1)。

表1 试验原料营养成分和缓冲能Table 1 Nutritional composition and buffering capacity of experimental materials
1.2 发酵TMR调制
将粗料切成2cm左右,与精料按设计比例混合均匀,装入15L的实验室青贮窖中,压实密封,每个处理各个时间点5个重复,共计80个实验室青贮窖,室温下保存45d。TMR根据中国奶牛饲养标准,结合西藏改良奶牛生产实际配制而成的,其组成见表2。
1.3 TMR材料营养成分和微生物成分分析
样品在65℃烘干至恒重测定干物质(dry matter,DM),粗蛋白(crude protein,CP)含量采用全自动凯氏定氮仪(FOSS 2300)测定,粗脂肪(ether extract,EE)含量采用残余法测定[8],粗灰分(ash)含量采用灼烧法测定,可溶性碳水化合物(water soluble carbohydrates,WSC)含量采用蒽酮-硫酸法测定,酸性洗涤纤维(acid detergent fiber,ADF)、中性洗涤纤维(neutral detergent fiber,NDF)采用范氏(van Soost)方法测定[8],缓冲能(buffering capacity)采用盐酸、氢氧化钠滴定法测定[9]。乳酸菌、酵母菌和霉菌数量分别采用 MRS(de-Man Rogosa Sharpe)琼脂培养基、马铃薯葡萄糖琼脂培养基(南京寿德生物科技有限公司)计数。乳酸菌在37℃恒温培养箱厌氧培养3d;酵母菌和霉菌在30℃恒温培养箱培养3d。

表2 TMR的组成、营养成分和缓冲能Table 2 Ingredients and nutritional compositions and buffering capacity of TMR before fermentation
1.4 测定项目及分析方法
45d后开窖,取出全部样品,按四分法取出350g样品,放入1L的烧杯里,加入700mL水后,置于冰箱内浸提24h。用2层纱布和滤纸过滤,收集滤液于塑料瓶中,并置于-20℃冰箱中冷冻保存待测。滤液用来测定pH值(pH value)、乳酸(lactic acid,LA)、氨态氮(ammonia nitrogen,NH3-N)、乙酸(acetic acid,AA)、丙酸(propionic acid,PA)与丁酸(butyric acid,BA),总挥发性脂肪酸(volatile fatty acids,VFAs)含量为乙酸、丙酸和丁酸含量总和。pH值用pH211型精密pH计测定;乳酸采用对羟基联苯法测定[10];氨态氮采用苯酚-次氯酸钠比色法测定[11];乙酸、丙酸、丁酸采用高效气相色谱仪(日本岛津GC-14B)测定,测定条件:柱温140℃,气化室温度180℃,氢气检测器温度220℃。
1.5 有氧稳定性分析
开窖后,松动实验室青贮窖使FTMR充分与空气接触,盖上1层纱布,并放置于室温下,有氧暴露3,6,9d后检测FTMR的pH值、有机酸和WSC含量的变化,评价FTMR饲料的有氧稳定性。
1.6 数据统计
采用SAS统计软件进行单因素方差分析(ANOVA),并用Fisher’s(LSD)进行多重比较。
2 结果与分析
2.1 TMR营养成分、缓冲能和微生物数量
发酵前不同TMR组营养成分、缓冲能和微生物数量如表2和表3所示,随着全株玉米比例的下降,各组干物质含量显著(P<0.05)上升,水溶性碳水化合物含量逐渐下降,但各组水溶性碳水化合物含量均高于120g/kg DM。各组粗蛋白含量界于120~150g/kg DM 之间,从大到小的顺序依次是:TMR-3>TMR-2>TMR-4>TMR-1(P<0.05)。各组粗灰分含量随着替代水平的增加呈上升趋势。各组乳酸菌和酵母菌数量均超过5.0 log cfu/g FW,各组霉菌数量为4.0~5.0log cfu/g FW,且差异不显著(P>0.05)(表3)。

表3 TMR的微生物数量Table 3 Microbial counts of TMR before fermentation
2.2 TMR的发酵品质
发酵45d后各组TMR发酵品质如表4所示。随替代水平的增加,pH值呈上升趋势,其中TMR-4组pH值显著高于 TMR-1和 TMR-2组(P<0.05),TMR-3组pH 值与 TMR-2组差异不显著(P>0.05),TMR-1组pH 值最低(4.10)。TMR-3组乳酸含量显示最低值,显著(P<0.05)低于 TMR-1组,而 TMR-2和 TMR-4组乳酸含量与TMR-1组差异不显著(P>0.05)。各组乙酸含量和乳酸/乙酸分别为6.01~7.05g/kg DM 和5.15~6.80,且各组间差异均不显著(P>0.05)。各替代组丙酸、丁酸和挥发性脂肪酸含量均显著低于TMR-1组(P<0.05)。各组的氨态氮/总氮均低于60g/kg TN,其中各替代组氨态氮/总氮均显著高于TMR-1组(P<0.05),TMR-3和 TMR-4组氨态氮/总氮又显著高于TMR-2组(P<0.05)。
各组乳酸菌数量范围在6.2~7.4log cfu/g FW之间,且差异不显著(P>0.05)。各组酵母菌和霉菌数量均较少,其中 TMR-2和 TMR-3组酵母菌数量显著低于 TMR-1和 TMR-4组(P<0.05);TMR-2、TMR-3和TMR-4组均未检测到霉菌。
2.3 发酵TMR的营养品质
发酵45d后各组TMR营养品质如表5。各组干物质含量和酸性洗涤纤维含量差异性均显著(P<0.05),其中干物质含量大小顺序为:TMR-4>TMR-3>TMR-2>TMR-1,酸性洗涤纤维顺序则为:TMR-4>TMR-1>TMR-2>TMR-3;各组间粗蛋白含量在137~155g/kg DM 之间,无显著差异(P>0.05);TMR-1组中性洗涤纤维含量显著(P<0.05)高于其他3组,TMR-2与TMR-3中性洗涤纤维含量较低;TMR-1和TMR-2组水溶性碳水化合物含量显著高于 TMR-4组(P<0.05);TMR-1粗脂肪含量显著(P<0.05)高于 TMR-2和 TMR-4组;TMR-1和 TMR-3粗灰分含量显著高于 TMR-2和TMR-4组(P<0.05)。
2.4 发酵TMR的有氧稳定性
发酵45d后,打开实验室青贮窖,将各组发酵TMR暴露于空气中。随着暴露时间的延长,各组pH值均呈上升趋势,TMR-1有氧暴露第9天pH 值为5.61,增幅达36.8%,其上升幅度最大,而TMR-2、TMR-3和TMR-4的组pH值上升幅度较小,第9天pH值分别升至5.15,5.05和5.32,增幅分别仅为20.6%,17.2%和21.2%。在有氧暴露9d中,各组乳酸、乙酸和水溶性碳水化合物含量急剧下降,其中TMR-1、TMR-2、TMR-3和TMR-4的乳酸含量下降幅度分别为59.6%,56.3%,41.0%和43.1%,乙酸含量下降幅度分别为76.9%,86.4%,58.5%和76.7%,水溶性碳水化合物含量下降幅度分别为56.8%,47.6%,57.5%和52.9%。各组丙酸和丁酸含量变化在有氧暴露3d中,丙酸和丁酸含量略有增加,其中TMR-1组丙酸和丁酸含量均显著(P<0.05)高于其他各组,之后均逐渐下降,直至暴露第9天各组均未被检出(图1)。
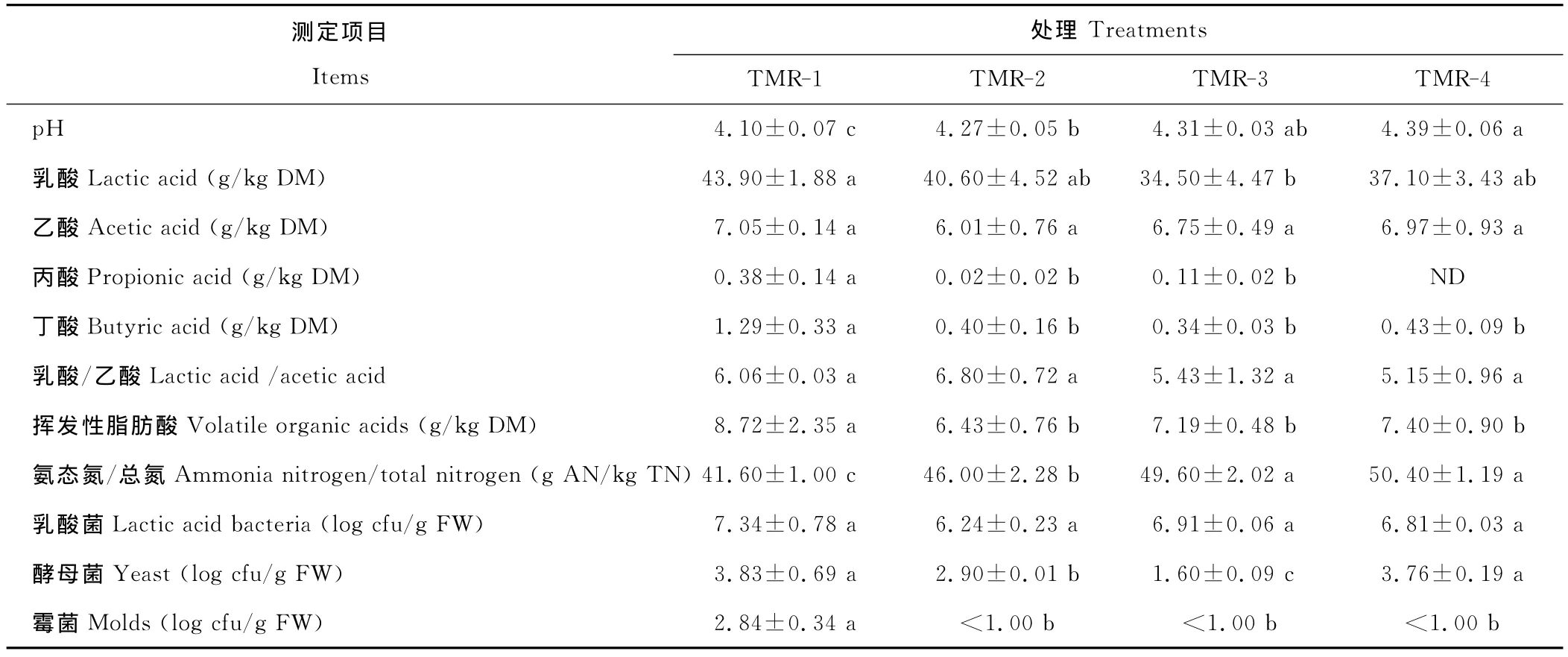
表4 45d后TMR的发酵品质Table 4 Fermentation quality of TMR after 45days of fermentation

表5 发酵45d后TMR营养成分Table 5 Nutritional compositions of TMR after 45days of fermentation
3 讨论
3.1 不同替代水平对TMR发酵品质的影响
本试验中TMR-1组水溶性碳水化合物含量较高(>70g/kg DM),缓冲能较低(<200mE/kg DM)及乳酸菌数量较高,致使该组发酵45d后pH值最低,且低于常规成功青贮要求的pH值4.2[2,8],乳酸含量和乳酸/乙酸较高,氨态氮和丁酸含量较低,发酵品质良好。Porter和Murray[12]将干物质含量分别为175,241和339g/kg FM的紫花苜蓿进行青贮,发现各组pH值分别降至3.80,3.90和4.23,表明青贮饲料pH值随干物质含量增加而呈升高趋势。本试验中各替代组pH值均高于4.20,且随着替代水平的增加呈上升趋势,可能是由于较高的干物质含量一定程度上抑制了乳酸菌的活性。Meeshe等[13]研究表明,青贮材料干物质含量较高时,pH值不必降至4.20也可良好保存,其对干物质含量为317和328g/kg FW的全株燕麦进行青贮,发现pH值分别达到4.56和4.52均能良好保存。各替代组氨态氮/总氮均略高于TMR-1组,这可能是由于干物质含量高,抑制了乳酸菌的活性,未能产生足够的乳酸,并降低pH值,因而不能完全抑制有害微生物对蛋白质、肽及氨基酸的降解。但各组氨态氮/总氮均远低于优质青贮饲料要求的临界值(100g/kg TN)[14],且各组仅检测到微量丙酸和丁酸含量,由此表明各替代组发酵品质虽不及TMR-1组,但发酵品质仍属于良好。

图1 有氧暴露阶段发酵TMR饲料pH值、有机酸和WSC含量的变化Fig.1 Changes in pH value,volatile organic acids and WSC contents of fermentation TMR during the aerobic period
3.2 不同替代水平对发酵TMR营养品质的影响
与发酵前相比,各组水溶性碳水化合物均呈大幅下降趋势,分别下降49.9%,48.1%,48.4%和51.7%,这是由于发酵过程中乳酸菌以水溶性碳水化合物为底物[15-16],将其代谢为以乳酸为主的有机酸,降低pH值,从而达到长期保存饲料的目的[17],这一点与各组均有大量有机酸生成相一致。另外粗蛋白、中性洗涤纤维、酸性洗涤纤维、粗脂肪等营养物质含量均高于发酵前,这可能是由于发酵45d后水溶性碳水化合物被降解利用,导致其他各组分相对比例均有一定程度升高。除TMR-1组干物质含量下降了5.97%,其他3组干物质含量变化均较小(<1.83%),可忽略不计,这可能归因于TMR-1组水溶性碳水化合物较充足,包括乳酸菌在内的微生物活动旺盛,较多的水溶性碳水化合物被消耗,导致干物质含量下降。
经过发酵45d水溶性碳水化合物大幅度下降,同时各组间干物质、粗蛋白、中性洗涤纤维、酸性洗涤纤维、粗脂肪等营养物质含量均呈不同程度上升或下降,但变化幅度较小,因此各组间营养成分的差异与发酵前基本一致。发酵45d后除TMR-4组外,其他组粗蛋白含量均在15%左右,其中TMR-2和TMR-3组均高于15%,能够满足改良奶牛的蛋白营养需要;各组中性洗涤纤维含量均在500g/kg DM以上,满足奶牛对纤维的需求。
3.3 不同替代水平对发酵TMR开窖后有氧稳定性的影响
发酵TMR有氧腐败变质主要是由酵母和霉菌等有害微生物增殖引起,发酵TMR开窖后,厌氧环境被破坏,好氧性微生物开始活跃,它们可以分解代谢乳酸、氨基酸、蛋白质和糖类等有机物,释放热量、二氧化碳和氨态氮,导致pH值上升,TMR腐败变质,严重时营养损失可达30%。Johnson等[18]研究表明,青贮饲料有氧稳定性与其乳酸和水溶性碳水化合物含量呈负相关,这是由于乳酸和水溶性碳水化合物可以做为好氧性微生物生长繁殖的底物,促进酵母和霉菌的生长繁殖,造成营养成分损失,加剧了青贮饲料的腐败变质。挥发性脂肪酸(乙酸、丙酸等)有较强的抗真菌能力,能够抑制真菌生长繁殖,对维持有氧稳定起着重要作用[19-21]。本试验结果显示各组乳酸含量均呈不同程度的下降,pH值上升,其中TMR-1组变化最大,这是由于该组发酵品质最好,乳酸和水溶性碳水化合物含量最高,为有害微生物提供较充足的底物,同时在有氧暴露第3天其乙酸含量下降较快,低于其他3组,不能有效地抑制酵母和霉菌的生长繁殖,导致有氧稳定性最差。而TMR-3组pH值上升幅度最小,其有氧稳定性最好,可能归因于该组乙酸含量在有氧暴露过程中下降幅度较小,尤其是在第6天后,其含量高于其他3组。本试验在有氧暴露3d中各组丙酸和丁酸含量有增加趋势,且含量较少,之后逐渐下降,直至未能检测到,这可能是由于产丁酸和丙酸的微生物在开窖初期大量繁殖,导致丁酸和丙酸含量增加,但随着暴露时间的延长,丁酸和丙酸等均挥发殆尽。
4 结论
综上所述,苜蓿、全株燕麦和小麦秸秆以不同比例替代全株玉米后,pH有所升高,乳酸含量降低,但各替代组氨态氮/总氮低于100g/kg DM,仅检测到微量丙酸和丁酸,因此各组发酵品质仍属良好。在有氧暴露9d后,TMR-3组pH值上升幅度最小,其有氧稳定性最好,且该组有较高的粗蛋白含量,因此,TMR-3组可应用于西藏优质发酵TMR的实际生产中。
[1]原现军,邵涛,余成群,等.西藏青稞秸秆与多年生黑麦草混合青贮发酵品质的研究[J].草业学报,2012,21(4):325-330.
[2]原现军,王奇,邵涛,等.添加糖蜜对青稞秸秆和多年生黑麦草混合青贮发酵品质及营养价值的影响[J].草业学报,2013,22(3):116-123.
[3]Kolver E S,Muller L D.Performance and nutrient intake of high producing holstein cows consuming pasture or a total mixed ration[J].Journal of Dairy Science,1998,81(5):1404-1411.
[4]Nishino N,Wang F J.Resistance to aerobic deterioration of total mixed ration silage:effect of ration formulation,air infiltration and storage period on fermentation characteristics and aerobic stability[J].Journal of the Science of Food and Agriculture,2008,88(1):133-140.
[5]Wang F,Nishino N.Ensiling of soybean curd residue and wet brewers grains with or without other feeds as a total mixed ration[J].Journal of Dairy Science,2008,91(6):2380-2387.
[6]Weinberg Z G,Chen Y,Miron D,etal.Preservation of total mixed rations for dairy cows in bales wrapped with polyethylene stretch film-A commercial scale experiment[J].Animal Feed Science and Technology,2011,164(1):125-129.
[7]Sepp l A,Heikkil T,M ki M,etal.Controlling aerobic stability of grass silage-based total mixed rations[J].Animal Feed Science and Technology,2013,179(3):54-60.
[8]荣辉,邵涛,余成群,等.添加绿汁发酵液、乳酸菌制剂和葡萄糖对象草青贮发酵品质的影响[J].草业学报,2013,22(3):108-115.
[9]McDonald P,Playne M J.The buffering constituents of herbage and of silage[J].Journal of the Science of Food and Agriculture,1966,17(6):264-265.
[10]Barker S B,Summerson W H.The colorimetric determination of lactic acid in biological material[J].Journal of Biological Chemistry,1941,138:535-554.
[11]Broderica G A,Kang J H.Automated simultaneous determination of ammonia and amino acids in ruminal fluid and in vitro media[J].Journal of Dairy Science,1980,33(1):64-75.
[12]Porter M G,Murray R S.The volatility of components of grass silage on oven drying and the inter-relationship between drymatter content estimated by different analytical methods[J].Grass and Forage Science,2001,56(4):405-411.
[13]Meeshe R,Merwe G D,Grayling J F,etal.The effect of adding an enzyme containing lactic acid bacterial inoculant to big round bale oat silage on silage,milk production and milk composition of jersey cows[J].Animal Feed Science and Technology,2002,97(3):159-167.
[14]Shao T,Shimojo M,Masuda Y,etal.Effect of adding glucose,sorbic acid and pre-fermented juices on the fermentation quality of guineagrass[J].Asian-Australasian Journal of Animal Sciences,2005,18(9):1273-1278.
[15]Shao T,Noriko O H B A,Masuda Y,etal.Fermentation quality of forage oat silages treated with pre-fermented juices,sorbic acid,glucose and encapsulated-glucose[J].Journal of Faculty of Agriculture,2003,47(2):341-349.
[16]于杰,郑琛,李发弟,等.向日葵秸秆与全株玉米混合青贮饲料品质评定[J].草业学报,2013,22(5):198-204.
[17]McDonald P.The Biochemistry of Silage[M].University of Wisconsin:Chalcombe Publications,1991:1-10.
[18]Johnson L M,Harrison J H,Davidson D,etal.Corn silage management:effect of maturity,inoculation,and mechanical processing on pack density and aerobic stability[J].Journal of Dairy Science,2002,85(2):434-444.
[19]Danner H,Holzer M,Mayrhuber E,etal.Acetic acid increases stability of silage under aerobic conditions[J].Applied and Environmental Microbiology,2003,69(1):562-567.
[20]Kung L,Sheperd A C,Smagala A M,etal.The Effect of preservatives based on propionic acid on the fermentation and aerobic stability of corn silage and a total mixed ration[J].Journal of Dairy Science,1998,81(5):1322-1330.
[21]Nishino N,Wada H,Yoshida M,etal.Microbial counts,fermentation products,and aerobic stability of whole crop corn and a total mixed ration ensiled with and without inoculation ofLactobacilluscaseiorLactobacillusbuchneri[J].Journal of Dairy Science,2004,87(8):2563-2570.
