苍耳提取物对萝卜蚜和粘虫作用方式及解毒酶活性影响的研究
2014-01-02张君霞张新虎沈慧敏
张君霞,张新虎,沈慧敏*
(1.甘肃农业大学林学院,甘肃 兰州730070;2.甘肃农业大学草业学院 草业生态系统教育部重点实验室 中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
苍耳(Xanthiumsibiricum)为菊科苍耳属(Xanthium)一年生草本植物,在我国林地、农田和草地均广泛分布。苍耳全株有毒,幼芽和果实的毒性最大,茎叶中含有对神经及肌肉有毒的物质,作为中药具有散风除湿、拘挛麻木、通窍止痛、解毒杀虫的作用[1-4]。
在植物源农药领域,苍耳提取物的杀菌活性已有很多报道。如杨顺义[5]、郭东艳[6]、何静等[7]、刘林和孟昭礼[8]、李玉平等[9]、张君霞[10]发现苍耳不同部位丙酮提取液对番茄灰霉病、辣椒丝核病菌、黄瓜枯萎病菌、番茄早疫病菌、黄瓜黑星病菌、葡萄白腐病菌、苹果腐烂病菌、小麦赤霉病菌等菌丝生长及孢子萌发均有较强抑制作用;冯俊涛等[11]在室内采用黄瓜子叶法测定苍耳全株丙酮提取物对番茄灰霉病的防护作用为65.1%,而盆栽试验对小麦白粉病的治疗效果72.5%。Amerjothy等[12]研究发现印度苍耳(X.indicum)的正己烷提取物对白色念珠菌、黑曲霉、绿脓杆菌和金黄色葡萄球菌有明显抑制作用。同时,有人对苍耳的化感活性也做了研究,如李美等[13]报道苍耳丙酮提取物对作物幼根及幼茎的生长有较强的抑制作用,其10g/L的丙酮提取物对黄瓜(Cucumissativus)幼根的抑制率高达82.6%,在质量浓度为5g/L 时对油菜(Brassicacampestris)和高粱(Sorghum vulgare)幼根的生长抑制率分别为90.7%和92.1%;高兴祥等[14]报道苍耳水浸提液对油菜种子的萌发和生长最为敏感,有较强的抑制作用,其次为萝卜(Raphanussativus)。
关于其杀虫活性,张兴等[15]在对西北地区杀虫植物资源进行初步调查中首次发现了苍耳具有杀虫活性;周琼等[16-17]报道了苍耳分离物对小菜蛾有拒食和忌避活性(或产卵忌避性);王国夫等[18]报道苍耳乙醇提取物对菜粉蝶的拒食率为96.24%,丙酮提取物触杀效果最好(48h校正死亡率为81.48%);何道航[19]对苍耳的杀虫活性物质进行了分离鉴定,发现其主要为苍耳素、β-谷甾醇和苍术甙,茎叶和种子是其主要的活性部位。而在杀虫机理方面,仅见何道航[19]和熊正燕等[20]报道:何道航[19]报道苍耳对菜粉蝶的作用机理主要是降低幼虫的血淋巴总糖和蛋白质含量,并对中肠酯酶活力有较明显抑制作用;熊正燕等[20]报道了苍耳氯仿萃取物对粘虫的拒食作用及消化酶活性的影响,结果表明处理粘虫12h中肠蛋白酶、淀粉酶和羧酸酯酶活性均被明显抑制。以上研究结果表明,以苍耳为植物源农药原料,对不同危害方式害虫的杀虫作用方式及对其解毒酶影响的研究还未见报道。因此,本文针对此问题进行研究,以期进一步明确苍耳提取物的杀虫作用方式及作用机理,为苍耳植物源农药的开发利用提供理论依据。
1 材料与方法
1.1 供试材料
苍耳2009年8月下旬采自甘肃兰州。苍耳茎叶洗净凉干,粉碎过40目筛(孔径0.37mm)后密封,置4℃冰箱中保存备用。
萝卜蚜(Lipaphiserysimi):虫源采自兰州刘家堡乡菜豆(Phaseolusvulgaris)地,在实验室盆栽菜豆苗上继代饲养,选个体大小一致,健康活泼的无翅成蚜作为供试蚜虫。
粘虫(Mythimnaseparata):甘肃农业大学养虫室内饲养,选取同代健康活泼的3~4龄幼虫供试粘虫。养虫室饲养条件:温度(25±5)℃;相对湿度(50±5)%;光照周期12h∶12h(L∶D)。
1.2 试验方法
1.2.1 苍耳提取物提取方法 取粉碎植物样品20g装入滤纸筒中,以索氏抽提法[7]分别用乙醇、氯仿、丙酮提取72h,提取液用旋转蒸发仪浓缩至少量转入刻度试管中,分别用其提取溶剂定容至20mL,浓度相当于每毫升溶液含1g干样品(1g/mL),并将其用相应溶剂稀释为1,0.7,0.4,0.1和0.05g/mL 5个浓度梯度。
1.2.2 触杀作用 萝卜蚜:采用浸虫法[21],剪取有萝卜蚜的新鲜菜豆叶,在苍耳不同浓度提取物中浸3s,放入9 cm培养皿。每处理150头萝卜蚜,设溶剂和清水对照。24h后观察其死亡情况,计算死亡率、校正死亡率,求出毒力回归式和致死中浓度LC50(LC50值表示杀死有害生物50%个体所需要的药剂浓度)。本研究中所有死亡率、校正死亡率计算公式如下:

粘虫:采用微量点滴法[21],选择3龄幼虫(平均体重5.6059mg/头)用微型进样器在中胸背板定量点滴(0.1 mL/头)不同浓度提取物。待溶剂挥发,每培养皿放入2头粘虫,每处理30头,再放入新鲜玉米(Zeamays)叶段,48h后记录死亡情况。计算死亡率、校正死亡率,求出毒力回归式和致死中浓度LC50。
1.2.3 内吸作用 将新鲜菜豆叶片叶柄插于不同浓度提取物中,72h后取出,放入保湿培养皿中,接入无翅成蚜50头。重复3次,48h后观察其死亡率。计算死亡率、校正死亡率,求出毒力回归式和致死中浓度LC50。
1.2.4 忌避作用 采用选择性忌避方法[21]。将新鲜菜豆以叶中脉为界,一侧正反涂布苍耳提取物(浓度为0.05 g/mL),另一侧涂布溶剂作为对照,每侧各接无翅成蚜25头。重复3次,于4,24,48h后记录叶片上的萝卜蚜数(叶中脉的萝卜蚜不计算在内),计算忌避率。

1.2.5 拒食作用[21-22]新鲜玉米叶在不同浓度提取物中浸渍3s,打成直径为1cm的叶碟,放入培养皿,接入经4h饥饿的4龄幼虫2头,每处理30头,设溶剂对照和清水空白对照。药后72h,用坐标纸法测量取食面积,计算拒食率和校正拒食率。求出毒力回归式和拒食中浓度AFC50。

1.2.6 胃毒作用 方法同1.2.5,记录药后72h死亡情况,计算死亡率、校正死亡率,求出毒力回归式和LC50。
1.2.7 生长调节作用 采用称体重法[21-22]:具体方法与拒食法基本相同,用0.05g/mL苍耳氯仿提取物浸渍玉米叶片3s,打成直径1cm叶碟,放入保湿培养皿,接入3龄幼虫2头,每处理30头,于24,48和72h后分别称体重,计算体重增长率。

1.2.8 乙酰胆碱酯酶(AchE)活力测定 酶液的制备:以触杀作用测定方法处理试虫,处理浓度分别为其上述试验所获得的触杀LC50,设溶剂处理为对照。在0,0.5,2,4,12,24h各取出处理组和对照组20头萝卜蚜、在0,0.5,4,12,24,48h各取出处理组和对照组10头4龄粘虫的头部,分别加入0.1mol/L,pH 7.2磷酸缓冲液4 mL,用玻璃匀浆器于冰浴中研磨,匀浆液在0~4℃条件下,3000r/min离心10min,取其上清液作酶源。
酶活力测定:参照 Manulis等[23]的方法,0.4mL反应体系中含50μL 0.1mol/L的碘化硫代乙酰胆碱,0.1 mL酶液及0.1mol/L、pH为8.0的磷酸缓冲液,在25℃水浴箱反应15min,加入3.6mL对硝基苯甲酸(DTNB)-乙醇-磷酸缓冲液,于412nm处比色,测定OD412值。重复3次,根据酶液经蛋白质含量测定得出的每毫升酶液相当的蛋白质含量,计算乙酰胆碱酯酶比活力,单位以μmol/(min·mL)表示。

1.2.9 谷胱甘肽-S-转移酶(GSTs)活力 酶液制备:萝卜蚜用内吸法,粘虫用胃毒法(处理浓度分别为其内吸LC50及胃毒LC50,设溶剂处理为对照),分别在0,4,8,12,24,48h各取对照组和处理组萝卜蚜50头和粘虫10头,加0.25mL生理盐水冰浴中匀浆后,10000r/min,4℃下离心15min,取上清液备用。
酶活力测定:参照Hansen和Hodgson[24]的方法,反应体系中谷胱甘肽(GSH)和CDNB均为1mmol/L,酶液1mL,0.1mol/L、pH 6.5磷酸缓冲液,反应总体积为3mL,25℃水浴箱中反应5min,于340nm 处比色,测定OD340值,重复3次,根据酶源蛋白质测定结果,将OD值换算成比活力ΔOD,单位以ΔOD/(mg蛋白·mL)表示。
1.2.10 多功能氧化酶(MFO)活力 酶液制备:试虫处理方法同内吸处理(萝卜蚜)和胃毒处理(粘虫)(处理浓度分别为其内吸LC50及胃毒LC50,设溶剂处理为对照),分别在0,2,4,8,12,24h各取对照组和处理组萝卜蚜50头,在0,4,8,12,24,48h各取对照组和处理组10头粘虫中肠,在1.5mL 磷酸缓冲液(0.2mol/L pH 7.8)中充分匀浆后,10000r/min,4℃下离心15min,取上清液备用。
酶活力测定:参照 Clark等[25]的方法,反应体系中1mmol/L NADPH 溶液、0.1mmol/L对硝基苯甲醚:均用缓冲溶液配制,磷酸缓冲液为pH 6.5、0.1mol/L,30℃水浴箱中反应30min,加1mmol/L HCl 1mL,终止反应;再往试管中加5mL氯仿萃取,移取氯仿层3mL到另一试管内,加0.5mol/L NaOH 3mL萃取;取NaOH溶液层2mL于400nm处比色,测定OD400值,重复3次,根据对硝基苯酚标准曲线求得酶促反应生成的硝基苯酚量,酶活力单位以μmol/(min·mL)表示。
1.3 统计分析
采用Excel软件进行统计,用SPSS 17.0软件进行毒力回归分析及Duncan法显著性分析。
2 结果与分析
2.1 苍耳3种提取物对萝卜蚜和粘虫的杀虫作用方式
2.1.1 触杀作用 苍耳3种提取物对萝卜蚜和粘虫的触杀作用测定结果(表1)显示,苍耳3种溶剂提取物对萝卜蚜和粘虫有一定的触杀作用,且随提取物浓度的增高触杀作用增强,同时显示,对萝卜蚜和粘虫触杀作用最高的为氯仿提取物,校正死亡率最高分别为67.24%和47.90%,LC50分别为0.7420和1.3070g/mL,其次为丙酮提取物,再次是乙醇提取物;另外,由表中可以看出,苍耳提取物对萝卜蚜的触杀作用整体较对粘虫的高。
2.1.2 内吸作用 苍耳3种溶剂提取物对萝卜蚜的内吸作用测定结果(表2)表明,苍耳各提取物对萝卜蚜的内吸作用均较弱,乙醇、氯仿和丙酮提取物对萝卜蚜的内吸校正死亡率最高分别为12.35%,12.13%和10.46%,LC50分别达到36.8347,42.7764和55.9830g/mL。
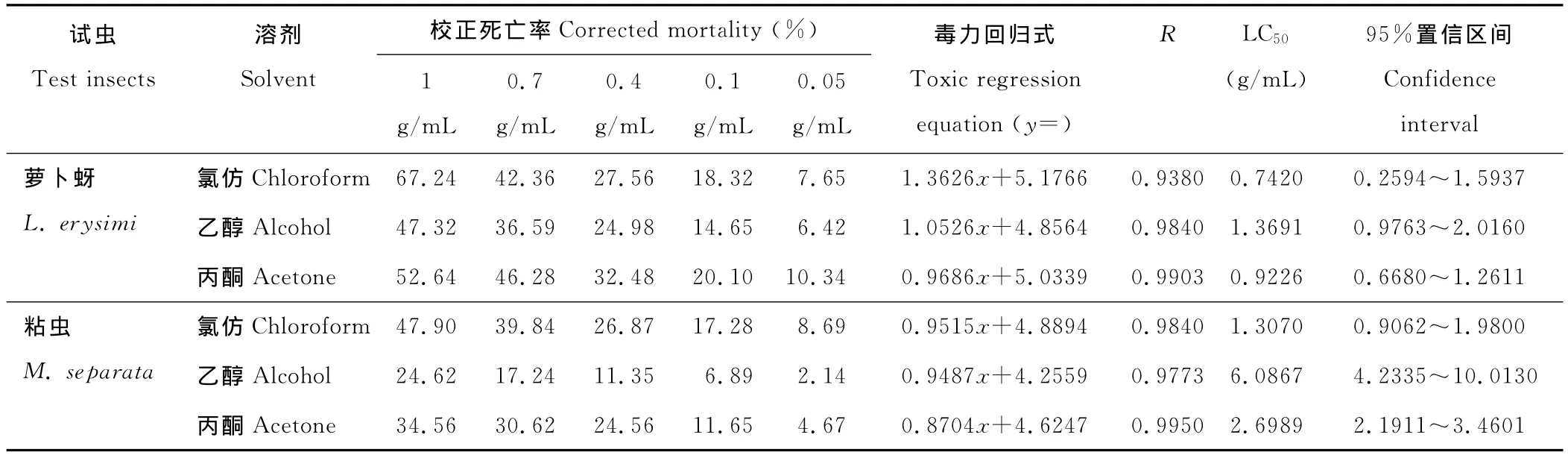
表1 苍耳提取物对萝卜蚜和粘虫的触杀作用测定Table 1 Test of contact toxicity of the extraction of X.sibiricumon L.erysimi and M.separata

表2 苍耳提取物对萝卜蚜的内吸作用测定Table 2 Test of systemic action of the extraction of X.sibiricumagainst L.erysimi
2.1.3 忌避作用 苍耳3种溶剂提取物对萝卜蚜的忌避作用测定结果(表3)表明,3种提取物对萝卜蚜均具有较高忌避活性,处理4h,其忌避率均大于87%,且苍耳氯仿提取物的忌避活性最强,忌避率为94.25%;随时间推移,3种提取物忌避率下降,48h丙酮提取物忌避率最低,为62.48%,与氯仿和乙醇提取的忌避率差异极显著,而后两者差异不显著,忌避率均高于80%。

表3 苍耳提取物对萝卜蚜的忌避作用测定Table 3 Test of repellency action of the extraction of X.sibiricumagainst L.erysimi %
2.1.4 拒食作用 苍耳3种溶剂提取物对粘虫的拒食作用测定结果(表4)表明,拒食活性与提取物浓度呈正比,且苍耳氯仿和丙酮提取物对粘虫均具有较强拒食活性,在浓度为1g/mL时,校正拒食率为98.27%和95.67%,AFC50分别为0.1985和0.2414g/mL;苍耳乙醇提取物对粘虫拒食活性较弱,其 AFC50为1.8277 g/mL。
2.1.5 胃毒作用 苍耳提取物对粘虫幼虫的胃毒作用测定结果表明(表5),苍耳氯仿、乙醇和丙酮3种提取物对粘虫均有一定胃毒作用,在1g/mL时校正死亡率分别为57.14%,54.08%和56.00%,LC50分别为0.8997,1.1351和0.8521g/mL。
2.1.6 生长调节作用 苍耳提取物对粘虫的生长调节作用见表6。结果表明,用浓度为0.05g/mL的苍耳氯仿、乙醇和丙酮提取物处理后,处理粘虫的体重增长率由0~48h间的缓慢增长趋势变为逐渐下降,72h时后体重增长率分别为-5.85%,35.91%和16.61%,以苍耳氯仿提取物的抑制作用最强,对照粘虫幼虫体重增长率高达588.93%,差异达极显著水平。

表4 苍耳提取物对粘虫的拒食作用测定Table 4 Test of antifeeding action of the extraction of X.sibiricumagainst M.separata

表5 苍耳提取物对粘虫的胃毒作用测定Table 5 Test of stomach toxicity of the extractions of X.sibiricumagainst M.separata
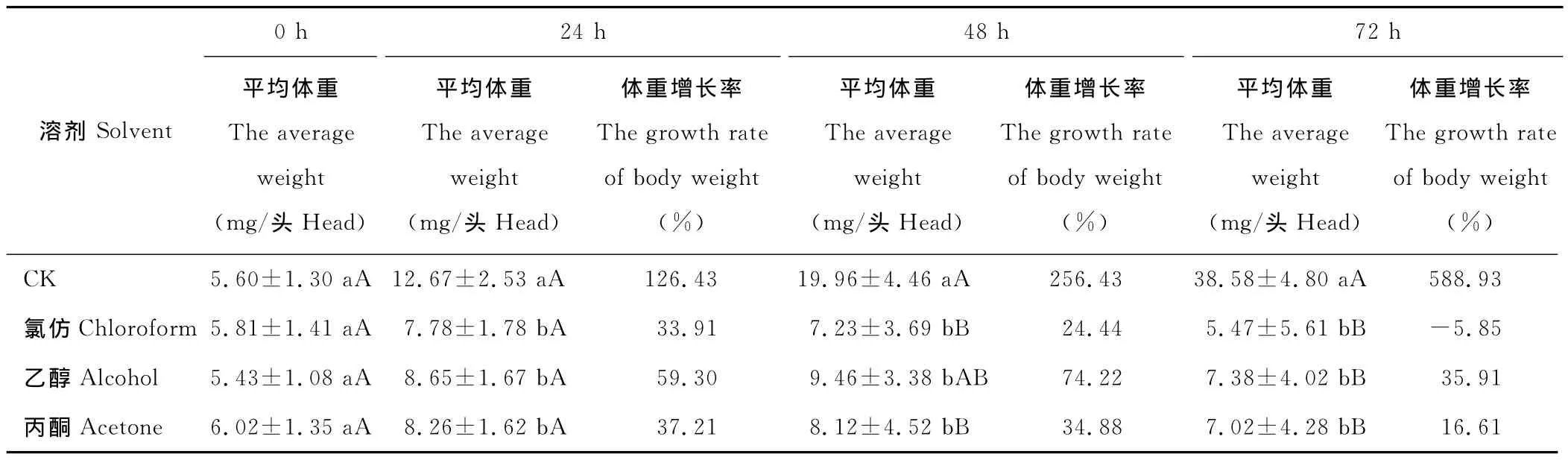
表6 苍耳提取物对粘虫生长调节作用测定Table 6 Test of growth inhibition action of the extraction of X.sibiricumagainst M.separata
2.2 试虫中毒症状描述
2.2.1 萝卜蚜中毒症状 用浸虫法处理萝卜蚜时,可以观察到,萝卜蚜在接触苍耳提取物0~0.5h时虫体腹部向上翘起,后足伸展,表现麻痹状态,2h后逐渐恢复,拔出口针,四处爬行,大部分爬到培养皿边,少部分停留在叶柄部分,在叶面上几乎没有萝卜蚜;对照处理接上萝卜蚜之后,试虫很少爬动,大部分停留在叶面上,24h后,虫体死亡,体色变褐。
2.2.2 粘虫中毒症状 粘虫触杀试验中,处理几秒后,多数试虫四处爬行并翻滚、不停摇动头部,一些试虫头部和腹末向上尽力抬起,0.5h后,个别粘虫身体蜷缩,用硬物触动,没有反应,4h后恢复行动,但行动迟缓,爬到叶片上进行取食,但取食量明显少于对照。12h后,未恢复行动粘虫体色变黑,虫体萎缩僵硬死亡。
拒食试验中,试虫只用口器轻碰叶片,但不取食,在叶片周围及培养皿边缘爬行或静止不动,不接近叶片;经过一段时间饥饿,健壮粘虫取食衰弱粘虫,只有部分少量取食叶片,取食后48h体色变深,萎缩、僵硬,最后死亡,个别行动迟缓,48h后并不死亡,随后其取食和行动逐渐恢复,72h后,生长发育较对照粘虫缓慢,虫体萎缩,平均体重显著小于对照,化蛹期比对照推迟2~3d。
胃毒试验中,粘虫对夹毒叶片表现极强不选择性,所有粘虫均取食未涂药液一面叶碟,而将有药液一面叶碟较完整的保留下来,当饥饿一段时间后,有少量取食。取食后症状与拒食试验取食后症状相同。
2.3 苍耳氯仿提取物对萝卜蚜和粘虫解毒酶活性的影响
2.3.1 乙酰胆碱酯酶(AchE) 苍耳氯仿提取物对萝卜蚜乙酰胆碱酯酶(AchE)活力的影响结果(图1)表明,苍耳氯仿提取物对萝卜蚜AchE产生抑制作用。处理0~0.5h,AchE活力迅速下降,0.5h抑制率为27.78%,随后AchE活力有所升高,但其活力均比对照低,处于抑制状态,12h后,AchE活力又迅速下降,处理萝卜蚜AchE比活力为1.53μmol/(min·mL),与对照相比处理AchE活力的抑制率达到最高,为37.55%。
苍耳氯仿提取物对粘虫AchE活力测定结果(图2)表明,苍耳氯仿提取物对粘虫AchE活力同样有抑制作用,在4h时,处理粘虫AchE比活力为3.42μmol/(min·mL),抑制率达最高,为25.65%。随后处理粘虫AchE活力逐渐升高,12h时,酶被激活,激活率为9.42%;之后处理粘虫体内AchE活力又下降,到48h一直处于被抑制状态。

图1 苍耳氯仿提取物对萝卜蚜的AchE活力的影响Fig.1 AchE activity of the chloroform extraction of

图2 苍耳氯仿提取物对粘虫的AchE活力的影响Fig.2 AchE activity of the chloroform extraction of
2.3.2 谷胱甘肽-S-转移酶(GSTs) 由图3可以看出,苍耳氯仿提取物对萝卜蚜体内谷胱甘肽-S-转移酶(GSTs)活力有激活作用,24h时,处理酶活力与对照酶活力分别为0.056和0.041ΔOD/(mg蛋白·mL),激活率最高为26.79%,48h后,又被抑制。
苍耳氯仿提取物对粘虫谷胱甘肽-S-转移酶(GSTs)活力有先抑制后激活的影响,如图4所示,0~8h,处理粘虫GSTs比活力较对照低,其酶被抑制,抑制率最高为18.11%;8~12h后处理粘虫酶比活力高于对照,24h时,对照和处理酶比活力分别为0.320和0.420ΔOD/(mg蛋白·mL),其激活率为23.81%;24h后酶活力有所降低,逐渐与对照相当。
2.3.3 多功能氧化酶(MFO) 苍耳氯仿提取物对萝卜蚜多功能氧化酶(MFO)活力影响不明显。如图5所示,在0~2h内,苍耳氯仿提取物对萝卜蚜的 MFO活力的影响呈上升趋势,处理2hMFO被激活,激活率为13.44%;在2~8h间,酶活力呈下降趋势,8h时处理酶活力被抑制,抑制率为11.89%,8~12h时处理组MFO呈上升趋势,之后又下降,但处理组与对照组比活力差别不大。
苍耳氯仿提取物对粘虫MFO活力的影响见图6。结果表明,在取食带毒叶片0~4h内,处理粘虫体内MFO活力被微弱抑制;在8~48h,表现较弱激活作用,48h时,激活作用最高,对照酶比活力为3.85μmol/(min·mL),处理粘虫的为4.94μmol/(min·mL),激活率达22.06%。

图3 苍耳氯仿提取物对萝卜蚜的GSTs活力的影响Fig.3 GSTs activity of the chloroform extraction of
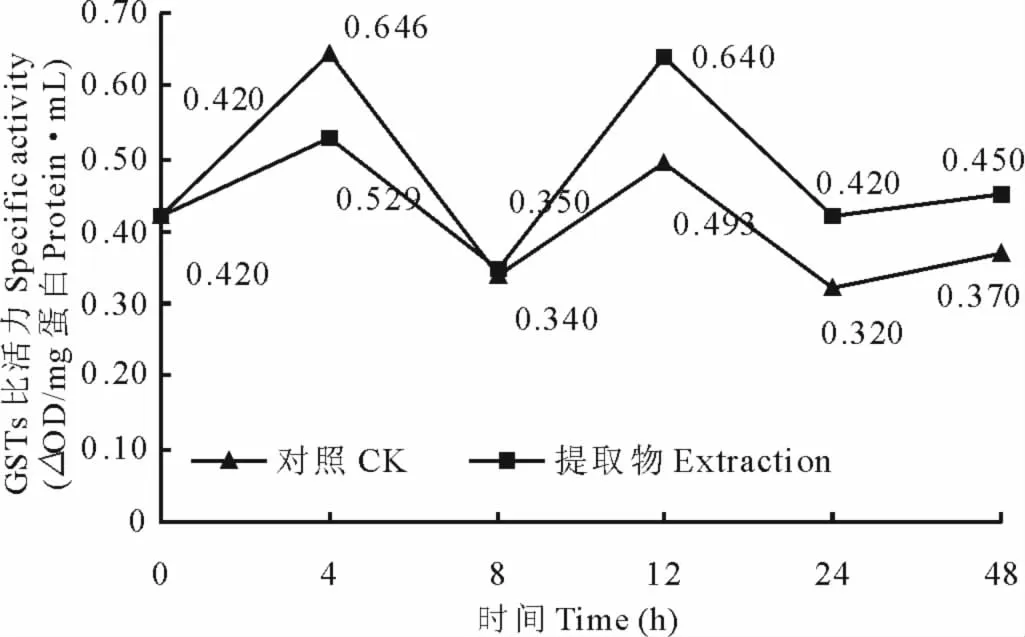
图4 苍耳氯仿提取物对粘虫的GSTs活力的影响Fig.4 GSTs activity of the chloroform extraction of

图5 苍耳氯仿提取物对萝卜蚜的MFO活力的影响Fig.5 MFO activity of the chloroform extraction of
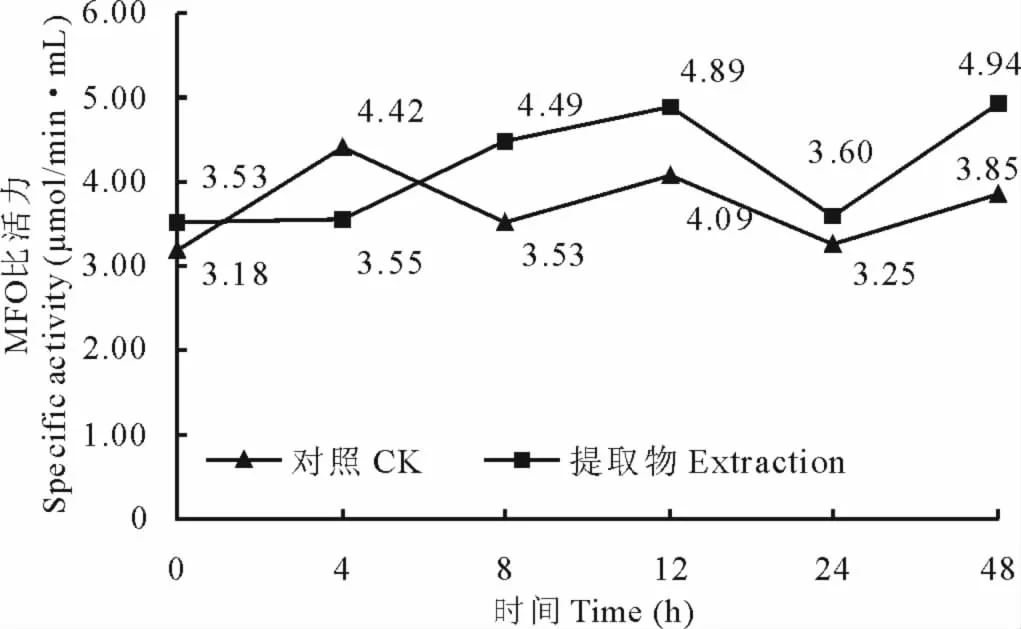
图6 苍耳氯仿提取物对粘虫的MFO活力的影响Fig.6 MFO activity of the chloroform extraction of
3 结论与讨论
乙酰胆碱酯酶(AchE)是大多数神经毒剂农药的作用靶标。主要作用是催化昆虫中枢神经系统传导物乙酰胆碱(Ach)的水解,其活性受到抑制,势必会引起昆虫神经传导的异常反应,直至最终阻断突触传递,使昆虫死亡[26-27]。本研究中,触杀法处理萝卜蚜和粘虫后,其AchE立即受到抑制,萝卜蚜表现痉挛,而粘虫表现焦躁不安的过度兴奋状态,之后逐渐恢复,说明苍耳氯仿提取物是试虫神经靶标AchE的抑制剂,但是,AchE活力会恢复,这一点与一般的神经毒剂不同,可能原因有:活性物质与AchE的结合是可逆的;另外可能与GSTs及MFO的解毒代谢有关。
谷胱甘肽-S-转移酶(GSTs)和多功能氧化酶(MFO)都是昆虫体内重要的解毒酶系。GSTs能使有害的亲电物质与内源的还原型谷胱甘肽(GSH)结合,参与转运体内重要的脂类化合物[28];当苍耳氯仿提取物处理萝卜蚜24h之前,其GSTs被激活,说明苍耳氯仿提取物具有杀虫活性物质,或对萝卜蚜能够产生有害的亲电物质,但随着时间延长,酶又被抑制,表明其解毒能力下降,而此时萝卜蚜AchE和MFO同处在抑制状态,从而引起虫体死亡。而MFO系是一类由细胞色素P 450、细胞色素b 5、NADPH-细胞色素b 5还原酶、NADPH-细胞色素c还原酶及磷脂等组成的氧化酶系,能够催化各种结构不同的内源或外源化合物氧化,如脂肪酸、甾体激素、药物、杀虫剂及各种环境有害化合物等,与害虫抗药性发展密切相关的重要酶系[29],本研究中苍耳氯仿提取物对萝卜蚜和粘虫的MFO活力影响不明显,说明苍耳杀虫作用与该酶系关系不大,反之亦说明萝卜蚜和粘虫对苍耳氯仿提取物不易产生抗性。
粘虫对苍耳氯仿提取物表现极高的拒食活性,其取食量非常小,从而导致进入虫体的药液量少,但当粘虫取食一定量的毒叶后,粘虫表现活动迟缓,生长发育被抑制。这很有可能是因为拒食活性高,取食少造成其营养缺乏,从而被饿死;另一个原因可能是:当粘虫取食少量毒叶后,其体内重要的解毒酶——GSTs和MFO活力均被微弱抑制,粘虫表现中毒症状为行动迟缓,而之后,酶又被激活,使得其解毒作用增强,代谢加速,使昆虫产生暂时的耐药性,以帮助其渡过“危险期”,从而使得不表现高的胃毒活性。但粘虫为了维持这种高水平的解毒过程,消耗了体内大量的能量导致体能衰竭,直至最终死亡;而其他存活的个体,也因为耗能太多,造成体质衰弱,生活力差,因此又表现很高生长发育抑制作用。
本文针对试虫中毒症状,研究了试虫3种酶的活性,基本明确了其杀虫机理是对其AchE活性的抑制作用。同时,也得出,苍耳氯仿提取物对试虫内吸及胃毒活性低的原因可能与GSTs的激活有关。但是试虫对苍耳提取物的拒食及忌避机理是什么,苍耳中究竟含有哪些影响试虫取食的成分等问题,还有待于进一步研究。
[1]韩婷,秦路平,郑汉臣,等.苍耳及其同属药用植物研究进展[J].解放军药学学报,2003,19(2):122-125.
[2]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1985:324.
[3]Roussakis C,Chinou I,Vayas C,etal.Cytotoxic activity ofXanthatinand the crude extracts ofXanthiumstrumarium[J].Planta Medica,1994,60(5):473-474.
[4]国家中医药管理局.中华本草(第7册)[M].上海:科学技术出版社,1999:7084.
[5]杨顺义.苍耳、狼毒等植物提取物抑菌活性的初步研究[D].兰州:甘肃农业大学,2003.
[6]郭东艳.苍耳提取物中抑菌成分的初步分离与鉴定[D].兰州:甘肃农业大学,2004.
[7]何静,沈慧敏,张新虎.七种植物粗提物对常见植物病菌的抑菌作用研究[J].甘肃农业大学学报,2004,39(4):447-450.
[8]刘林,孟昭礼.苍耳抑菌活性的初步研究[J].莱阳农学院学报,2003,20(4):261-263.
[9]李玉平,慕小倩,冯俊涛,等.几种菊科植物杀菌活性的初步研究[J].西北农林科技大学学报(自然科学版),2002,30(1):68-71.
[10]张君霞.十五种植物提取物抑菌活性的初步研究[J].甘肃农业大学学报,2003,12(2):122-124.
[11]冯俊涛,祝木金,于平儒,等.西北地区植物源杀菌剂初步筛选[J].西北农林科技大学学报(自然科学版),2002,30(6):129-133.
[12]Amerjothy S,Ezhilarasi R,Shanmugakumar S D,etal.Short communication antimicrobial assay of the leaf extracts ofXanthiumindicumKoen[J].Pharmacognosy Magazine,2010,6(23):158-161.
[13]李美,高兴祥,高宗军,等.苍耳4种溶剂提取物除草活性的研究[J].植物资源与环境学报,2007,16(1):45-48.
[14]高兴祥,李美,高宗军,等.苍耳对不同植物幼苗的化感作用初探[J].草业学报,2009,18(2):95-101.
[15]张兴,杨崇珍,王兴林,等.西北地区杀虫植物资源初步调查[J].甘肃农业大学学报,1993,2(11):93-98.
[16]周琼,魏美才,刘炳荣,等.苍耳不同分离物对害虫的拒食和忌避活性[J].植物保护,2007,(6):81-84.
[17]周琼,刘炳荣,舒迎花,等.苍耳等药用植物提取物对小菜蛾的拒食作用和产卵忌避效果[J].中国蔬菜,2006,(2):17-20.
[18]王国夫,钟俊燕,胡春霞.苍耳有效成分的提取及其杀虫活性的研究[J].北方园艺,2010,(3):155-157.
[19]何道航.苍耳的杀虫活性及其有效成分研究[D].广州:华南农业大学,2002.
[20]熊正燕,周琼,苏旭.苍耳氯仿萃取物对粘虫的拒食作用及酶活性的影响[J].湖南师范大学学报(自然科学),2010,33(1):120-223.
[21]慕立义.植物化学保护研究方法[M].北京:中国农业出版社,1994:234-235.
[22]张宗炳.杀虫药剂的毒力测定[M].北京:科学出版社,1988:59-82.
[23]Manulis S,Ishaaya I,Perry A S.Acetylcholinesterase ofAphiscitricolaproperties and significance in determining toxicity of systemic carbamate compounds[J].Pesticide Biochemistry and Physiology,1981,13:267-274.
[24]Hansen L G,Hodgson E.Biochenical characteristics of insect microsames,N-and O-demethylation[J].Biochempharmacal,1971,20(7):1569-1573.
[25]Clark A G,Dick G L,Sminth J H.Kinetic studies on a glutathione stranferase from the larvae ofCostelytrazealandica[J].Biochemical Journal,1984,217(1):51-58.
[26]赵善欢.昆虫毒理学原理[M].广州:广东科技出版社,1993.
[27]张静,冯岗,马志卿,等.细辛醚对粘虫幼虫的毒力及几种重要酶系的影响[J].昆虫学报,2007,50(6):574-577.
[28]吕敏,刘惠霞,吴文君.谷胱甘肽-S-转移酶与昆虫抗药性的关系[J].昆虫知识,2003,40(3):204-207.
[29]高新菊,沈慧敏.二斑叶螨对甲氰菊酯的抗性选育及解毒酶活力变化[J].昆虫学报,2011,(1):64-69.
