不同紫云英基因型根系分泌物中有机酸成分分析
2014-01-02林新坚兰忠明张辉王飞何春梅
林新坚,兰忠明,张辉,王飞,何春梅
(福建省农业科学院土壤肥料研究所 农业资源与环境研究中心,福建 福州350013)
低分子量有机酸是指相对分子质量<500的含羧基化合物,是土壤中广泛存在的一类非常活泼的物质。它们主要来源于土壤表层动植物残体的分解、微生物的代谢作用、植物根系的分泌物和施入土壤有机物的转化[1-3]。低分子量有机酸是植物根系分泌物中最为重要的成分,它们在养分活化、改变土壤微生物活性以及缓解金属元素毒害胁迫方面发挥重要作用[4]。不少研究结果表明,许多植物的根系如白羽扇豆(Lupinusalbus)[5-8]、木豆(Cajanuscajan)[9-10]、大麦(Hordeumvulgare)[11]、菜豆(Phaseolusvulgaris)[12-13]等都能够分泌大量的低分子量有机酸(柠檬酸、苹果酸、草酸、丙二酸、琥珀酸和酒石酸等),这些低分子量有机酸能够溶解部分难溶性磷,提高土壤磷素有效性进而促进植物活化吸收利用难溶性磷酸盐的作用[14-16]。有研究表明,根系分泌有机酸的分泌量是植物本身的反应特征,受植物的种类、遗传特性的影响。因而,不同作物品种有机酸分泌量存在很大差异,且同一作物种类不同基因型其有机酸分泌量也存在差异。有学者提出,提高磷有效性最有效的途径,就是培育耐低磷及磷高效利用品种[17]。在低磷条件下,植物主要通过还原和络合反应提高土壤中难溶性磷的生物有效性,有机酸的分泌也能活化土壤中的难溶性磷[18],从而促进植物对磷的吸收。目前有用化学浸提法研究有机酸对几种人工合成磷酸盐(Ca2-P、Fe-P和Al-P)的活化作用,发现低分子质量有机酸对难溶性磷酸盐的活化能力与有机酸种类、浓度有关,有机酸浓度增加,磷酸盐溶解度增加,这主要是有机酸能与土壤中难溶性化合物中阳离子进行螯合反应,促进难溶性养分的溶解,从而释放难溶性养分。目前国内对植物根系分泌物的研究,大多集中在水培和沙培研究,对在土培或原位条件下(能够很大程度上反映田间条件下真实分泌情况)收集植物根系分泌物研究报道较少,因此本研究尝试分析不同紫云英(Astragalussinicus)基因型在土培条件下根系分泌物中有机酸成分及差异。
1 材料与方法
1.1 供试材料
供试紫云英品种有9个:1-闽紫1号,2-信阳种,3-闽紫7号(8324411),4-8487711,5-浙紫5-12,6-闽紫6号,7-余江大叶,8-84341022,9-弋江籽,3次重复。试验于2011年11月1日播种,2012年2月8日收集根系分泌物并采收。紫云英种植在黑色塑料袋内,规格为直径15cm,高度12cm。培养基质为土壤与蛭石混合,重量为1 kg,土壤与蛭石比重约6∶1,搅拌混匀装袋。供试土壤为水稻土,其土壤本底养分分别为碱解氮117.3mg/kg,有效磷30.2mg/kg,速效钾69.8mg/kg,pH 5.01,有机质18.0g/kg,全磷0.51g/kg。
1.2 根系有机酸收集
紫云英根系有机酸收集:采用抖土法将根系松散结合的土壤抖落,剩余的与根系紧密结合的土壤为根际土,把根与根际土一同浸入50mL去离子水塑料纸杯中,培养4h,取出根系,充分混匀土壤悬浊液,用定量滤纸202将根系分泌物溶液过滤到容积为50mL塑料瓶中,定容到40mL(即为紫云英根系分泌物),放置-20℃冷冻冰箱保存备用。清洗根部,用剪刀剪植株地上茎叶和根部,分别装入信封,在105℃下杀青30min后,均匀稳定在75℃下,48h烘至恒重。
1.3 有机酸测定方法
土培条件下收集的紫云英根系分泌物上Waters2695高效液相色谱仪(HPLC)。样品和标样的前处理:用平头注射器吸取1mL样液,过0.45μm水相滤膜,等待进样。流动相:0.04mol/L磷酸二氢钾-磷酸缓冲溶液,pH为2.40。流速:1.0mL/min,进样量:5μL,温度:35℃,色谱柱:菲罗门柱,4.6mm×250mm,检测器:二极管阵列检测器Waters2996。有机酸标准样品的配制:分别称取草酸500mg,酒石酸500mg,苹甲酸500mg,柠檬酸500mg,马来酸500mg,琥珀酸20mg,这6种有机酸定容体积都为10mL;分别吸取甲酸、乳酸、乙酸各5mL,定容体积分别为25,50和50mL。混标1:上机浓度9种酸各自标准母液混合并稀释10倍(标样取100μL,用流动相定容到1mL),混标2:马来酸稀释1000倍,其余各酸标准溶液稀释10倍(马来酸取10μL,其余各酸取1mL,最后用流动相定容到10mL)。
1.4 数据处理
本文的结果数据为3次重复的平均值,数据进行ANOA方差分析,并用LSD进行多重比较。数据分析及图表均在 Microsoft Excel 2003和 DPS 12.5软件上进行。
2 结果与分析
2.1 不同紫云英基因型性状及干物重差异
从表1可以看出,不同紫云英品种在土培条件下其株高、根长及干物重的差异表现为:闽紫6号,闽紫7号和8487711之间株高差异不显著,但这3个品种显著高于闽紫1号,信阳种,余江大叶和弋江籽;紫云英根部长度9个品种间差异不显著,可能由于生长在小型容器范围内限制了根系的生长。从紫云英地上部茎叶和地下根部干物质看,闽紫7号显著高于闽紫1号,但与其他几个品种间未见显著差异。然而在总干重方面(地上部和地下部干重总和),闽紫7号显著大于闽紫1号,余江大叶和弋江籽。
2.2 不同紫云英基因型根系分泌草酸、苹果酸浓度差异
从图1和图2可见,不同紫云英基因型分泌的草酸和苹果酸浓度分别介于0.015~0.034mg/mL和0.001~0.031mg/mL之间。9个紫云英品种都可分泌草酸,且重复间稳定变异系数不大;84341022(0.034mg/mL)分泌的草酸量最大,显著高于闽紫1号、闽紫7号、8487711、浙紫5-12、余江大叶和弋江籽,但84341022与信阳种和闽紫6号之间差异不显著。在苹果酸分泌方面,除弋江籽未检测到,其余8个品种都有一定量苹果酸分泌;闽紫1号苹果酸分泌量低,仅为0.001mg/mL,闽紫7号分泌量最大达到0.031mg/mL;闽紫7号和浙紫5-12这2个品种苹果酸分泌量显著高于闽紫1号,但除闽紫1号外,其他品种间未见显著差异,究其原因可能与重复间变动差异大有关。
2.3 不同紫云英基因型根系分泌乳酸、乙酸浓度差异
从图3可见,紫云英乳酸分泌量介于0.027~0.530mg/mL,闽紫7号和浙紫5-12乳酸分泌量大,分别为0.53和0.52mg/mL;但经过方差分析表明,9个品种间乳酸分泌未见显著差异,其原因是重复间变动差异大所致。从图4可以看出,乙酸分泌量为0.01~0.14mg/mL,闽紫1号和闽紫7号显著高于闽紫6号、余江大叶、84341022和弋江籽,但闽紫1号、信阳种、闽紫7号和8487711品种间乙酸分泌未见显著差异。
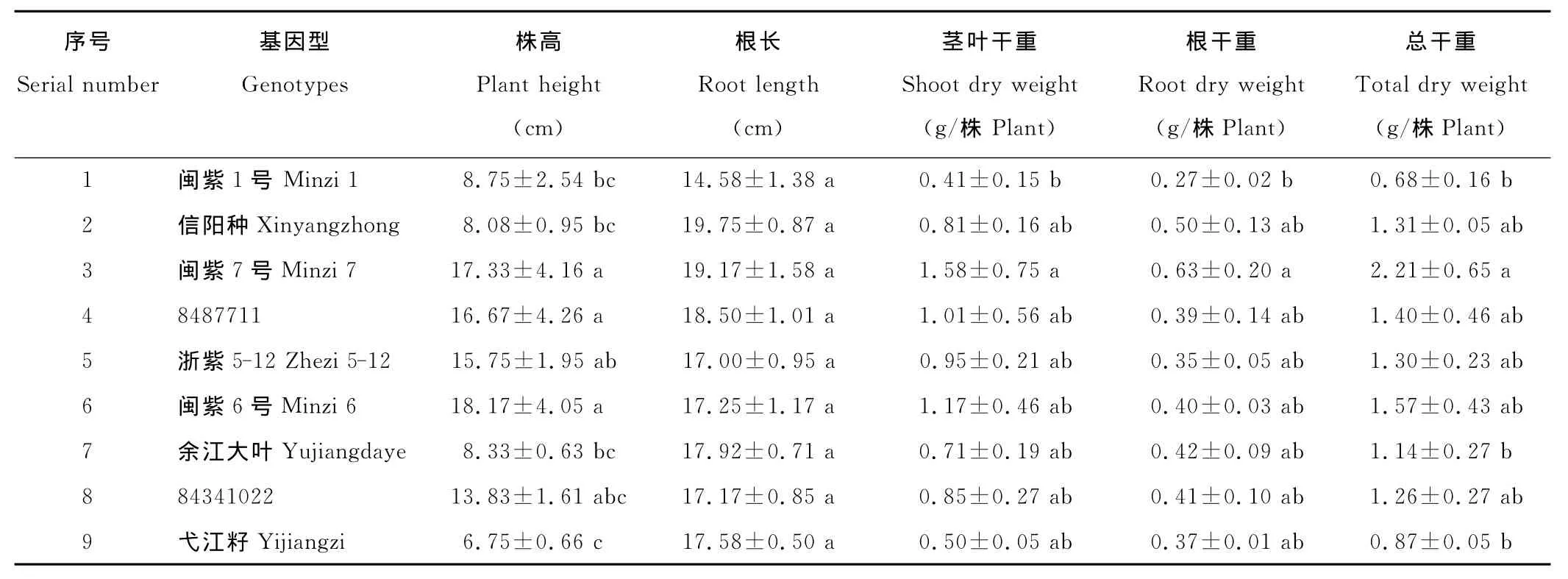
表1 不同紫云英基因型性状及干物重差异Table 1 Effect of genotypic character of different A.sinicus on dry weight
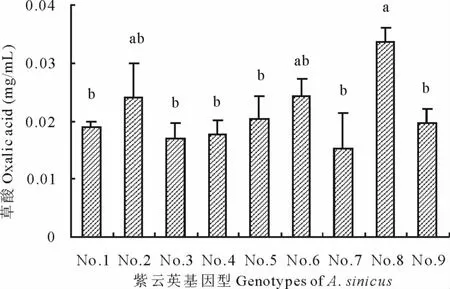
图1 不同紫云英基因型草酸浓度差异Fig.1 Effect of genotypic variation of different A.sinicus on oxalic acid
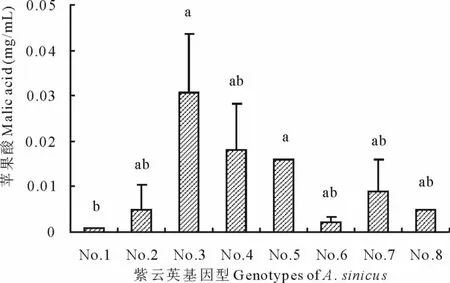
图2 不同紫云英基因型苹果酸浓度差异Fig.2 Effect of genotypic variation of different A.sinicus on malic acid

图3 不同紫云英基因型乳酸浓度差异Fig.3 Effect of genotypic variation of different A.sinicus on lactic acid
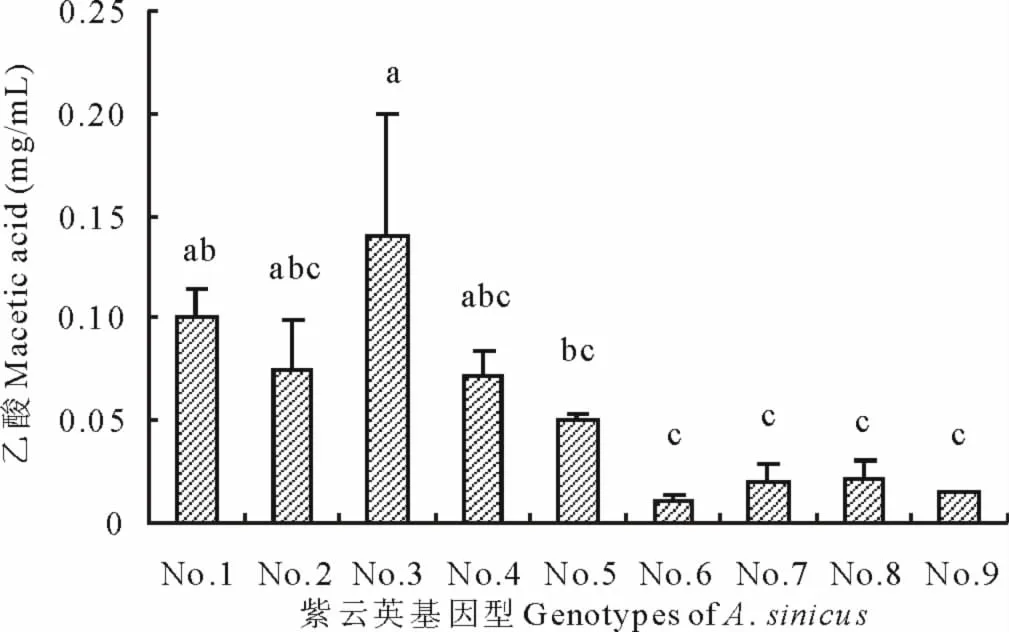
图4 不同紫云英基因型乙酸浓度差异Fig.4 Effect of genotypic variation of different A.sinicus on macetic acid
2.4 不同紫云英基因型根系分泌柠檬酸、琥珀酸浓度差异
从图5和图6可见,不同紫云英基因型分泌的柠檬酸和琥珀酸酸浓度分别介于0.037~0.152mg/mL和0.005~0.314mg/mL之间。闽紫7号、84341022和浙紫5-12(这3个品种间无显著差异)柠檬酸分泌量显著高于闽紫1号、信阳种、弋江籽和余江大叶。在琥珀酸分泌量方面,其浓度闽紫7号除与84341022相近外,都显著高于其他各个品种;闽紫7号琥珀酸分泌量是余江大叶的62.8倍。
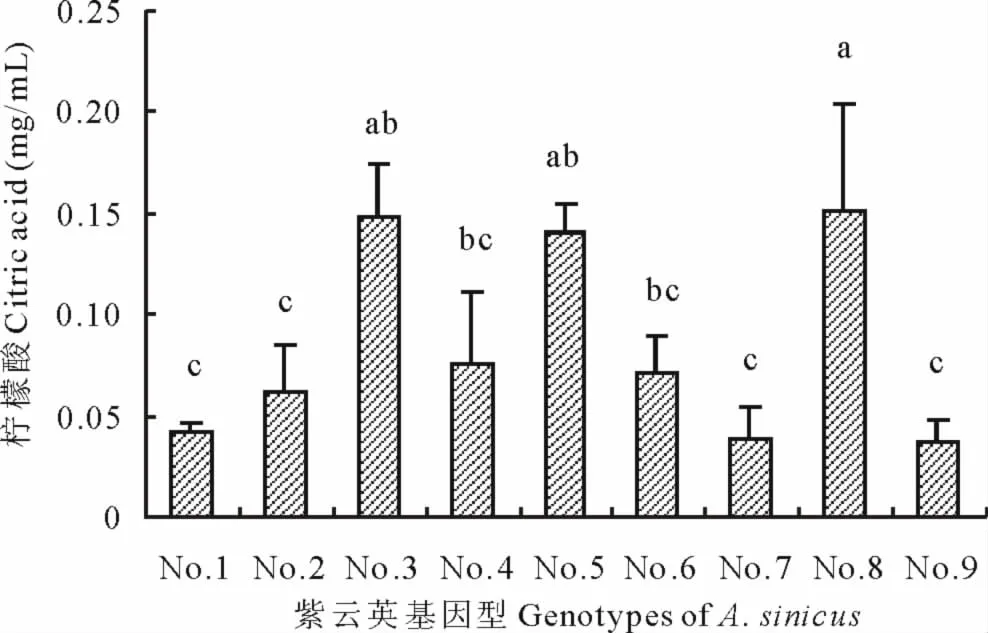
图5 不同紫云英基因型柠檬酸浓度差异Fig.5 Effect of genotypic variation of different A.sinicus on citric acid
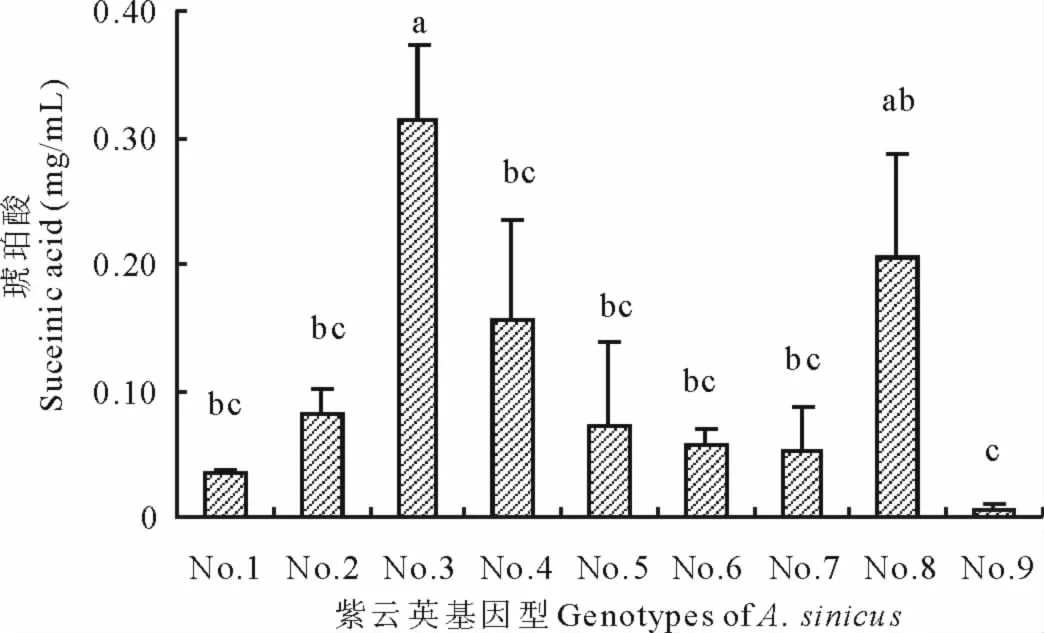
图6 不同紫云英基因型琥珀酸浓度差异Fig.6 Effect of genotypic variation of different A.sinicus on suceinic acid
2.5 不同紫云英基因型根系分泌有机酸总量差异
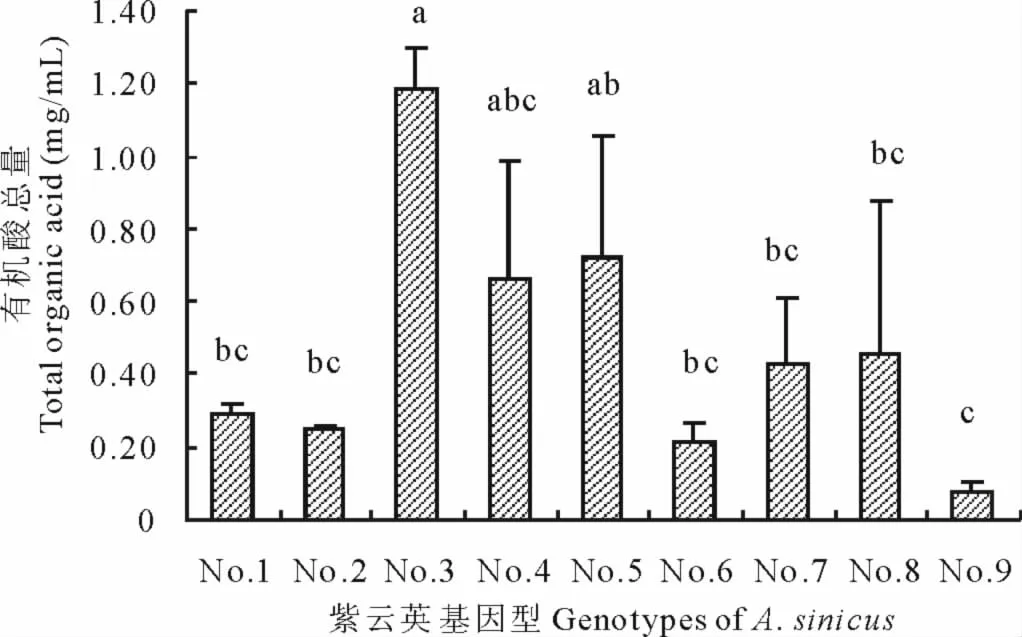
图7 不同紫云英基因型有机酸总量差异Fig.7 Effect of genotypic variation of different A.sinicus on total organic acid
有机酸总量为各个紫云英品种分泌的草酸、苹果酸、乳酸、乙酸、柠檬酸和琥珀酸的总和。从图7可以看出,土培条件下紫云英有机酸分泌总量介于0.075~1.181mg/mL;大体可以分为 3 类:8324411、浙紫5-12、8487711,84341022、余江大叶、闽紫1号、信阳种、闽紫6号,弋江籽;闽紫7号总的有机酸最大,弋江籽有机酸总量最低,仅为0.075 mg/mL,闽紫7号有机酸总量是弋江籽的约15倍;此外,闽紫7号显著高于闽紫1号、信阳种、闽紫6号、余江大叶、84341022和弋江籽;但闽紫7号与8487711、浙紫5-12未见显著差异。
2.6 不同紫云英基因型根系分泌各有机酸与生物量的关系
从图8可以看出,紫云英分泌有机酸(草酸、苹果酸、乳酸、乙酸、柠檬酸和琥珀酸)与植株生物量的相关拟合关系表明,紫云英根系分泌的草酸、乳酸、乙酸和柠檬酸与生物量拟合度较低,其对应的相关系数(r<ɑ0.05),差异不显著。然而,紫云英根系分泌的苹果酸、琥珀酸与生物量拟合相关系数差异达到极显著水平,呈极显著正相关。因此,所分泌的苹果酸和琥珀酸含量的高低可以一定程度上表征紫云英生物量高低,或者某种意义上说明其对土壤中难溶性养分的释放与溶解发挥着重要作用,所释放与溶解的养分可供紫云英吸收利用,进而影响紫云英生长及生物量。
2.7 不同紫云英基因型根系分泌有机酸总量与生物量的关系

图8 紫云英根系分泌各有机酸与植株生物量的关系Fig.8 Relationship between plant biomass and each organic acid
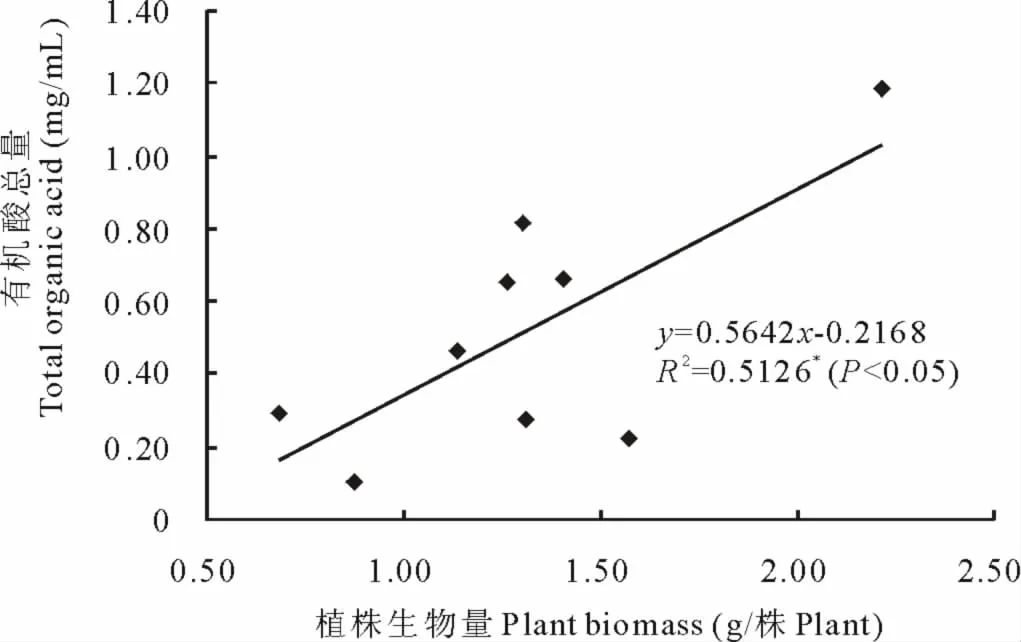
图9 根系分泌有机酸总量与植株生物量的关系Fig.9 Relationship between plant biomass and total organic acid
从图9可以看出,紫云英根系分泌的有机酸总量与生物量呈显著正相关关系。因此,有机酸分泌的高低对紫云英植株生长及生物量影响显著。大量研究表明,有机酸对酸性土壤中 Al-P和 Fe-P中 Al3+、Fe3+的螯合有利,可使难溶性Al-P和Fe-P中的P释放出来供植物吸收利用。本试验结果显示,紫云英在土培条件下可分泌6种成分有机酸,当然在实际条件下,所分泌的有机酸种类可能还远远高于这些,在利用高效液相色谱测定时只选定常见成分9种有机酸(另外3种酸是甲酸、酒石酸和马来酸)进行标定。土壤养分的高低对紫云英生物量影响很大,然而在同等土壤背景条件下,作物有机酸分泌量势必很大程度上影响植物的生长,它能充分与土壤中难溶性化合物中阳离子进行螯合反应,促进难溶性养分的溶解,释放出有效养分供植物吸收利用。9个不同紫云英基因型中,分泌有机酸累积量最高的品种为闽紫7号,最低为弋江籽,其对应的生物量闽紫7号也是最高,虽然弋江籽的生物量不是最低,但也接近最低。
3 讨论
兰忠明等[17]报道了用溶液培养法收集不同紫云英基因型根系分泌物,显现出有机酸的差异性,主要成分是草酸;个别基因型还分泌出少量酒石酸、柠檬酸、苹果酸、琥珀酸等[13];通过石英砂培养试验,表明闽紫6号和闽紫1号在利用难溶性磷时都显著高于余江大叶和弋江籽。不同紫云英基因型在不同磷源中,地上部、地下部吸磷量及总吸磷量也均表现为K-P>Al-P>Fe-P>CK,紫云英对难溶性磷吸收利用时,对Al-P吸收富集优于Fe-P[14];然而,在土培条件下,所有基因型都检测到对应的有机酸(除弋江籽和苹果酸外),3个重复中都有2个或3个数值即重复效应较好,但某些品种分泌的有机酸重复变异较大。溶液培养中在缺磷下,闽紫1号、闽紫6号两种紫云英在草酸分泌方面显著高于弋江籽和余江大叶,但在土培试验中闽紫6号和闽紫1号草酸浓度含量虽高于弋江籽和余江大叶,然而统计分析闽紫6号、闽紫1号、余江大叶和弋江籽草酸含量未达显著差异,可能是由于在土培收集根系分泌物抖土过程中根系一定程度受到损伤,导致根系分泌的有机酸浓度降低(溶液培养在理想条件下,根系损伤少)。前期采用石英砂培养研究结果表明:闽紫6号对难溶性磷的吸收量及生物量均高于浙紫5-12、弋江籽和余江大叶,土培试验表明,闽紫6号的生物量都高于浙紫5-12、弋江籽和余江大叶,然而品种间未见显著差异水平。田间磷高效试验结果表明,闽紫7号在大田栽培适应性方面表现出磷高效特征,土培试验结果也表明闽紫7号有机酸分泌总量最大其生物量也最高,其结果与水培、砂培、土培和田间试验的结果一致。因此,可以得出,不同紫云英基因型根系分泌物有机酸不同,紫云英根系分泌的苹果酸、琥珀酸与生物量拟合呈极显著正相关,紫云英根系分泌的苹果酸和琥珀酸含量高低可以一定程度上表征紫云英生物量高低。
[1]Jones D L.Organic acids in the rhizosphere-a critical review[J].Plant and Soil,1998,205:25-44.
[2]Shen A L,Li X,Kanamori T,etal.Low-molecular-weight organic acids in two Japanese soils incubated with plant residues under different moisture conditions:I.Aliphatic acids[J].Pedosphere,1997,7(1):79-86.
[3]Strobel B W.Influence of vegetation on low-molecular-weight carboxylic acids in soil solution-A review[J].Geoderma,2001,99:169-198.
[4]严小龙.根系生物学原理与应用[M].北京:科学出版社,2007:115-142.
[5]Gardner W K,Parbery D G,Barber D A.The acquisition of phosphorus byLupinusalbusL.I.Some characteristics of the soil/root interface[J].Plant and Soil,1982,68(1):19-32.
[6]Gardner W K,Parbery D G,Barber D A.The acquisition of phosphorus byLupinusalbusL.II.The effect of varying phosphorus supply and soil type on some characteristics of the soil/root interface[J].Plant and Soil,1982,68(1):33-41.
[7]Gardner W K,Barber D A,Parbery D G.The acquisition of phosphorus byLupinusalbusL.III.The probable mechanism by which phosphorus movement in the soil/root interface is enhanced[J].Plant and Soil,1983,70(1):107-124.
[8]谷俊涛,李金才,韩胜芳,等.异源表达白羽扇豆酸性磷酸酶基因对白三叶草磷吸收的影响[J].草业学报,2007,16(4):69-75.
[9]Ae N,Arihara J,Okada K,etal.Phosphorus uptake by pigeon pea and its role in cropping systems of the Indian subcontinent[J].Science,1990,248(49-54):477-480.
[10]Subbarao G V,Ae N,Otani T.Genetic variation in acquisition and utilization of phosphorus from iron-bound phosphorus in pigeon pea[J].Soil Science and Plant Nutrition,1997,43(3):511-519.
[11]Gahoonia T S,Asmar F,Giese H,etal.Root-released organic acids and phosphorus uptake of two barley cultivars in laboratory and field experiments[J].European Journal of Agronomy,2000,12(3/4):281-289.
[12]Shen H,Yan X L,Zhao M,etal.Exudation of organic acids in common bean as related to mobilization of aluminum-and iron-bound phosphates[J].Environmental and Experimental Botany,2002,48(1):1-9.
[13]赵明,沈宏,严小龙.不同菜豆基因型根系对难溶性磷的活化吸收[J].植物营养与肥料学报,2002,8(4):435-440.
[14]Johnson S E,Loeppert R H.Role of organic acids in phosphate mobilization from iron oside[J].Soil Science Society of A-merica Journal,2006,70:222-234.
[15]Onthong J,Osaki M,Nilnood C,etal.Phosphorus status of some highly weathered soils in peninsulr Thailand and availability in relation to citrate and oxalate application[J].Soil Science and Plant Nutrition,1999,45:627-637.
[16]师尚礼,曹致中,刘建荣.苜蓿根瘤菌溶磷和分泌植物生长素能力研究[J].草业学报,2007,16(2):105-111.
[17]兰忠明,林新坚,张伟光,等.缺磷对紫云英根系分泌物产生及对难溶性磷活化的影响[J].中国农业科学,2012,45(8):1521-11531.
[18]兰忠明,张辉,吴一群,等.不同紫云英基因型对难溶性磷吸收利用的影响[J].生态环境学报,2011,20(10):1454-1460.
