龟裂碱土对不同基因型甜高粱幼苗生长和生理特性的影响
2014-01-02刘吉利吴娜
刘吉利,吴娜
(1.宁夏大学新技术应用研究开发中心,宁夏 银川750021;2.宁夏大学农学院,宁夏 银川750021)
土壤盐渍化是影响农业生产的主要因素之一[1-2]。当前,全球不同类型盐渍土面积约为10亿hm2,其中碱土和碱化土壤约占60%[3]。龟裂碱土,俗称白僵土[4],是一种具有不良理化性质的碱化土壤,其矿物组成以伊利和高岭为主,质地粘重,土壤湿时吸水膨胀,泥泞不易透水,干时收缩板结,土壤肥力很低,其他营养元素的含量也偏低[5-6]。宁夏银川平原是我国龟裂碱土的主要分布区之一,该区域虽然土壤理化性状不良,但地势平坦,土层深厚,毗邻黄河,开发利用潜力巨大[7]。
能源作物甜高粱(Sorghumbicolor)属于C4植物,具有高能、高光效、高生物产量和高含糖量等特点,同时具有较强的抗旱、耐瘠、耐盐碱特性,可在盐碱干旱等边际土地上种植[8-9],是适于龟裂碱土种植的侯选作物之一。充分利用宁夏银川平原盐渍化边际性土地种植甜高粱,发展生物质能源,符合我国“不与粮争地、不与人争粮”大力发展非粮生物质能源的政策导向,对于提高边际土壤的利用效率、缓解能源紧张、发展农村区域经济等都具有重要意义[10-11]。
植物耐盐性是一个复杂的反应过程,涉及组织器官结构、生理生化反应等多方面的因素。盐碱胁迫条件下,植物生长发育受到抑制,在内部结构和外部形态上将发生一系列的改变[12]。植物为了适应盐碱环境、抵抗盐碱胁迫也产生了一系列适应机制,主要包括质膜透性改变、渗透调节、增加保护酶系统活性等途径来抵御盐碱胁迫[13-15]。目前关于甜高粱盐碱胁迫的研究较少,并且相关研究主要集中在NaCl胁迫方面[2,10,16]。但目前甜高粱对碱化土壤盐碱胁迫的响应以及不同品种间的差异研究较少[17],尤其是甜高粱对典型龟裂碱土的适应性研究鲜有报道。为此,研究了龟裂碱土对5个不同基因型甜高粱幼苗生长和光合速率、保护酶活性等生理指标的影响,旨在探明甜高粱幼苗对龟裂碱土胁迫的生理响应机制,为宁夏银川平原龟裂碱土的开发利用和耐盐碱甜高粱育种与栽培提供理论依据。
1 材料与方法
1.1 试验材料
试验于2012年5-8月在宁夏大学温室内进行。试验材料采用醇甜2号(CT-2)、ZNH05、ZNH07、ZNH12、ZNH18等5个不同基因型的甜高粱,均为杂交种。供试材料由中国农业大学非粮生物质原料研发中心提供。
1.2 试验设计
5个不同基因型的甜高粱分别设置龟裂碱土胁迫和对照(无盐碱胁迫)2个处理,随机区组试验设计,重复3次。采用盆栽试验,花盆直径为15cm,高度为25cm,每个花盆装入1.0kg土壤,每盆播种甜高粱6粒,待出苗后每盆定苗3株,每重复6盆。对照和龟裂碱土胁迫处理所用土壤分别采自宁夏大学西大滩盐碱地改良试验站耕地和典型龟裂碱土0~30cm土层,土壤理化性状见表1。
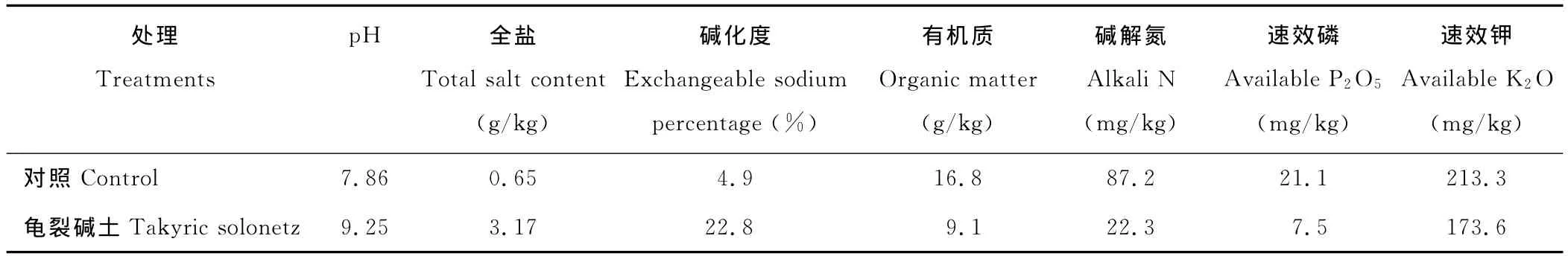
表1 供试土壤的主要理化性状Table 1 Main soil properties of the study site in the top 0-30cm
1.3 测定指标与方法
各处理于定苗后15d,进行株高、根长、植株干重等幼苗生长指标测定。同时,采集植株最新展开的叶片进行叶绿素含量、净光合速率、保护性酶活性(SOD、POD、CAT)、质膜透性以及丙二醛含量等生理指标测定。
叶绿素含量用80%丙酮浸提法测定[18],净光合速率采用便携式光合作用测定系统(Li-6400USA)在1200 μmol/(m2·s)的光强下测定,SOD活性采用氮蓝四唑(NBT)法测定,POD活性采用愈创木酚法测定,CAT活性采用紫外吸收法测定,叶片质膜透性用电导率法测定,丙二醛含量用硫代巴比妥酸(TBA)法测定[19]。
1.4 数据处理与统计分析方法
试验数据的处理和相关分析用Microsoft Excel 2003和SAS软件完成。采用SAS 8.2软件进行方差分析,其他分析使用Microsoft Excel 2003软件完成。
2 结果与分析
2.1 龟裂碱土对不同基因型甜高粱幼苗生长的影响
龟裂碱土对不同基因型甜高粱幼苗的生长有较大影响,龟裂碱土胁迫处理显著降低了甜高粱幼苗株高、根长和植株干重,且各指标在不同品种间均存在着较大的差异。龟裂碱土胁迫条件下,各品种甜高粱幼苗株高、根长和植株干重的降幅分别为12.0%~35.1%、11.9%~30.0%和21.4%~37.5%(表2)。品种ZNH07和ZNH18各指标降幅均较小,品种ZNH05降幅较大,这说明ZNH07和ZNH18在龟裂碱土胁迫条件幼苗生长受抑制较小,表现出较强的耐盐碱性;ZNH05幼苗生长受抑制程度最大,其抗盐碱性最差。
2.2 龟裂碱土对不同基因型甜高粱叶片叶绿素含量的影响
叶片叶绿素含量与光合作用密切相关,是植物抗逆性研究中的一个重要指标。由图1可以看出,龟裂碱土胁迫显著降低了甜高粱叶片的叶绿素含量,不同品种叶绿素含量降低幅度不同,降幅范围为14.7%~33.9%,其中ZNH07和ZNH12降幅较小,ZNH18和CT-2居中,ZNH05降幅最大。胁迫条件下,品种ZNH07和ZNH18的叶绿素含量显著高于其他品种,表现出较强的耐盐碱性。
2.3 龟裂碱土对不同基因型甜高粱叶片净光合速率的影响
光合作用是对逆境胁迫最为敏感的生理过程之一,光合速率在一定程度上反映光合作用的水平。由图2可知,与对照相比,龟裂碱土胁迫处理甜高粱叶片光合速率大幅度降低,降幅为26.9%~47.6%,品种间差异显著。其中品种ZNH07和ZNH18净光合速率降幅较小,ZNH05和CT-2降幅较大,这与叶绿素含量的变化规律基本一致。胁迫条件下,甜高粱品种间净光合速率差异显著,ZNH07和ZNH18仍能保持较高的光合速率,说明其叶片生理活性受盐碱胁迫影响较轻。
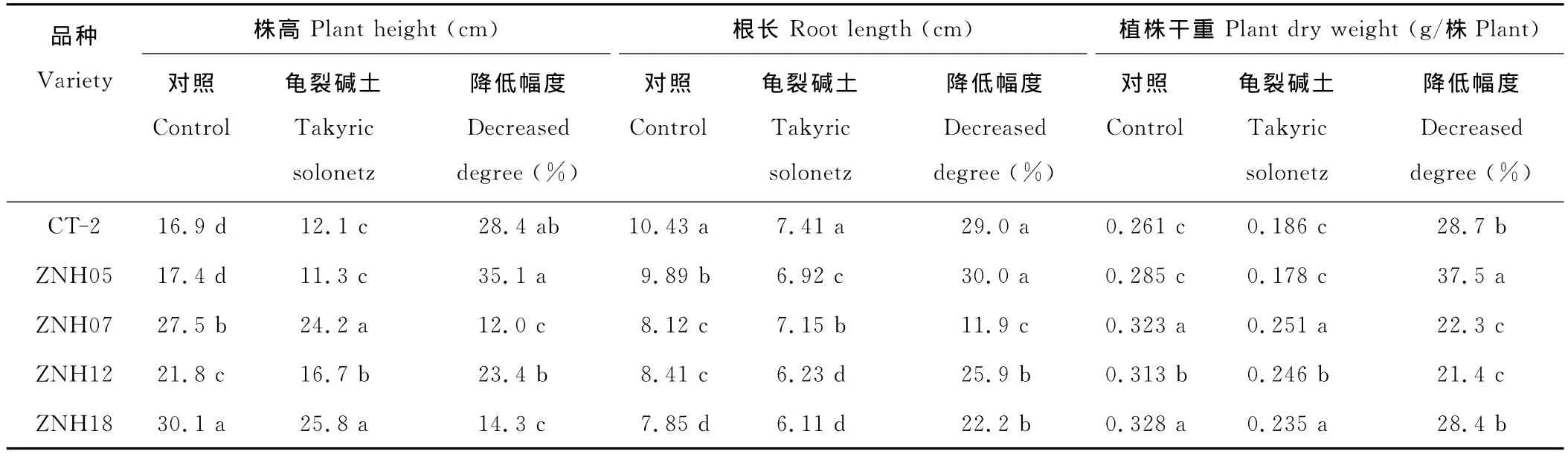
表2 龟裂碱土对不同基因型甜高粱幼苗生长的影响Table 2 Effects of takyric solonetz on seedling growth of different sweet sorghum genotypes

图1 龟裂碱土对不同基因型甜高粱叶绿素含量的影响Fig.1 Effects of takyric solonetz on chlorophyll content of different sweet sorghum genotypes

图2 龟裂碱土对不同基因型甜高粱净光合速率的影响Fig.2 Effects of takyric solonetz on net photosynthetic rate of different sweet sorghum genotypes
2.4 龟裂碱土对不同基因型甜高粱叶片保护性酶活性的影响
如表3所示,龟裂碱土对不同基因型甜高粱叶片保护性酶活性有较大影响,龟裂碱土胁迫处理显著增加了甜高粱叶片中SOD、POD、CAT 等保护性酶活性,增幅分别为25.9%~44.3%、19.4%~51.4%和22.4%~40.3%。龟裂碱土胁迫处理条件下,3种酶活性在不同甜高粱品种间均存在着较大的差异。与对照相比,品种ZNH07和ZNH18三种酶活性均大幅度增加,且保持较高的保护性酶活性;品种ZNH05三种酶活性增幅均较小,且3种酶活性均显著低于ZNH07和ZNH18。这说明ZNH07和ZNH18在龟裂碱土胁迫条件能够保持较高的保护性酶活性,表现出较强的耐盐碱性。
2.5 龟裂碱土对不同基因型甜高粱叶片质膜相对透性和丙二醛含量的影响
逆境胁迫会使植物细胞质膜受到不同程度的损伤,其往往表现为细胞膜透性增大,丙二醛含量增加。图3和图4表明,龟裂碱土胁迫增加了甜高粱幼苗叶片质膜相对透性和丙二醛含量,且品种间存在明显差异。龟裂碱土胁迫处理条件下5个品种甜高粱叶片质膜相对透性比对照增加2.2~3.8倍,丙二醛含量增幅为75.4%~187.3%。品种ZNH05的质膜相对透性和丙二醛含量及其增幅均最高,其次为CT-2和ZNH12,ZNH07和ZNH18最低。这说明盐碱胁迫条件下ZNH05质膜受损伤最严重,其抗盐碱性较弱;ZNH07和ZNH18细胞膜受损较轻,其抗盐碱性较强。

表3 龟裂碱土对不同基因型甜高粱叶片保护性酶活性的影响Table 3 Effects of takyric solonetz on protective enzyme activities of different sweet sorghum genotypes
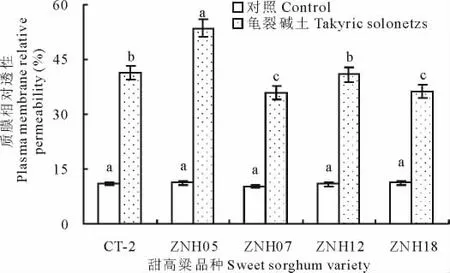
图3 龟裂碱土对不同基因型甜高粱质膜相对透性的影响Fig.3 Effects of takyric solonetz on plasma membrane relative permeability of different sweet sorghum genotypes
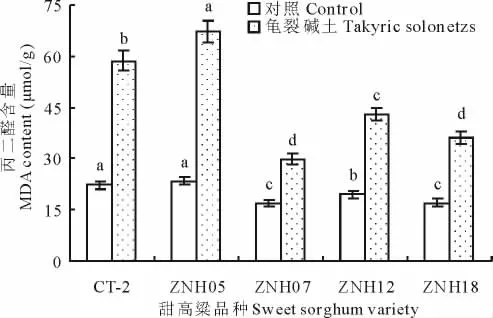
图4 龟裂碱土对不同基因型甜高粱丙二醛含量的影响Fig.4 Effects of takyric solonetz on MDA content of different sweet sorghum genotypes
3 讨论
植物对盐碱胁迫最为敏感的过程是其生长受到抑制[20],而生长量是植物对盐胁迫响应的综合体现及对盐胁迫的综合适应,是评估胁迫程度和植物抗盐能力的可靠指标[21]。较高盐胁迫下所有植物生长都会受到抑制,其耐盐程度因不同植物及同一植物不同品种而存在很大差异[22]。本研究表明,龟裂碱土显著抑制了不同基因型甜高粱幼苗的生长,株高、根长和植株干重等指标均有不同程度降低,品种间差异明显,这与前人研究结论一致[17,23-24]。品种ZNH07和ZNH18在龟裂碱土胁迫条件幼苗生长受抑制较小,表现出较强的耐盐碱性;ZNH05幼苗生长受抑制程度最大,其抗盐碱性最差。
光合作用是作物物质生产和产量形成的重要因素,它与叶绿素含量密切相关[25]。光合作用也是植物对逆境胁迫最为敏感的生理过程,盐碱胁迫使6个甜高粱品种的叶绿素含量均降低,抑制了光合作用和植物的生长[17]。本研究亦得出类似结果,龟裂碱土胁迫处理显著降低了甜高粱叶片的叶绿素含量和光合速率。这可能是由于盐碱胁迫破坏了叶绿体结构,造成叶片光合器官损伤、叶肉细胞的光合活性下降,最终导致光合速率下降[26]。胁迫条件下,ZNH07和ZNH18叶绿素含量和光合速率降幅较小,仍能保持较高的叶绿素含量和光合速率,说明其叶片光合器官生理活性受盐碱胁迫影响较轻,表现出较强的耐盐碱性,这与单株生物量的变化结果相吻合。
植物在逆境胁迫下会发生膜脂过氧化作用造成细胞膜损伤,其往往表现为MDA含量增加和细胞膜透性增大[27]。同时,植物在逆境条件下可通过提高SOD、POD、CAT等保护酶活性,清除活性氧自由基,从而防止其对生物膜结构和功能的破坏,保持一定的耐盐碱性[28]。许多研究已经证明,MDA含量与植物抗逆能力呈负相关,保护性酶活性与植物抗逆能力呈正相关[29-30]。本研究表明,龟裂碱土胁迫条件下,各甜高粱品种生物膜均受到不同程度损伤,质膜相对透性和MDA含量均显著升高;同时,叶片中SOD、POD、CAT等保护性酶活性亦显著升高,表现出不同的耐盐碱能力。品种ZNH05叶片中3种保护性酶活性增幅较小,丙二醛含量和质膜透性增幅最高,其抗盐碱性较弱;品种ZNH07和ZNH18叶片中3种保护性酶活性增幅较大,且丙二醛含量增幅最低,其抗盐碱性较强。
盐碱胁迫能对植物造成多方面的伤害,影响植物光合作用及体内相关代谢反应[31],从而抑制植物生长[1];同时植物耐盐性也是多种指标的综合体现[32]。本研究中,龟裂碱土胁迫处理造成甜高粱质膜相对透性和丙二醛含量增加,叶绿素含量和光合速率降低,不同程度上抑制了植株生长,但胁迫也诱发体内保护酶系统,提高了SOD、POD、CAT活性,表现出一定的耐盐碱性。综合本研究中形态指标及生理指标情况可发现,耐性强的甜高粱品种ZNH07和ZNH18在胁迫条件下表现出株高、根长、植株干重等形态指标以及叶绿素含量、光合速率等生理指标降低幅度小,SOD、POD、CAT活性增加幅度大,质膜相对透性及丙二醛含量虽增加,但幅度较小。耐盐碱性较差的品种ZNH05则表现出光合作用显著降低,保护性酶活性增幅较小,质膜相对透性及丙二醛含量显著增加,幼苗生长显著受抑。
4 结论
龟裂碱土显著抑制了不同基因型甜高粱幼苗的生长,其株高、根长、植株干重、叶绿素含量和光合速率等指标均有不同程度降低;叶片质膜相对透性、MDA含量以及SOD、POD、CAT等保护性酶活性呈上升趋势。不同甜高粱品种对龟裂碱土胁迫的耐受能力存在较大差异,品种ZNH05耐盐碱能力较差,ZNH07和ZNH18则表现出较强的耐盐碱性,但是其耐盐性综合评价及耐盐机制还有待于进一步研究。
[1]李晓宇,蔺吉祥,李秀军,等.羊草苗期对盐碱胁迫的生长适应及Na+、K+代谢响应[J].草业学报,2013,22(1):201-209.
[2]吕金印,郭涛.水分胁迫对不同品种甜高粱幼苗保护酶活性等生理特性的影响[J].干旱地区农业研究,2010,28(4):89-93.
[3]张体彬,康跃虎,胡伟,等.宁夏银北地区龟裂碱土盐分特征研究[J].土壤,2012,44(6):1001-1008.
[4]殷允相.龟裂碱土的形成、性质及改良途径[J].土壤通报,1985,(5):206-208.
[5]李跃进,乌力更,芦永兴,等.燃煤烟气脱硫副产物改良碱化土壤田间试验研究[J].华北农学报,2004,19(S1):10-15.
[6]Sakai Y,Matsumoto S,Sadakata M.Alkali soil reclamation with flue gas desulfurization gypsum in China and assessment of metal content in corn grains[J].Soil and Sediment Contam,2004,13:65-80.
[7]孙兆军,赵秀海,王静,等.脱硫石膏改良龟裂碱土对枸杞根际土壤理化性质及根系生长的影响[J].林业科学研究,2012,25(1):107-110.
[8]樊帆,韩立朴,刘祖昕,等.氮素对干旱地区甜高粱碳水化合物和理论乙醇产量的影响研究[J].中国农业大学学报,2013,18(4):28-36.
[9]谢光辉,庄会永,危文亮,等.非粮能源植物生产原理和边际地栽培[M].北京:中国农业大学出版社,2011.
[10]王秀玲,程序,谢光辉,等.NaCl胁迫对甜高粱发芽期生理生化特性的影响[J].生态环境学报,2010,19(10):2285-2290.
[11]张春霞,边鸣镝,于慧,等.碳酸钠胁迫对甜高粱种子萌发和幼苗期生理特性的影响[J].吉林农业大学学报,2011,33(2):134-138.
[12]刘新星,罗俊杰.豌豆幼苗在盐胁迫下的生理生态响应[J].草业科学,2010,27(7):88-93.
[13]张丽,张华新,杨升,等.植物耐盐机理的研究进展[J].西南林学院学报,2010,30(3):82-86.
[14]ZHU J K.Plant salt tolerance[J].Trends in Plant Science,2001,6(2):66-71.
[15]Yasar F,Ellialtioglu S,Yildiz K.Effect of salt stress on antioxidant defense systems,lipid peroxidation,and chlorophyll content in green bean[J].Russion Journal of Plant Physiology,2008,55(6):782-786.
[16]吴发远,葛江丽.NaCl胁迫对甜高粱幼苗抗性酶活性的影响[J].中国农学通报,2009,25(6):136-139.
[17]戴凌燕,张立军,阮燕晔,等.盐碱胁迫下不同品种甜高粱幼苗生理特性变化及耐性评价[J].干旱地区农业研究,2012,30(2):77-83.
[18]高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000.
[19]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[20]Munns R.Comparative physiology of salt and water stress[J].Plant,Cell and Environment,2002,25:239-250.
[21]魏秀君,殷云龙,芦治国,等.NaCl胁迫对5种绿化植物幼苗生长和生理指标的影响及耐盐性综合评价[J].植物资源与环境学报,2011,20(2):35-42.
[22]吴成龙,周春霖,尹金来,等.NaCl胁迫对菊芋幼苗生长及其离子吸收运输的影响[J].西北植物学报,2006,26(11):2289-2296.
[23]Claudivan F L,Cambraia J,Oliva M A,etal.Solute accumulation and distribution during shoot and leaf development in two sorghum genotypes under salt stress[J].Environmental and Experimental Botany,2003,49:107-120.
[24]丛靖宇,杨冠宇,张烨,等.不同品种甜高粱幼苗耐受渗透胁迫能力的研究[J].华北农学报,2010,25(4):136-140.
[25]Hao N B,Du W G,Ge Q Y,etal.Progress in the breeding of soybean for high photosynthetic efficiency[J].Acta Botanica Sinica,2002,44(3):253-258.
[26]杨淑萍,危常州,梁永超.盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响[J].中国农业科学,2010,43(8):1585-1593.
[27]杜润峰,郝文芳,王龙飞.达乌里胡枝子抗氧化保护系统及膜脂过氧化对干旱胁迫及复水的动态响应[J].草业学报,2012,21(2):51-61.
[28]匡艺,李廷轩,余海英.氮素对不同氮效率小黑麦基因型叶片保护酶活性和膜脂过氧化的影响[J].草业学报,2011,20(6):93-100.
[29]祈娟,徐柱,王海清,等.旱作条件下披碱草属植物叶的生理生化特征分析[J].草业学报,2009,18(1):39-45.
[30]胡梦芸,张正斌,徐萍.作物几种光合酶与抗旱节水的关系研究进展[J].干旱地区农业研究,2008,26(2):250-256.
[31]刘爱荣,张远兵,钟泽华,等.盐胁迫对彩叶草生长和渗透调节物质积累的影响[J].草业学报,2013,22(2):211-218.
[32]刘晶,才华,刘莹,等.两种紫花苜蓿苗期耐盐生理特性的初步研究及其耐盐性比较[J].草业学报,2013,22(2):250-256.
