黄花草木樨水浸提液中潜在化感物质的分离、鉴定
2014-01-02邬彩霞刘苏娇赵国琦
邬彩霞,刘苏娇,赵国琦
(扬州大学动物科学与技术学院,江苏 扬州225009)
黄花草木樨(Melilotusofficinalis)为豆科草木樨属植物,适应能力强,具有很高的生物量产量和固氮能力,能最大限度地减少水土流失和改良土壤[1-2],也是极好的蜜源和花粉植物[3];黄花草木樨还可以入药,它可以作为抗凝血剂(双香豆素及其衍生物)用于减少手术后血块凝结[3]并用于治疗脂肪团[4]。此外,黄花草木樨还具有很强的化感作用,其水浸提液对多花黑麦草(Loliummultiflorum)、婆婆纳(Veronicapersica)、早熟禾(Poapratensis)等植物的种子萌发和幼苗生长有显著的抑制作用[5],其刈割后的残茬能有效控制当季田间杂草[6],作为绿肥栽培,刈割翻埋后能显著减少田间杂草,如多年生杂草蒲公英(Taraxacumofficinale)和苦菜(Sonchusarvensis),以及一年生杂草地肤(Kochiascoparia),播娘蒿(Descurainiasophia),俄罗斯蓟(Salsolaiberica)和旱雀麦(Bromustectorum)等[7],或者田间施用黄色草木樨干草粉也能显著抑制杂草生长[5],所以,黄花草木樨被认为可以通过间作、翻埋或覆盖等方式作为天然除草剂来控制田间杂草。
化感物质的分离、鉴定和验证是植物化感作用研究的重要组成部分[8]。化感物质被认为是比化学除草剂更安全和对环境友好的生物除草剂,迄今为止,一些化感物质已被分离和研究出来以开发新的天然除草剂[9]。因此,如果能找到草木樨的主效化感物质,或许可以开发成为新型生物除草剂,以减少人类对化学除草剂的依赖。国内外许多学者很早就开始对草木樨属植物的化学成分进行了研究,从中分离出了香豆素、黄酮、酚酸、三萜、皂苷类化合物[10-11],但都是从药理特性方面进行分析研究的。然而,到目前为止,关于黄花草木樨的化感活性物质只有少数报道,Macías等[12-13]分离出一些酚类物质和极性化合物,鉴定为黄花草木樨的潜在化感物质;邬彩霞等[14]发现酚酸类化合物存在于黄花草木樨的水浸提液中,且其含量和水浸提液的化感作用强度相关。但黄花草木樨的主要化感物质,或者作用最强的化感物质仍然未知。本研究借鉴了Takemura等[15]的方法,拟采用有机溶剂萃取、层析、色谱分离、GC-MS等方法将黄花草木樨水浸提液中的主要化感物质进行提取、分离、鉴定,为黄花草木樨化感作用的深入研究提供理论基础。
1 材料与方法
1.1 植物材料与试剂
以黄花草木樨为供体植物,2011年10月25日播种于江苏省扬州大学试验田,2012年4月中旬于花期采集新鲜植株;以多花黑麦草为受体植物;种子均购于北京正道生态科技有限公司。
分析纯:石油醚、乙酸乙酯、正丁醇、丙酮。色谱纯:甲醇、乙腈、丙酮。均购于国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 黄花草木樨水浸提液的制备 取黄花草木樨新鲜植株100g,剪成2cm长,用1000mL蒸馏水4℃浸提72h,获得10%(w/v)的水浸提液。水浸提液经过二重过滤:第一重用定量滤纸过滤;第二重用滤元单位为0.45 μm的滤膜过滤。得到不含微生物的水浸提液,置于4℃冷藏备用。
1.2.2 黄花草木樨水浸提液不同极性有机相萃取 主要化感物质的分离参考Bertin等[16]的方法,并适当加以改进。将制备好的黄花草木樨水浸提液10L用旋转蒸发仪(45℃,-0.1MPa)减压浓缩,浓缩至1L。再用3种极性递增的有机试剂(石油醚、乙酸乙酯、正丁醇)依次萃取浓缩液,每种有机溶剂萃取3次,合并萃取液,除水(无水Na2SO4过夜处理)后浓缩、低温干燥后收集各组分萃取物,称重,并配制水溶液做化感活性的生物检测。
1.2.3 化感物质生物活性的测定 将50粒供体植物多花黑麦草种子用1%的NaClO浸泡30min后,播入铺有石英砂、直径为9cm的培养皿中,加入10mL化感物质处理液,播种3和6d后分别计算种子的发芽率,播种6d后从每个培养皿中随机取10株幼苗,测定其根长和苗长,并测定这10株幼苗的干重。
1.2.4 黄花草木樨水浸提液乙酸乙酯萃取物中主要化感物质的分离和鉴定 对各萃取物进行生物活性的测定后,将活性较强的乙酸乙酯萃取物用硅胶柱(硅胶:300~400目;层析柱:直径30mm,高度450mm,口径24 mm)进行层析分离。采用湿法装柱,将300~400目柱层析硅胶装入层析柱内,并用空气泵压实,排净空气。用薄层层析色谱法以及紫外分析仪不断摸索得到的洗脱剂(乙酸乙酯∶石油醚=2∶3)进行洗脱,经薄层层析结合紫外分析仪分别收集显色的成分,将黄花草木樨水浸提液的乙酸乙酯萃取物分出上层、中层和下层3层混合物,分别用旋转蒸发仪旋干后收集,取部分配制水溶液进行生物检测,部分经气质联用色谱仪确定各混合物中的主要成分。
1.2.5 化感物质检测的仪器条件 气质联用仪(Trace DSQII,美国 Thermo Fisher Scientifc)色谱条件。色谱柱:Stabilwas-DA 30mm×0.25mm×0.32μm石英毛细管柱。起始温度50℃,保持3min,以10℃/min升温至300℃,以20℃/min升温至330℃。进样量1μL。
1.3 数据处理和统计方法
采用SPSS(Ver.16.0)对数据进行单因素方差分析以及差异显著性分析。采用Excel 2003进行作图。
抑制率IR(inhibition rate,%)的计算参考Chung等[17]的方法,计算公式如下:

当IR>0时,表示为抑制作用;当IR<0时,表示为促进作用。IR的绝对值代表作用强度的大小。
2 结果与分析
2.1 黄花草木樨水浸提液乙酸乙酯萃取物对多花黑麦草幼苗生长的影响

图1 乙酸乙酯各层提取物对多花黑麦草种子萌发和幼苗生长的抑制率Fig.1 Inhibition rate of Italian ryegrass seed germination and seedling growth treated by ethyl acetate extract
如图1,黄花草木樨水浸提液浓缩分离后的乙酸乙酯相及其分层后的3层混合物对多花黑麦草种子萌发和幼苗生长均具有一定的化感作用,其中,乙酸乙酯相及其上层混合物处理与对照相比均显著抑制了多花黑麦草种子萌发和幼苗生长的各项指标(P<0.05)。乙酸乙酯相处理的抑制作用均为最强,对3d发芽率、6d发芽率、幼苗根长、茎长和苗干重的抑制率分别为83.02%,20.14%,91.06%,40.22%,67.50%,且显著高于其分离得到的上、中、下层3层混合物的处理(P<0.05);上层混合物处理对多花黑麦草的抑制率次之,对3d发芽率、6d发芽率、幼苗根长、茎长和苗干重分别为45.99%,6.25%,81.89%,14.88%和49.16%;中层混合物处理则只对多花黑麦草种子3d发芽率和幼苗根长具有显著的抑制作用(P<0.05);下层混合物处理对多花黑麦草的种子萌发和幼苗生长则表现出明显的促进作用,对多花黑麦草种子3d发芽率、根长、茎长、干重的抑制率均为负值,分别为-11.11%,-2.74%,-9.27%和-0.83%,且与其他处理之间差异显著(P<0.05)。
2.2 黄花草木樨水浸提液乙酸乙酯提取相中化感物质的检测
2.2.1 乙酸乙酯相潜在化感物质的检测 采用气质联用色谱仪(GC-MS)分析乙酸乙酯相中潜在的化感物质,结果发现检测到约25种物质,其中的12种相对含量较高,具体鉴定见表1。其中,相对含量最高的物质出峰时间在14.51min,经鉴定为香豆素,其相对含量远高于其他物质(图2)。
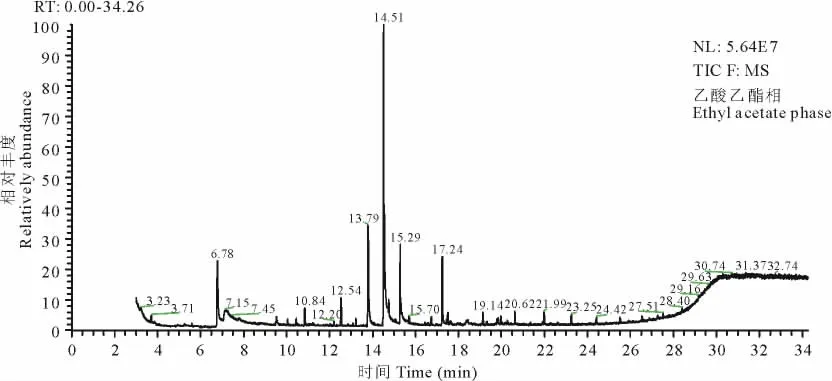
图2 乙酸乙酯相的GC-MS图Fig.2 GC-MS chromatogram of ethyl acetate phase
2.2.2 乙酸乙酯上层潜在化感物质的检测 采用气质联用色谱仪(GC-MS)分析乙酸乙酯上层中潜在的化感物质,检测到23种物质,其中的5种相对含量较高,具体鉴定结果见表2,其中主要物质的峰出现在14.55min,经鉴定为香豆素,其相对含量远高于上层其他物质(图3)。
2.2.3 乙酸乙酯中层潜在化感物质的检测 采用气质联用色谱仪(GC-MS)分析乙酸乙酯中层中潜在的化感物质,结果检测到25中化学物质,其中的12种相对含量较高(图4),具体鉴定结果见表3,其中几种主要物质鉴定分别为二溴三甲基环丙烷、6-(3-Hydroxy-but-1-enyl)-1,5,5-trimethy-7-oxabicyclo[4,1,0]heptan-2-ol、2,6-二叔丁基对甲酚、甲基环戊醇等。

表1 乙酸乙酯相中的主要化学成分Table 1 The main chemical composition of ethyl acetate phase

图3 乙酸乙酯相分离出的上层物质的GC-MS图Fig.3 GC-MS chromatogram of upper layer stratified from ethyl acetate phase

表2 乙酸乙酯相分离出的上层的主要化学成分Table 2 The main chemical composition of upper layer stratified from ethyl acetate phase

图4 乙酸乙酯相分离出的中层物质的GC-MS图Fig.4 GC-MS chromatogram of middle layer stratified from ethyl acetate phase

表3 乙酸乙酯相分离出的中层中主要化学成分Table 3 The main chemical composition of the middle layer stratified from ethyl acetate phase
2.2.4 乙酸乙酯下层潜在化感物质的检测 采用气质联用色谱仪(GC-MS)分析乙酸乙酯下层中潜在的化感物质,结果检测到25种化学物质,发现其中的11种物质相对含量较高(图5),具体鉴定见表4。其中几种主要物质鉴定分别为二溴三甲基环丙烷、甲基环戊醇、环己基溴化膦等。
3 讨论
本研究提取、分离、鉴定了黄花草木樨水浸提液中潜在的化感物质。很多关于化感物质的提取、分离、鉴定的研究中[18-19],都采用有机溶剂直接浸泡植物体来提取更多的化感物质,此类方法尽管可以尽可能的提高植株中化感物质的提取量,但可能出现的情况是提取到的物质并不是植物在自然条件下能释放到周围环境中并表现出化感活性的物质,即不能称之为化感物质。在自然条件下,活体植物是通过根系分泌、茎叶淋溶、挥发及残株腐解等形式向环境释放某些化学物质,所以,采用水浸提植物体中的化感物质,提取到的活性物质更能真实反映植物体的化感物质组成[20]。因此,本文采用了水浸提液为分析黄花草木樨化感物质的基础条件。
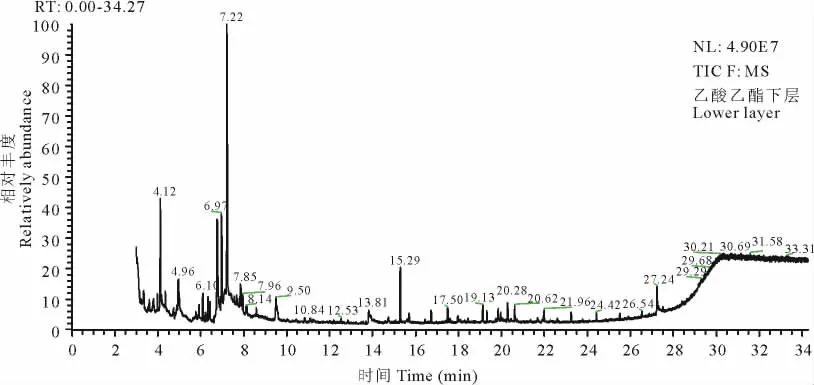
图5 乙酸乙酯相分离出的下层物质的GC-MS图Fig.5 GC-MS chromatogram of lower layer stratified from ethyl acetate phase

表4 乙酸乙酯相分离出的下层的主要化学成分Table 4 The main chemical composition of lower layer stratified from ethyl acetate phase
化感物质的分离纯化大多采用的是色谱分离法,其原理是利用不同物质在固定相和流动相这两相中不同的平衡分配和吸附系数进行分离纯化[21]。色谱分离法的种类很多,在化感活性物质的分离纯化过程中主要应用的是:用于初步分离的柱色谱分离法、用于检测的薄层色谱法(TLC)和用来纯化的制备色谱仪(制备TLC或HPLC)。在化感物质的结构鉴定方面主要依据的是:熔点、红外光谱、紫外光谱、液质联用(LC-MS)、气质联用(GC-MS)[22]、毛细管电泳(CE)和核磁共振谱(NMR)等参数来判断物质中存在的功能团、共轭体系、分子量、分子结构以及H原子和C原子在分子中的结合方式等信息,从而确定化感物质的化学结构,最后再根据测定出的结构用已知的标准品数据对照,最终确定这种物质[8]。本文即采用了层析柱和薄层色谱分析法,分离了黄花草木樨水浸提液乙酸乙酯萃取相中的潜在化感物质,并采用GC-MS技术检测、鉴定了其中相对含量较高的主要成分。结果发现,乙酸乙酯相中含有的物质种类非常复杂,这些物质主要属于8类化合物,分别为香豆素类(香豆素和3,4-二氢香豆素)、醇类[1-甲基环戊醇,3-甲基环戊醇,6-(3-Hydroxy-but-1-enyl)-1,5,5-trimethyl-7-oxabicyclo[4,1,0]heptan-2-ol,叔丁基过氧化氢]、酯类(磷酸三甲酯)、烷烃类(反式-3,4-环氧辛烷,2-溴-1,1,3-三甲基环丙烷和正十一烷)、酮类(二氢苯并吡喃酮)、苯酚类(2,6-二叔丁基-4-甲基苯酚)、酰胺类(芥酸酰胺,油酸酰胺)和磷化氢类(环己基膦二溴化物)。其中含量最高的物质为香豆素,其次为6-(3-Hydroxy-but-1-enyl)-1,5,5-trimethyl-7-oxabicyclo[4,1,0]heptan-2-ol、二氢苯并吡喃酮、2,6-二叔丁基对甲酚、二溴三甲基环丙烷、磷酸三甲酯等物质;将乙酸乙酯相进一步分离后,得到3层混合物:上层、中层、下层,经过GC-MS检测发现上层混合物中相对含量较高的主要为香豆素,中层混合物中含量相对较高的有二溴三甲基环丙烷、6-(3-Hydroxy-but-1-enyl)-1,5,5-trimethy-7-oxabicyclo[4,1,0]heptan-2-ol、2,6-二叔丁基对甲酚、甲基环戊醇等物质;下层混合物中含量相对较高的有二溴三甲基环丙烷、甲基环戊醇、环己基溴化膦等物质。由于乙酸乙酯相中的化学成分非常复杂,在本文中只鉴定了那些相对含量较高的物质,而乙酸乙酯相分离后3层混合物的检测到的一些相对含量较高的成分,在未分离纯化前,即在乙酸乙酯相中的含量非常微小,所以,在乙酸乙酯相的成分分析中没有标出这些物质,也是结果中(表1~表4)乙酸乙酯相分离前后分析出的主要成分有差异的原因。但是,总体来看,乙酸乙酯相分离前和分离后,相对含量较高的物质是一致的。
检测出的物质中,香豆素为已报道的具有较强化感活性的化感物质[23-24],香豆素不仅可以抑制其他植物生长[23],还具有杀虫[25]、抗菌[26]等生物活性,被认为是非常有应用前景的化感物质[24]。也有研究[27-29]发现2,6-二叔丁基对甲酚为一些植物的化感物质,但在生物检测中,其化感活性并不是很强。检测出的其他物质多数均为新发现的化感物质。本研究结果表明,香豆素在整个乙酸乙酯相以及乙酸乙酯上层提取物中的相对含量均远高于其他物质(图2,图3);生物检测结果(图1)显示,乙酸乙酯相处理对多花黑麦草种子萌发和幼苗生长的化感抑制作用最强,其处理的多花黑麦草种子萌发和幼苗生长的各项指标抑制率均显著高于相同浓度的乙酸乙酯上层、中层和下层提取物处理;而上层混合物处理对多花黑麦草种子萌发和幼苗生长的抑制作用又明显高于中层和下层提取液。由以上结果或许可以推测,香豆素为乙酸乙酯提取液中主要的化感物质之一,其在黄花草木樨的化感抑草作用中可能扮演重要角色。Takemura等[15]将强化感植物墨西哥丁香(Gliricidiasepium)的浸提液进行分离、鉴定时也发现,香豆素含量最高的组分对生菜(Lactucasativa)的化感抑制作用最强,且经过分析浸提液中香豆素的含量及其对综合化感效应的贡献,发现香豆素为其浸提液化感作用中发挥关键作用的物质,即为其主效化感物质。此外,6-(3-Hydroxy-but-1-enyl)-1,5,5-trimethyl-7-oxabicyclo[4,1,0]heptan-2-ol、二氢苯并吡喃酮等新发现的化感物质在乙酸乙酯相和乙酸乙酯中层混合物中的含量也相对较高,而乙酸乙酯中层混合物处理的多花黑麦草种子萌发或幼苗生长也受到显著的抑制作用,因此,这几种物质也可能具有较高的化感抑草潜力,在下一步的研究中,将用这几种物质的化学纯品进行生物检测验证,以进一步明确黄花草木樨的主效化感物质。
乙酸乙酯相对多花黑麦草的抑制作用显著高于分离出来的每一层物质,这一结果还说明乙酸乙酯相中的化感物质之间存在一定的协同效应。植物水浸提液提取物所表现出来的化感活性往往不是单一物质在发挥作用,而是几个或几类化合物综合作用的结果,所以化感效应的强弱不仅取决于化学物质的种类和浓度,更取决于不同化感物质之间的拮抗和协同作用。
4 结论
黄花草木樨水浸提液的乙酸乙酯相是化感抑制活性较高的组分,其中含有的物质种类非常复杂,其中相对含量最高的物质为香豆素,还包括二氢苯并吡喃酮、2,6-二叔丁基对甲酚6-(3-Hydroxy-but-1-enyl)-1,5,5-trimethyl-7-oxabicyclo[4,1,0]heptan-2-ol等相对含量较高的化合物;将乙酸乙酯相进一步分离得到的3层混合物,上层混合物的化感活性最强,且其中相对含量最高的物质仍然为香豆素,推测香豆素可能是黄花草木樨水浸提液中主要的化感物质。
[1]Schlegel A J,Havlin J L.Green fallow for the central Great Plains[J].Agronomy Journal,1997,89(5):762-767.
[2]Sparrow S D,Cochran V L,Sparrow E B.Herbage yield and nitrogen accumulation by seven legume crops on acid and neutral soils in a subarctic environment[J].Canadian Journal of Plant Science,1993,73(4):1037-1045.
[3]Smith W,Gorz H.Sweetclover improvement[J].Advances in Agronomy,1965,17:163-231.
[4]Nicotra M,Meli R,Savoca F.Efficacy ofMelilotusofficinalis(L.)pallas in cellulitis treatment[J].Bollettino Accademia Gioenia Scienze Naturali,2009,42:20-28.
[5]Wu C X,Guo X X,Li Z H,etal.Feasibility of using the allelopathic potential of yellow sweet clover for weed control[J].Allelopathy Journal,2010,25(1):173-183.
[6]Moyer J,Blackshaw R,Huang H.Effect of sweetclover cultivars and management practices on following weed infestations and wheat yield[J].Canadian Journal of Plant Science,2007,87(4):973-983.
[7]Blackshaw R E,Moyer J R,Doram R C,etal.Yellow sweetclover,green manure,and its residues effectively suppress weeds during fallow[J].Weed Science,2001,49(3):406-413.
[8]Sampietro D A,Catalan C A,Vattuone M A.Isolation,Identification and Characterization of Allelochemicals/Natural Products[M].Boca Raton:Science Publishers,2009.
[9]Kelton J,Price A J,Mosjidis J.Allelopathic weed suppression through the use of cover crops[J].Weed Control,2012,2:978-953.
[10]Stoker J,Bellis D.The isolation and identification of bound coumarin fromMelilotusalbum[J].Canadian Journal of Biochemistry and Physiology,1962,40(12):1763-1768.
[11]Kang S S,Lee Y S,Lee E B.Saponins and flavonoid glycosides from yellow sweetclover[J].Archives of Pharmacal Research,1988,11(3):197-202.
[12]Macías F A,Simonet A M,Galindo J C.Bioactive steroids and triterpenes fromMelilotusmessanensisand their allelopathic potential[J].Journal of Chemical Ecology,1998,23(7):1781-1803.
[13]Macías F A,Simonet A M,Galindo J C,etal.Bioactive phenolics and polar compounds fromMelilotusmessanensis[J].Phytochemistry,1999,50(1):35-46.
[14]邬彩霞,李志华,沈益新.豆科牧草水浸提液的酚酸物质含量及化感潜力[J].草地学报,2007,15(5):401-406.
[15]Takemura T,Kamo T,Sakuno E,etal.Discovery of coumarin as the predominant allelochemical inGliricidiasepium[J].Journal of Tropical Forest Science,2013,25(2):268-272.
[16]Bertin C,Paul R N,Duke S O,etal.Laboratory assessment of the allelopathic effects of fine leaf fescues[J].Journal of Chemical Ecology,2003,29(8):1919-1937.
[17]Chung I M,Kim K H,Ahn J K,etal.Comparison of allelopathic potential of rice leaves,straw,and hull extracts on barnyardgrass[J].Agronomy Journal,2003,95(4):1063-1070.
[18]Kato-Noguchi H,Yamamoto M,Tamura K,etal.Isolation and identification of potent allelopathic substances in rattail fescue[J].Plant Growth Regulation,2010,60(2):127-131.
[19]Bich T,Ohno O,Suenaga K,etal.Isolation and identification of an allelopathic substance from duckweed(LemnaminorL.)[J].Allelopathy Journal,2013,32(2):213-221.
[20]Salam A,Kato-Noguchi H.Isolation and characterisation of two potent growth inhibitory substances from aqueous extract ofBangladeshiricecultivar BR17[J].Allelopathy Journal,2011,27(2):207-216.
[21]杨国庆.紫茎泽兰淋溶主效化感物质的分离鉴定及其对旱稻幼苗的作用机理[D].北京:中国农业科学院,2006.
[22]Eljarrat E,BarcelóD.Sample handling and analysis of allelochemical compounds in plants[J].TrAC Trends in Analytical Chemistry,2001,20(10):584-590.
[23]El-Shahawy T A,Abdelhamid M T.Potential allelopathic effect of six phaseolus vulgaris recombinant inbred lines for weed control[J].Australian Journal of Basic&Applied Sciences,2013,7(1):462-467.
[24]Razavi S M.Plant coumarins as allelopathic agents[J].International Journal of Biological Chemistry,2011,5:86-90.
[25]Sharma R,Negi D S,Shiu W K,etal.Characterization of an insecticidal coumarin fromBoenninghauseniaalbiflora[J].Phytotherapy Research,2006,20(7):607-609.
[26]Brooker N,Kuzimichev Y,Laas J,etal.Evaluation of coumarin derivatives as anti-fungal agents against soil-borne fungal pathogens[J].Communications in Agricultural and Applied Biological Sciences,2006,72(4):785-793.
[27]Ascari J,Takahashi J A,Boaventura M A D.Phytochemical and biological investigations ofCaryocarbrasilienseCamb[J].Boletín Latinoamericanoy del Caribe de Plantas Medicinalesy Aromáticas,2010,9(1):20-28.
[28]Hong Y,Hu H,Sakoda A,etal.Straw preservation effects ofArundodonaxL.on its allelopathic activity to toxic and bloom-formingMicrocystisaeruginosa[J].Water Science & Technology,2011,63(8):1566-1573.
[29]Qiao M,Xiao J,Yin H,etal.Analysis of the phenolic compounds in root exudates produced by a subalpine coniferous species as responses to experimental warming and nitrogen fertilisation[J].Chemistry and Ecology,2014,30(6):1-11.
