马缨杜鹃不同完整性居群遗传多样性的AFLP分析
2014-01-02李佳蔓周安佩胡世俊何承忠
纵 丹 ,员 涛 ,李佳蔓 ,周安佩 ,胡世俊 ,何承忠 ,,
(西南林业大学 a. 西南山地森林资源保护与利用省部共建教育部重点实验室; b. 西南地区生物多样性保育国家林业局重点实验室, 云南 昆明 650224)
马缨杜鹃不同完整性居群遗传多样性的AFLP分析
纵 丹a,员 涛a,李佳蔓a,周安佩a,胡世俊b,何承忠a,b,
(西南林业大学 a. 西南山地森林资源保护与利用省部共建教育部重点实验室; b. 西南地区生物多样性保育国家林业局重点实验室, 云南 昆明 650224)
采用选择性扩增片段多态性(AFLP)技术对马缨杜鹃5个不同完整性居群的遗传多样性进行检测和分析。结果表明:筛选出的7对引物组合共扩增出527条带,其中多态带382条,多态带百分率为72.49%;5个居群间的多态性百分率在52.23%~69.64%之间,居群平均多态性百分率为57.80%;Nei’s基因多样性变化范围在0.113 9~0.173 8之间,Shannon信息指数为0.186 8~0.277 7;居群间遗传分化系数Gst为0.168 8,表明83.12%遗传变异发生在居群内,居群间基因流为2.462 4,足以维持居群间现有的遗传结构;AMOVA分析结果表明,18.34%的遗传变异存在于居群间,81.66%的遗传变异存在于居群内;基于UPGMA聚类结果,可将5个马缨杜鹃居群分为3组,紫溪山和板凳山居群、马雄山和小营地居群之间各为一组,老湾地居群独自一组。研究表明,该物种有些居群虽遭受严重的人为破坏,但居群的遗传多样性仍然较高。
马缨杜鹃;居群;AFLP标记;遗传多样性
马缨杜鹃Rhododendron delavayiFranch又名马缨花,是杜鹃花科常绿杜鹃亚属植物,直立小乔木或灌木,高3~8 m,最高可达到12 m以上,喜酸性土壤[1-2],主要分布于云南、贵州等较高海拔的地区,有耐寒、耐旱、花色鲜艳、花期长等特性,可药用,具有较高的观赏和药用价值[3-4]。目前国外对杜鹃花的宏观和微观研究相对较多,在分子水平主要是对同种不同环境的居群的分析[5]、耐寒基因研究[6]、转基因研究[7]和分子遗传图谱的构建[8]等。国内对杜鹃属植物的研究主要包括两个方面,一是对杜鹃属植物分类学的基础性研究,另一方面是与应用有关的组培育种驯化和生理生化研究[9],如对马缨杜鹃种子的萌发以及播种苗的生长规律[2,10]、马缨杜鹃种子萌发生长的最佳生理条件[4]、不同浸种方式对4个居群的马缨杜鹃种子发芽率影响和组织培养与快速繁殖的研究[11-12]等。
近年来,随着人类活动的加剧,物种赖以生存的生态环境受到严重的破坏,而生境的破坏和片段化又以更微妙的方式影响物种的生存,不仅对生物性和物理性的生态系统造成干扰[13],也严重影响物种的遗传结构[14-15]。因此,生境破坏后的物种群体遗传多样性已成为当前研究的热点。张文标等[16]采用RAPD技术对不同生境夏腊梅的群体遗传多样性进行了分析;胡世俊等[17]分析了生境破碎对缙云卫矛种群遗传多样性的影响。当前,马缨杜鹃被广泛应用于园林绿化之中,但所用苗木基本来自于采挖野生资源,对马缨杜鹃种群结构造成了极大的破坏。而采用分子标记技术开展马缨杜鹃的相关研究报道较少,仅有赵喜华等[18]采用RAPD技术探讨了9种常绿杜鹃亚属和2种马缨花亚属杜鹃的种间亲缘关系及系统位置。
AFLP作为RAPD和RFLP相结合的一种分子标记技术,不仅具有RAPD的随机性和方便性,而且具有RFLP的专一性和可靠性[19]。本研究采用AFLP分子标记技术,对分布于云南境内5个马缨杜鹃不同完整性居群的遗传多样性进行检测,旨在了解这些不同破坏程度的马缨杜鹃自然居群的遗传变异及遗传结构特征,并探讨在当前较严重的生境干扰情况下,该物种的遗传多样性如何变化,为更好地保护其遗传多样性提供科学依据。
1 材料与方法
1.1 试验材料
供试材料分别采集于云南省楚雄市紫溪山、板凳山和曲靖市马雄山、小营地、老湾地5个马缨杜鹃的自然分布居群。每个居群确定5 km×5 km大小的取样范围,按照随机取样的原则,从中心点开始向四个方向每隔250 m采集1份,将采集的叶片用硅胶干燥,带回实验室备用。每居群的样本数及居群生境与结构完整性概况见表1。

表1 马缨杜鹃5个居群样本数及居群概况Table 1 Samples and introduction of 5 populations of R. delavayi
1.2 方 法
1.2.1 基因组DNA提取
将133份样本的叶片磨碎后,使用改良的SDS法依照标准酚/氯仿流程提取总DNA[20]。提取后的总DNA采用0.8%的琼脂糖进行电泳检测,-20℃保存,备用。
1.2.2 AFLP分析
AFLP分析的基本过程参照Vos等[21]的方法进行。采用EcoRⅠ+MesⅠ限制性内切酶组合进行基因组DNA的双酶切,预扩增反应采用EcoRⅠ+00/MesⅠ+00的引物组合,选择性扩增反应采用引物组合EcoRⅠ+3/MesⅠ+3,PCR扩增反应在PTC-100TMThermal PCR仪上进行。
1.2.3 选择性扩增产物的电泳分离
选择性扩增产物加入1/3体积的双指示剂短暂离心后,95 ℃变性5 min,取出后立即放入碎冰中,取样6 μL于已预电泳30 min的6%变性聚丙烯酰胺凝胶上进行电泳分离,其功率恒定为70 W,时间约2 h,电泳产物采用银染法[22]进行条带的显色反应。
1.2.4 数据统计与分析
依据AFLP指纹图谱上同一位点条带的有或无进行统计,选择清晰稳定的条带进行统计,有条带记为“1”,无条带记为“0”,形成0/1矩阵。采用POPGENE version 1.32软件对5个居群共133份马缨杜鹃样本进行相关遗传变异指标的统计与分析,计算多态性标记百分率、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性(H)、Shannon信息指数(I)。采用AMOVA 1.55软件[23]对居群间和居群内的分子变异进行分析。
2 结果与分析
2.1 不同引物组合的AFLP扩增条带多态性分析
采用筛选出的7对电泳条带清晰、重复性好的引物组合对供试样品进行分析,共扩增出527条条带,其中多态性条带382条,多态带百分率为72.49%,有效标记的长度范围为75~520 bp(见表2)。每对引物组合产生的总带数为43~102条,多态性条带29~78条,平均每对引物扩增总条带数和多态性条带分别为75.29条和54.57条。在7对选择性扩增引物组合中,多态性带数最多的是78条,出现在引物组合E32-M40的扩增结果中,最少的是由引物组合E58-M64扩增得到的29条。由此可知,5个居群的133份马缨杜鹃样本之间存在着一定的遗传差异。

表2 7对AFLP选择性引物组合扩增结果Table 2 Amplified results of AFLP makers by 7 selective primer combinations
2.2 不同居群马缨杜鹃遗传多样性指标分析
对马缨杜鹃的遗传多样性分析(见表3)表明,不同居群所扩增的多态性条带在270~367条之间,多态性位点百分率相差不大,其中小营地居群多态位点百分率最高,为69.64%,说明小营地居群的马缨杜鹃具有较高的遗传多样性。而最低的是紫溪山居群,占52.23%,其次为马雄山居群(52.37%)、老湾地居群(56.55%)和板凳山居群(59.20%)。
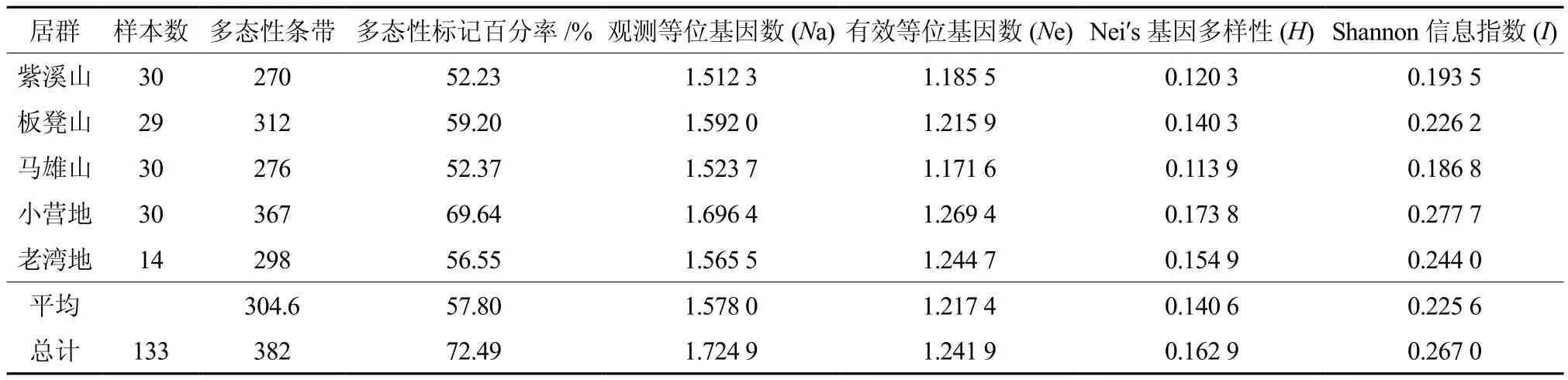
表3 马缨杜鹃5个居群遗传多样性指数Table 3 Genetic diversity indexes of 5 populations of R. delavayi
在居群水平上,Nei’s基因多样性变化范围在0.113 9~0.173 8之间,总体为0.162 9。其中小营地居群在观测等位基因数(1.696 4)、有效等位基因数(1.269 4)、Nei’s基因多样性(0.173 8)和Shannon信息指数(0.277 7)均表现出最高,而马雄山居群的多态性百分率(52.37%)和观测等位基因数(1.523 7)虽略高于紫溪山居群(52.23%和1.512 3),但其Nei’s基因多样性和Shannon信息指数(0.113 9和0.186 8)都要低于紫溪山居群(0.120 3和0.193 5)。5个居群的Shannon信息指数与Nei’s基因多样性变化趋势基本保持一致,也进一步表明来自不同地区的5个马缨杜鹃居群间存在一定的遗传差异。5个居群之间的基因流为2.462 4(>1),总基因多样性为0.169 2,居群内的基因多样性为0.140 7,居群间基因分化系数为0.168 8,表明马缨杜鹃总遗传变异的16.88%来自于居群间,而83.12%来自于居群内,即居群间的遗传分化较居群内小。
2.3 遗传差异的分子方差分析
AMOVA分析结果表明,5个居群间的遗传变异分量为11.302 8,占总变异的18.34%;而居群内的遗传变异分量为50.340 7,占总变异的81.66%,居群间的差异不显著(P=0.183)(见表4),说明马缨杜鹃的遗传变异主要存在于居群内不同个体之间,这与POPGEN分析结果相一致。
2.4 聚类分析
依据POPGENE的分析结果(见表5),5个居群之间的遗传距离变化范围在0.079 0~0.011 0之间,平均为0.042 5。紫溪山居群和老湾地居群之间的遗传距离最大,为0.079 0,表明紫溪山居群和老湾地居群之间具有较大的遗传差异,紫溪山居群和板凳山居群遗传距离最小(0.011 0)。基于5个居群之间的遗传距离,采用非加权算术平均法(UPGMA)进行聚类分析,并构建了聚类分析树状图(见图1)。当遗传距离为0.01时,可将5个居群划分为3类,第1类包括紫溪山和板凳山2个居群,马雄山和小营地居群组成第2类,老湾地居群单独聚为第3类。聚类结果与马缨杜鹃居群的地理分布位置基本一致。
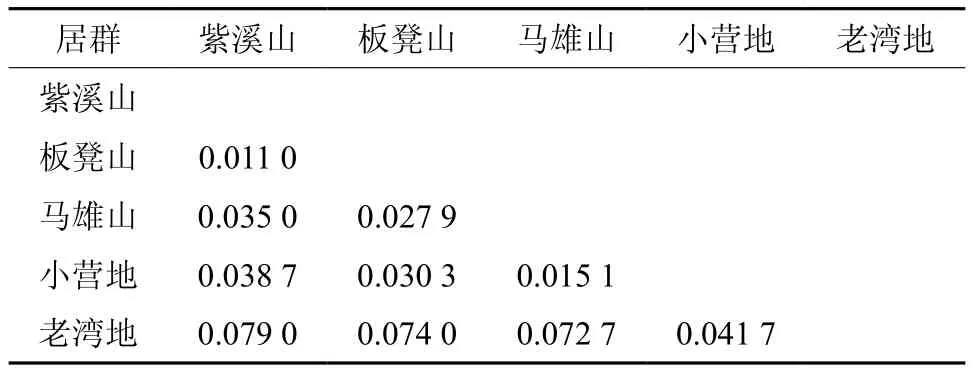
表5 马缨杜鹃5个居群间的遗传距离Table 5 Genetic distance of 5 populations of R. delavayi

图1 马缨杜鹃5个居群的UPGMA聚类Fig. 1 Dendrogram of 5 populations of Rhododendron delavayi
3 结论与讨论
遗传多样性是生物在长期进化过程中形成的一种自然属性,而这种属性不仅体现为物种居群间和居群内的差异,而且也体现在不同的个体之间,它是物种的种群和个体遗传变异的总和[24]。就植物而言,影响其遗传多样性高低的因素有很多,包括物种的交配形式、基因流、种群的数量和大小、人为干扰等[25],但在植物遗传多样性形成过程中,也有可能只有一种因素起主导作用[26-27]。
Hamrick和Godt[27]通过对449种植物的653例等位酶遗传变异进行研究,在综合分析的8个主要生态和生活史等特性中,认为在居群水平上,交配系统对植物遗传多样性和遗传结构影响最大,它控制基因由配子体在两个世代间的传递与延续。从某种意义上说,在其它条件基本一致的情况下,植物居群具有什么样的遗传结构将取决于自交和异交所占的比重[28],在自交种的遗传变异中,平均有51%存在于居群之间(遗传分化系数为0.510),而混交、动物传播或异交的植物类群,其遗传变异主要在居群内,其遗传分化系数分别为0.216和0.197[26]。杨佳等[29]通过对已知交配形式以自交为主的裸芸香居群进行研究,其结果中的遗传分化系数为0.509 6。马丽娟等[30]在对以异交为主的野生杏遗传多样性的研究结果中表明,遗传分化系数为0.172 0。这些研究结果均与Hamrick和Godt的结论一致。在同属异种的其它杜鹃遗传多样性研究中,赵芯等[31]用ISSR标记对浙江省大明山4个麂角杜鹃种群的遗传多样性研究结果显示,其多态位点百分率为88.07%,遗传变异主要存在于居群内。金则新等[32]采用ISSR技术对5个云锦杜鹃居群的研究结果表明,多态性位点百分率为88.24%,其中40.03%变异存在于居群间,59.97%存在于居群内。本研究结果表明,马缨杜鹃具有较高的遗传多样性(多态性百分率为72.49%,总基因多样性为0.169 2),其遗传分化系数为0.168 8,与异交植物类群遗传分化系数(0.197)接近。马缨杜鹃花色艳丽,能够吸引大量的传粉昆虫,异交可能在马缨杜鹃交配系统中占有相当比例。而居群间遗传变异仅占总变异的18.34%,居群内遗传变异占总变异的81.66%,说明马缨杜鹃的遗传变异主要存在于居群内不同个体之间。该结果与杜鹃属麂角杜鹃、云锦杜鹃的遗传结构相同。因此,在马缨杜鹃种质资源收集及保存时,可以减少采样居群的数量,但在居群内的取样数量要适当增加。
基因的相互交流使得居群内的遗传变异升高,减少了居群间的遗传分化,这种表现在居群间和居群内的遗传物质交流称为基因流[33]。Slatkin[34]和Hamrick等[27]认为,若基因流>1,基因流足以抵制遗传漂变作用,防止居群分化发生,维持居群现有的遗传结构;若基因流<1,就意味着居群间基因流不足以防止居群间的遗传分化。本研究的结果显示马缨杜鹃居群间的基因流为2.462 4,表明马缨杜鹃居群间的基因流足以维持其现有的遗传结构,而异交植物的基因流明显大于自交植物[27],这也进一步说明了马缨杜鹃的交配形式主要为异交。
随着人类活动的增加,人为干扰对遗传多样性造成严重的影响,而生境破坏和片段化对生物多样性尤其是遗传多样性的影响更为突出[35]。生境破碎化会增加居群间遗传分化,降低居群内遗传变异,并且影响居群长期及短期的生存力[18]。王峥峰等[36]通过对南亚热带厚壳桂的研究结果表明:森林的破碎化使种群遗传多样性降低,种群间基因流受阻。胡世俊等[18]对生境破碎的缙云卫矛研究结果显示:生境破碎不利于其居群间的基因流,导致小居群遗传多样性的丧失。王峥峰等[37]认为人为干扰使得种群个体数量减少,小种群具有较少的遗传变异,导致种群遗传多样性丧失,引起近交衰退,并影响到种群后代的适应性。此外,人为干扰等外部因素并不会直接影响等位基因的数目与频率,而是通过交配形式、基因流等内部因素间接来改变[27,38-40]。本研究中,小营地居群和老湾地居群的完整性均低于紫溪山居群和马雄山居群,但这2个居群的遗传多样性指标均高于紫溪山居群和马雄山居群,这表明小营地居群和老湾地居群虽然受人为干扰最为严重,居群的完整性较差,但这些外部因素均未能有效地影响其遗传多样性。可能的原因是该居群受干扰的历史较短,或居群属于大种群,在发展历史上就保持了较高遗传多样性,因此,短期的干扰并不会立即导致遗传多样性的明显下降。
通过对马缨杜鹃不同完整性居群遗传多样性的研究发现,马缨杜鹃遗传多样性主要存在于居群内不同个体之间。虽然一些受干扰较严重的居群的遗传多样性目前依然较高,但人类若不停止生境破坏、采挖、砍伐、放牧等行为,一些较大的种群也会急剧减小,加剧遗传多样性的丧失,进一步导致近交、繁殖障碍,降低马缨杜鹃种群的适应能力。因此要对受干扰较严重的马缨杜鹃种群加以就地保护,防止生境的进一步破坏,维持种群的数量,才能长期的保存这一具有重要观赏价值的物种。
[1] 徐小榕, 张习敏, 牛晓娟, 等. 赤霉素+2,4-D及赤霉素+丁酰肼对马缨杜鹃光合作用日变化的影响[J]. 中南林业科技大学学报, 2011, 31(11): 131-136.
[2] 段 旭, 陈 训, 赵洋毅. 马缨杜鹃播种苗的生长规律研究 [J]. 种子, 2007, 26(10): 82-84.
[3] 洪 怡, 文晓鹏. 马缨杜鹃离体快繁体系的建立与优化[J]. 西南大学学报, 2012, 34(8): 61-66.
[4] 李国树, 徐成东, 李天星, 等. 不同处理方法对马缨杜鹃种子萌发和生长的影响[J]. 中国园艺文摘, 2011, (1): 30-31.
[5] Wolf P G, Doche B, Gieiiy L,et al.Genetic structure of Rhododendron ferrugineum at a wide range of spatial scales [J].Journal of Heredity, 2004, 95(4): 30l-308.
[6] Marian C O, Krebs S L, Arora R. Dehydrin variability among Rhododendron specie: a 25-kDa dehydrin is conserved and associated with cold acclimation across diverse species[J]. New Phytologist, 2004, 161(3): 773-780.
[7] Pavingerova D, Briza J, Kodytek K,et al. Transformation ofRhododendronspp. Using Agrobacterium tumefaciens with a GUS – intron chimeric gene[J]. Plant Science, l997, l22: l65-l7l.
[8] Dunemann F, Kahnau R, Stange I. Analysis of complex leaf and flower characters inRhododendronusing a molecular linkage map [J]. Theoretical and Applied Genetics, l999, 98: 1146-1155.
[9] 梅济发, 秦建明, 陆万明. 分子标记技术在我国杜鹃属植物中的应用[J]. 湖北林业科技, 2011, 2: 37-39.
[10] 段 旭, 陈 训, 赵洋毅. 马缨杜鹃种子萌发研究[J]. 安徽农业科学, 2007, 35(29): 9199-9200.
[11] 程雪梅, 何承忠, 周 敏, 等. 不同浸种方式对马缨杜鹃种子发芽率的影响[J]. 北方园艺, 2008, 10: 106-109.
[12] 程雪梅, 赵明旭, 何承忠, 等. 马缨杜鹃的组织培养与快速繁殖[J]. 植物生理学通讯, 2008, 44(2): 297-298.
[13] Fahrig L. Effects of habitat fragmentation on biodiversity[J].Annual Review of Ecology, Evolution and Systematics, 2003,34: 487-515.
[14] Young A G, Boyle T, Brown T. The population genetic consequences of habitat fragmentation for plants[J]. Trends in Ecology and Evolution, 1996, 11(10): 413-418.
[15] Templeton A R, Shaw K, Routman E,et al.The genetic consequence of habitat fragmentation[J]. Annals of the Missouri Botanical Garden, 1990, 77(1): 13-27.
[16] 张文标, 金则新, 李钧敏. 不同生境夏腊梅群体遗传多样性的RAPD分析[J]. 植物研究, 2007, 27(3): 313-318.
[17] 胡世俊, 闫晓慧, 何 平, 等. 生境破碎对缙云卫矛种群遗传多样性的影响[J]. 重庆师范大学学报, 2013, 30(2): 26-29.
[18] 赵喜华, 张乐华, 王曼莹. 11种杜鹃花RAPD分类学初步研究[J]. 江西农业大学学报, 2006, 28(4): 544-547.
[19] 李 珊, 赵桂仿. AFLP分子标记及其应用[J]. 西北植物学报,2003, 23(5): 830-836.
[20] Murray M, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research, 1980, 8(19):4321-4326.
[21] Vos P, Hogers R, Bleeker M,et al. AFLP: a new technique for DNA fingerprinting[J]. Nucleic acids research, 1995, 23(21):4407-4414.
[22] Tixier M H, Sourdille R M, Leroy P,et al. Detection of wheat microsatellites using a non radioactive silver-nitrate staining method[J]. Journal of Genetic Breeding, 1997, 51(2): 175-177.
[23] Excoff i er L. Analysis of Molecular Variance (AMOVA ) Version 1. 55[M ]. Geneva: Genetics and Biometry Laboratory, 1993.
[24] 钱迎倩, 马克平. 生物多样性研究的原理与方法[M]. 北京:中国科学技术出版社, 1994.
[25] 文亚峰, 韩文军, 吴 顺. 植物遗传多样性及其影响因素[J].中南林业科技大学学报, 2010, 30(12): 80-86.
[26] Hamriek J L, Godt M J W. Allozyme diversity in plant species.[C]//Brown A D H,Clegg M T,Kahler A L. Plant population genetics, breeding and genetic resources. Sinauer: Sunderland,1990: 43-63.
[27] Hamriek J L,Godt M J W. Effects of life history traits on genetic diversity in plant species[J]. Philosophical Transactions of London Biological Sciences, 1996, 351: 1291-1298.
[28] 葛 颂. 同工酶和植物进化生物学研究[C]//陈家宽, 杨 继.植物进化生物学. 武汉: 武汉大学出版社, 1994: 153-208.
[29] 杨 佳, 李晓东, 李新伟, 等. 华中特有珍稀植物裸芸香的AFLP遗传多样性分析[J]. 武汉植物学研究, 2007, 25(3): 226-234.
[30] 马丽娟, 郭太君, 何丹丹, 等. 中国东北部野生杏资源ISSR遗传多样性[J]. 东北林业大学学报, 2013, 41(12): 13-20.
[31] 赵 芯, 金则新, 李建辉, 等. 麂角杜鹃遗传多样性的ISSR分析[J]. 江苏农业科学, 2010, (3): 34-36.
[32] 金则新, 李钧敏, 顾奇萍. 云锦杜鹃自然居群遗传多样性的ISSR分析[J]. 园艺学报, 2006, 33(6): 1263-1267.
[33] Grant V. The evolutionary process: A critical study of evolutionary theory[M]. New York: Columbia University Press,1991.
[34] Slatkin M. Isolation by distance in equilibrium and nonequilibrium populations[J]. Evolution, 1993, 47: 264-279.
[35] 文陇英. 生境片段化对遗传多样性的影响[J]. 科学·经济· 社会, 2006, 24(1): 70-72.
[36] 王峥峰, 高山红, 田胜尼, 等. 南亚热带森林片段化对厚壳桂种群遗传多样性遗传结构的影响[J]. 生物多样性, 2005,13(4): 324-331.
[37] 王峥峰, 彭少麟, 任 海. 小种群的遗传变异和近交衰退[J].植物遗传资源学报, 2005, 6(1): 101-107.
[38] 丁晓纲,张应中,陈清凤,等.广宁红花油茶果实性状的遗传变异规律[J].经济林研究,2012,30(2):23-27.
[39] 王弦云,朱晓敏,王 勤,等.杜仲ISSR-PCR反应体系的建立与引物筛选及其在遗传多样性研究中的应用[J].经济林研究,2013,31(1):30-34.
[40] 宋 丹,乌云塔娜,包文泉,等.内蒙古野生山杏优良单株果实性状的遗传变异分析[J].经济林研究,2013,31(3):1-9.
Analysis on genetic diversity of different integrity population ofRhododendron delavayiby AFLP markers
ZONG Dana, YUN Taoa, LI Jia-mana, ZHOU An-peia, HU Shi-junb, HE Cheng-zhonga,b
(a. Key Lab. for Forest Resources Conservation and Use in Southwest Mountains of China co-constructed by State Education Ministry and Yunan Province; b. Key Lab. of Biodiversity Conservation in Southwest China Supported by State Forestry Administration,Southwest Forestry University, Kunming 650224, Yunnan, China)
The genetic diversity of fi ve different integrity populations ofRhododendron delavayiwere investigated and analyzed by using the technology of amplif i ed fragment length polymorphism (AFLP). Seven pairs of AFLP primer combinations were selected and from these 527 AFLP fragments were obtained, of which 382 fragments were polymorphic, accounting for 72.49%. The percentage of polymorphic of 5 populations varied from 52.23% to 69.64%, and the average percentage of polymorphic fragments was 57.80%.Nei’s gene diversity varied from 0.113 9 to 0.173 8, and Shannon information index varied from 0.186 8 to 0.277 7. In addition, the gene differentiation coeff i cient (Gst) was 0.186 8, which showed that 83.12% genetic diversities existed within the populations. Nm was 2.462 4, which indicated that the gene fl ow was enough to maintain the current genetic structure. Analysis of molecular variance(AMOVA) implied that the genetic variation among populations was 18.34%, while 81.66% of the genetic variation existed within populations. The five populations could be divided into three groups based on the results of UPGMA. Zixishan and Bandengshan populations, Maxiongshan, and Xiaoyingdi population each became a group, while Laowandi population was alone as a group. The fi ndings showed that although some populations were disturbed by human being but also held higher genetic diversity.
Rhododendron delavayi; population; AFLP markers; genetic diversity
S759.95
A
1673-923X(2014)09-0117-06
2013-12-10
国家林业公益性行业专项基金项目(201104076);云南省中青年学术与技术带头人后备人才培养基金项目(2012HB021)
纵 丹(1988- ),女,安徽宿州人,硕士研究生,主要从事林木遗传育种研究
何承忠(1970- ),男,甘肃民勤人,教授,博士生导师,主要从事林木遗传育种与分子生物学研究;
E-mail: hcz70@163.com
[本文编校:谢荣秀]
