两种培养小鼠神经母细胞瘤N2a细胞方法的比较*
2014-01-01熊南翔沈建英
童 松, 熊南翔△, 沈建英
1华中科技大学同济医学院附属协和医院神经外科,武汉430022
2华中科技大学同济医学院基础医学院解剖学系组织胚胎学教研室,武汉430030
N2a细胞(Neuro-2acells)是小鼠神经嵴源性细胞,目前已经被大量用于研究神经细胞的分化、轴突生长及信号通路。该细胞经过血清剥夺或者其他的方法可在短时间内改变信号通路分子的表达从而使细胞分化、轴突生长[1]。目前有关N2a细胞的培养主要有2种方法:一种是用DMEM+10%FBS的培养液培养;另一种是用 DMEM/Opti-MEM(1∶1)+5%FBS的培养液培养[2-4]。我们采用2种不同的方法培养N2a细胞,观察该细胞在增殖、分化、粘附、迁移、自发凋亡方面的差异,旨在寻求最适合培养N2a细胞的方法。
1 材料与方法
1.1 材料与试剂
N2a细胞(由华中科技大学同济医学院病理生理学系王建枝教授赠送)、高糖DMEM培养液(Dulbecco’s modified Eagle’s medium,美国 Hyclone公司)、Opti-MEM 减血清培养液(Opti-MEM Reduced-Serum Medium,美国Gibco公司)、胎牛血清(FBS,美国 Gibco公司)、噻唑蓝(MTT,美国Amresco公司)、基质胶(Matrigel,美国BD公司)、AnnexinⅤ-FITC/PI试剂盒(上海贝博公司)。
1.2 N2a细胞的分组与培养
取冻存的N2a细胞,经复苏后分为2组,第1组细胞用DMEM+10%FBS培养并传代;第2组细胞用DMEM/Opti-MEM(1∶1)+5%FBS培养并传代,连续培养2周。
1.3 MTT实验
N2a细胞以1.0×105/mL密度接种于96孔细胞培养板,每孔0.1mL,分别于接种后1、2、3、4、5d进行 MTT检测。每孔加20μL MTT(5mg/mL),混匀,37℃条件下培养4h,小心吸弃上清,每孔加150μL二甲基亚砜(DMSO),振荡10min,充分溶解结晶,紫外分光光度计490nm波长测各孔吸光度值(A值),每孔设4个复孔。
1.4 细胞形态观察及分化细胞计数
细胞接种于6孔板中,在2种培养液中培养24 h后于相差显微镜下观察细胞形态并统计分化细胞数目。应用Image J软件分析细胞分化率[5]。每组至少统计500个细胞,计算分化细胞所占比例,并进行统计学分析。
1.5 细胞粘附实验
96孔培养板中分别加入50μL Matrigel,37℃、5%CO2孵育1h,PBS冲洗2次,1%BSA封闭1h,PBS冲洗2次后加入1.0×105/mL密度的细胞悬液100μL在37℃、5%CO2培养30min。每组有一半孔不用PBS洗,另一半的孔用温热的PBS洗去未粘附的细胞,之后行上文提到的MTT实验,测各孔吸光度值(A值)。粘附率=(粘附细胞A值/全部细胞A值)×100%。
1.6 划痕实验
我们对检测N2a细胞迁移能力的划痕实验进行了部分改进[6]:6孔板底部画好标记线,按1.0×105/mL浓度接种,培养细胞融合率达90%后,用10 μL加样枪头进行划痕损伤,PBS洗3次,镜下拍照损伤区。在37℃、5%CO2条件下分别用DMEM+4%FBS、DMEM/Opti-MEM(1∶1)+2%FBS培养液中培养24h后,镜下拍照,用计算机分析迁移距离。
1.7 AnnexinⅤ-FITC/PI法检测凋亡率
用不含EDTA的胰酶消化细胞后离心,收集细胞,用冷PBS洗涤细胞2次,离心后用400μL AnnexinⅤ结合液悬浮细胞,保持细胞密度为1×106/mL。在悬浮液中加入5μL AnnexinⅤ-FITC染色液,混匀,4℃避光孵育15min,最后加入10mL PI 4℃避光孵育5min,立即用流式细胞仪检测。
1.8 统计学分析
应用SPSS 13.0软件统计分析,两组数据均数的比较采用Student’s t检验进行分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组细胞增殖率的比较
MTT检测结果显示,2种培养液对N2a细胞的增殖作用没有明显的差异(图1)。在1、2、3、4、5 d,DMEM/Opti-MEM(1∶1)+5%FBS组的吸光度值分别为(0.34±0.04)、(0.47±0.05)、(0.78±0.07)、(1.33±0.06)、(1.76±0.05),DMEM+10%FBS的吸光度值分别为(0.35±0.06)、(0.44±0.05)、(0.87±0.07)、(1.45±0.06)、(1.84±0.06)。DMEM +10%FBS组细胞增殖率与DMEM/Opti-MEM(1∶1)+5%FBS组相比,差异无统计学意义(均P>0.05)。

图1 两组细胞增殖能力的比较Fig.1 Comparison of the proliferation of N2acells between the two groups
2.2 两组细胞分化率的比较
接种细胞24h后,DMEM/Opti-MEM(1∶1)+5%FBS组的细胞多数呈圆形,分化细胞所占比例为(5.10±0.95)%;DMEM+10%FBS组中多边形及分化细胞较多,分化细胞所占比例为(10.82±1.95)%(图2),表明 DMEM/Opti-MEM(1∶1)+5%FBS培养液可降低细胞自分化比例。
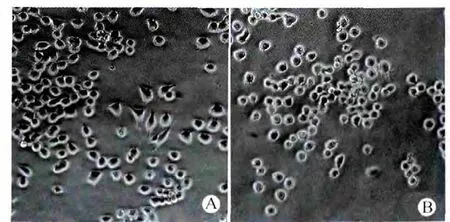
图2 两组细胞分化率的比较(倒置相差显微镜,×200)Fig.2 Comparison of the differentiation rate of N2acells between the two groups(Inverted phase contrast microscope,×200)
2.3 两组细胞粘附能力的比较
DMEM/Opti-MEM(1∶1)+5%FBS组的细胞粘附率为(64.00±4.56)%,DMEM+10%FBS组的细胞粘附率为(74.00±2.64)%,表明 DMEM/Opti-MEM(1∶1)+5%FBS组的细胞粘附能力较DMEM+10%FBS组降低。
2.4 两组细胞迁移能力的比较
在增殖实验中我们得知两组细胞增殖率相同,因此在本实验中我们可以排除增殖对本实验结果的影响。我们将低浓度血清的培养液用于本实验,这与正常血清浓度培养液相比降低了细胞增殖,与无血清培养液相比又抑制了细胞分化。使用低浓度血清培养液培养24h,结果显示DMEM/Opti-MEM(1∶1)+2%FBS组向划痕部位迁移的细胞数(97±14)与DMEM+4%FBS组的细胞数(107±25)差异无统计学意义(图3)。
2.5 两组细胞自发凋亡率的比较
两组细胞用AnnexinⅤ-FITC/PI染色,经流式细胞仪检查发现,DMEM/Opti-MEM(1∶1)+5%FBS组细胞凋亡率为(3.84±0.82)%,DMEM+10%FBS组细胞凋亡率为(3.42±0.61)%,两组凋亡率差异无统计学意义(图4)。

图3 两组细胞迁移能力的比较Fig.3 Comparison of the migration of N2acells between the two groups
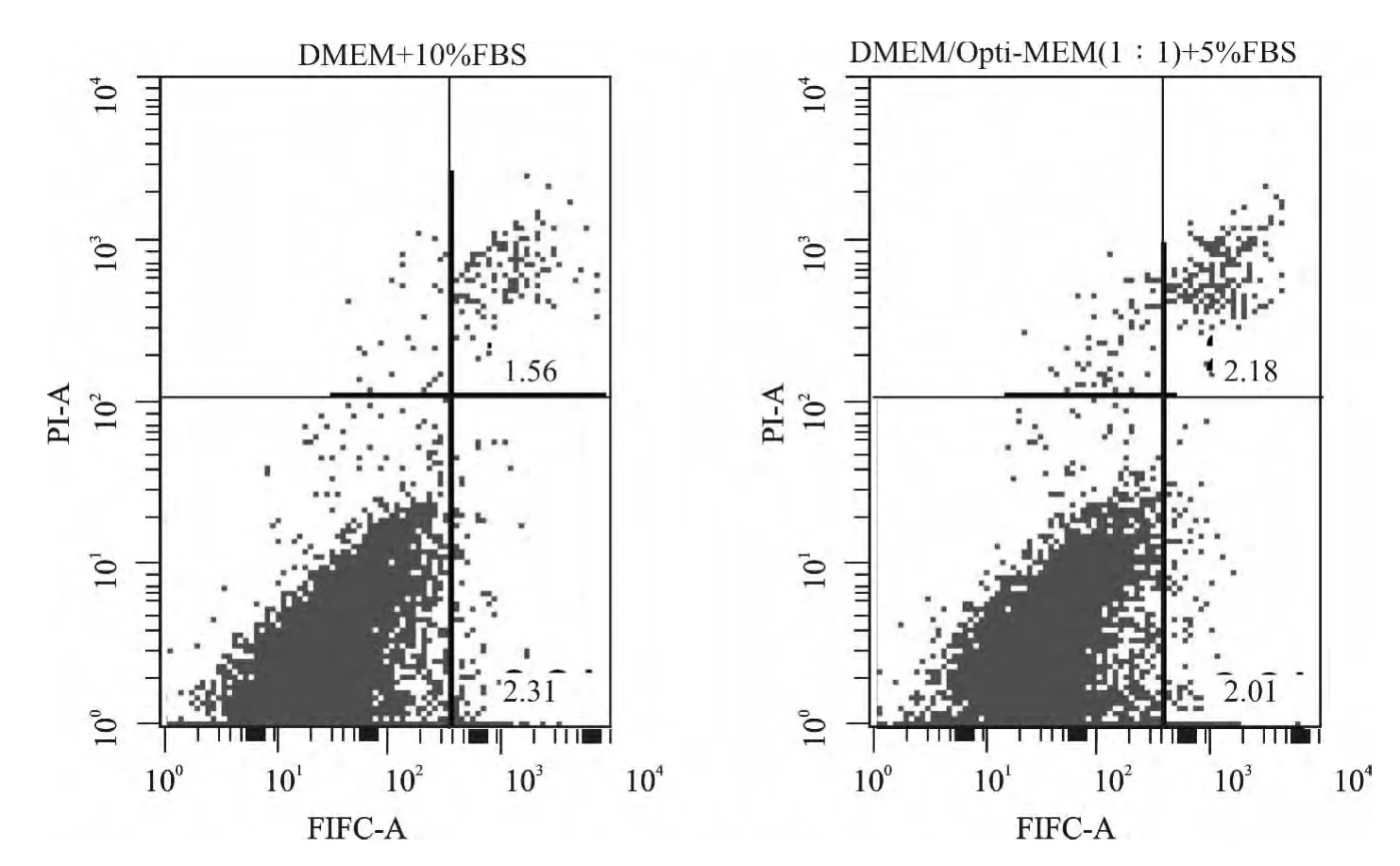
图4 两组细胞自发凋亡率的比较Fig.4 Comparison of spontaneous apoptosis of N2acells between the two groups
3 讨论
N2a细胞由Klebe与Ruddle于1969年通过A株白鼠的自发性肿瘤建立而成[7],该细胞因其转染易感并大量表达微管蛋白等特点,在神经细胞分化,轴突生长及信号通路领域被广泛应用。培养液是细胞体外赖以生长、分化、增殖的重要因素,不同细胞对培养液需求不同,选择相适应的培养液是提高细胞在体外培养成活率及实验成功率的关键因素之一。但是关于N2a细胞培养液的选择方面目前还没有一个统一的标准,最常见的用于N2a的培养液有2种:DMEM+10%FBS与 DMEM/Opti-MEM(1∶1)+5%FBS,这2种培养液在N2a细胞的培养中均被广泛运用,但是关于N2a细胞培养2种培养液的适用条件及各自的优缺点并未见报道。
我们运用这2种不同的培养液来培养N2a细胞,并观察2种不同培养方法下N2a细胞的细胞形态、增殖能力、粘附能力、迁移能力、自发凋亡的差异。结果显示,DMEM/Opti-MEM(1∶1)+5%FBS培养液与DMEM+10%FBS相比,可使N2a细胞保持较低的分化率与粘附力,在增殖、迁移、自发凋亡方面2种培养液对该细胞的作用相似。细胞粘附分子与细胞分化可以相互作用,相互影响[8],我们推测本实验中DMEM/Opti-MEM(1∶1)+5%FBS组N2a细胞粘附力与分化率的下降可能与调节粘附与分化的共同信号通路PI3K/AKT有关;DMEM/Opti-MEM(1∶1)+5%FBS培养液具有较低浓度的血清反而可抑制自分化,其原因可能与Opti-MEM 的 成 分 有 关。Opti-MEM 是 EMEM(Eagle’s minimum essential medium)的改良版,其中使用了4-羟乙基哌嗪乙磺酸(HEPES)和碳酸氢钠进行缓冲,并添加次黄嘌呤、胸苷、丙酮酸钠、L-谷氨酰胺、微量元素和生长因子等,这些营养元素加强了血清对细胞的营养作用,将普通培养液换成Opti-MEM培养细胞,可使培养液中血清的用量减少一半以上。
N2a细胞经过诱导后具有较好的分化能力,未经诱导的N2a细胞分化率各家报道不一,多在4%~14%之间[2,9]。造成这种差异原因可能与细胞培养液及培养方式不同有关。我们发现,DMEM/Opti-MEM(1∶1)+5%FBS培养液组因其具有较低的分化率,与DMEM+10%FBS相比,它更适合用于诱导N2a分化的实验中,因为该实验往往要求空白对照组的细胞保持较低的分化率。在用N2a细胞研究神经分化及细胞粘附的实验中,建议首选DMEM/Opti-MEM(1∶1)+5%FBS培养液进行细胞体外培养。在其他关于N2a实验中培养液的选择有待我们进一步去探索与研究。
[1] Saragoni L,Hernandez P,Maccioni R B.Differential association of tau with subsets of microtubules containing posttranslationally-modified tubulin variants in neuroblastoma cells[J].Neurochem Res,2000,25(1):59-70.
[2] Roffe M,Hajj G N,Azevedo H F,et al.IMPACT is a developmentally regulated protein in neurons that opposes the eukaryotic initiation factor 2alpha kinase GCN2in the modulation of neurite outgrowth[J].J Biol Chem,2013,288(15):10860-10869.
[3] Quinta H R,Galigniana M D.The neuroregenerative mechanism mediated by the HSP90-binding immunophilin FKBP52 resembles the early steps of neuronal differentiation[J].Br J Pharmacol,2012,166(2):637-649.
[4] 王海红,曲忠森,张迎春,等.DVL-1cDNA重组质粒在N2a细胞中的瞬时表达[J].华中科技大学学报:医学版,2004,33(4):398-401.
[5] Zeng M,Zhou J N.Roles of autophagy and mTOR signaling in neuronal differentiation of mouse neuroblastoma cells[J].Cell Signal,2008,20(4):659-665.
[6] Sheng B,Song B,Zheng Z,et al.Abnormal cleavage of APP impairs its functions in cell adhesion and migration[J].Neurosci Lett,2009,450(3):327-331.
[7] Klebe R J,Ruddle F H.Neuroblastoma:Cell culture analysis of a differentiating stem cell system[J].J Cell Biol,1969,43:69A
[8] Arimura N,Kaibuchi K.Neuronal polarity:from extracellular signals to intracellular mechanisms[J].Nat Rev Neurosci,2007,8(3):194-205.
[9] Jeon W B,Park B H,Choi S K,et al.Functional enhancement of neuronal cell behaviors and differentiation by elastin-mimetic recombinant protein presenting Arg-Gly-Asp peptides[J].BMC Biotechnol,2012,12:61.
