植物种子休眠与萌发调控机制研究进展
2013-12-27孙吉康费明亮
程 鹏,王 平,孙吉康,费明亮,杨 辉
(中南林业科技大学 生命科学与技术学院, 湖南 长沙 410004)
植物种子休眠与萌发调控机制研究进展
程 鹏,王 平,孙吉康,费明亮,杨 辉
(中南林业科技大学 生命科学与技术学院, 湖南 长沙 410004)
种子休眠的现象普遍存在于高等植物中,植物种子的休眠方式也因植物为了适应不同的环境变化而演变得千变万化。重点从生理生化和分子生物学水平上综述了植物种子休眠与萌发调控机理研究领域的最新研究成果,以期为深入开展植物种子休眠与萌发研究及解除休眠与种子人工萌发的生产实践工作指明方向并提供理论依据。
植物种子;休眠;萌发;调控机理;综述
种子休眠是指一个完整的有活力的种子由于休眠而在适宜环境条件下(水、氧气、温度)仍然无法发芽的一种生理现象[1]。这种现象在早期的种子生物学领域研究中显得很难理解[2]。但近10年来,在该领域的研究已有显著进展,有大量的相关文章发表,然而也存在很多争议。在生态学领域研究中,Fenner和Thompson[3]发现种子休眠与种子在土壤中的状态存在复杂关系,这引起对种子休眠原因的争论,如光线是否能解除休眠、诱导发芽等。在生理学领域大部分研究都是采用的分子遗传学的方法,利用模式物种,如拟南芥、茄科植物和谷类开展休眠机制研究,但这些模式植物都属于浅休眠型[4]。此外关于种子的休眠类型,学术界尚没有一个统一明确的定义,且分类方式较为混乱。尽管生态学家和生理学家都基于各自的领域研究种子休眠,但是很显然,这两种不同方式的研究所得到的成果是完全可以互补的。
1 植物种子的休眠与萌发
一个非休眠的种子的基因型能使种子在普通的物理环境下萌发。但在很多情况下种子萌发除了必需水、氧气和适当的温度外,常常会对一些其他因素非常敏感,如:光照、硝酸盐、pH值[5-7]。种子萌发通常可分为三个阶段:首先,干种子快速摄取水分而吸胀;然后,种子胚开始扩张;最后,种子进一步增加水分的吸收,胚轴伸长突破种皮,完成发芽[6]。
植物种子通过调控自身休眠使其发芽时间能避开外界不利因素,休眠的机制也因不同的植物为适应其生长环境而演变得多种多样[8]。因此,各种不同休眠机制随着植物千变万化的生存环境而演变。Baskin J M和Baskin C C[9]对种子休眠给出了一个比较恰当的释义:休眠的种子不能在指定时间内发芽,即使萌发环境中有着所有良好的物理环境因子。给休眠下一个准确的定义也是困难的,因为只有通过观测种子能否发芽才能确定种子是否具有休眠属性,虽然通过观察到单一种子的萌发全过程可以确定种子是休眠态还是非休眠态,然而单一种子实验得到的结果对于判定休眠与非休眠没有任何意义。Fenner和Thompson[3]认为休眠不应该被仅仅定义为是种子不能发芽,相反,休眠决定了种子发芽所需的条件。按这样理解,任何能改变种子发芽所需条件的因素,就称之为休眠因子。推而广之,当种子发芽不需要任何特定环境时,则称其为非休眠态种子。
1.1 植物种子休眠的分类
学术界普遍认同植物种子休眠一般分为初生休眠和次生休眠两种类型。在种子成熟过程中由ABA诱导的休眠称为初生休眠[10]。次生休眠是指种子掉落后由于一些不良环境条件而引发的浅度生理休眠[3]。在初生休眠因外界环境条件的变化而终止,而此环境条件却不能满足种子萌发的条件时,次生休眠将启动。随着季节的变化,次生休眠可能被终止,但马上又会重新启动,直到环境条件能满足种子萌发(如:土壤松动)[11]。总之,休眠是种子的本质属性,它规定了种子萌发所需的环境条件。
Baskin C C与Baskin J M[12]提出了一个全面的种子休眠分类系统,其中包括5个分类:生理休眠(PD)、形态休眠(MD)、形态生理休眠(MPD)、物理休眠(PY)、混合型休眠(PY+PD)。
生理休眠(PD)具最丰富的形式,普遍存在于裸子植物和被子植物的种子中,特别是温带植物。PD的休眠层次较多,包括浅度PD、中度PD和深度PD等。大部分的植物种子属于浅度PD,可以用分离胚培养法得到正常的幼苗;一定浓度的GA处理也能终止这类休眠;对种子进行变温处理也能促使其发芽;有的种子直接划破其种皮休眠就会终止。当然有些植物种子需要用以上的两三个方法结合在一起处理才能打破其休眠。深度的PD种子即使使用胚分离培养也不能发芽或者长出异常幼苗。简单的GA处理不能打破其休眠,在这类型的种子萌发前,可以对其进行低温或高温层积处理从而打破休眠促使种子萌发,如:挪威枫Acer platanoides、大槭树 Acer pseudoplatanus[13]。
形态休眠(MD)是由种子胚的某个部位(如:子叶、胚轴、胚芽等)发育不全所导致,这类种子不属于生理休眠,它只是需要时间来完成种胚的成长和萌发,如:芹菜Apium graveolens[14]。
处于形态生理休眠(MPD)的种子胚也有明显发育不全的现象。但除此之外导致MPD的还有一些生理因素,所以在这类种子萌发前需要对其进行破休眠处理,如:低温层积或者高温层积,有时候GA处理也能终止其休眠,如金莲花Trollius[15]。
物理休眠(PY)是由于种子的种皮、外壳的隔水层栅栏细胞控制了水的吸收,机械或化学破坏其外壳就能打破休眠。如:草本犀Melilotus[16]。
混合型休眠(PY+PD)种子有一层隔水的种皮或外壳,同时还存在生理休眠。如:天竺葵Geranium[17]。
1.2 植物种子休眠与萌发的影响因素
温度能影响植物种子的休眠与萌发,这一点已被广泛认可[5,7,18]。但关于光对种子休眠与萌发的影响存在争议,Batlla等[19]认为光既能刺激种子发芽,也能终止休眠。处于黑暗中的种子接收到光照后能够萌发,而这一步与其说是解休眠的最后一个过程,不如说是种子萌发的第一步,但这个说法在某种情况下可以被推翻,例如:在种子开始萌发前就一直用红外光照射,直到种子发芽[20]。此外,一些植物种子由于其种皮含有萌发抑制物而不能正常萌发(如:醛类、酚类、有机酸、脱落酸、生物碱等)[21]。这类种子只需经过光照和赤霉素(GA)浸泡都能够打破其休眠,实现种子萌发。
一些学者认为只有温度能改变种子的生理休眠(PD)进而终止种子休眠。然而,Krock等[22]证明了诱导混种烟草种子二次休眠的是自然产生的脱落酸(ABA)和另外4种萜烯,这5种物质均来源于其种子覆盖物。此外,外源性硝酸盐也会影响种子发芽所需环境,所以可以说外源性硝酸盐会直接影响休眠,而不仅仅只是促进发芽[23]。
对于PD型种子,有非常多的外界环境因素能改变它的休眠状态。这些因素对种子休眠的影响与其他因素有着一些明显的区别。这些因素都可能是与缓慢变化的季节相关,它们(如:温度)常随着时间的推移而影响种子的休眠深度,或者结合其他敏感因素(如:光)一起影响种子休眠。此外,Cadman等[24]通过研究有关种子休眠状态的基因表达谱分析,证明种子的多重休眠与基因定量及定性的转录表达密切相关。
2 植物种子休眠与萌发的调控机制
植物种子的内源激素和种子萌发环境共同调控种子的休眠及萌发。种子根据外界环境的变化调节种子内GA和ABA的合成与降解以维持休眠或者促进萌发。本文综合近年相关研究成果,总结了植物种子休眠与萌发的调控机制(见图1)。
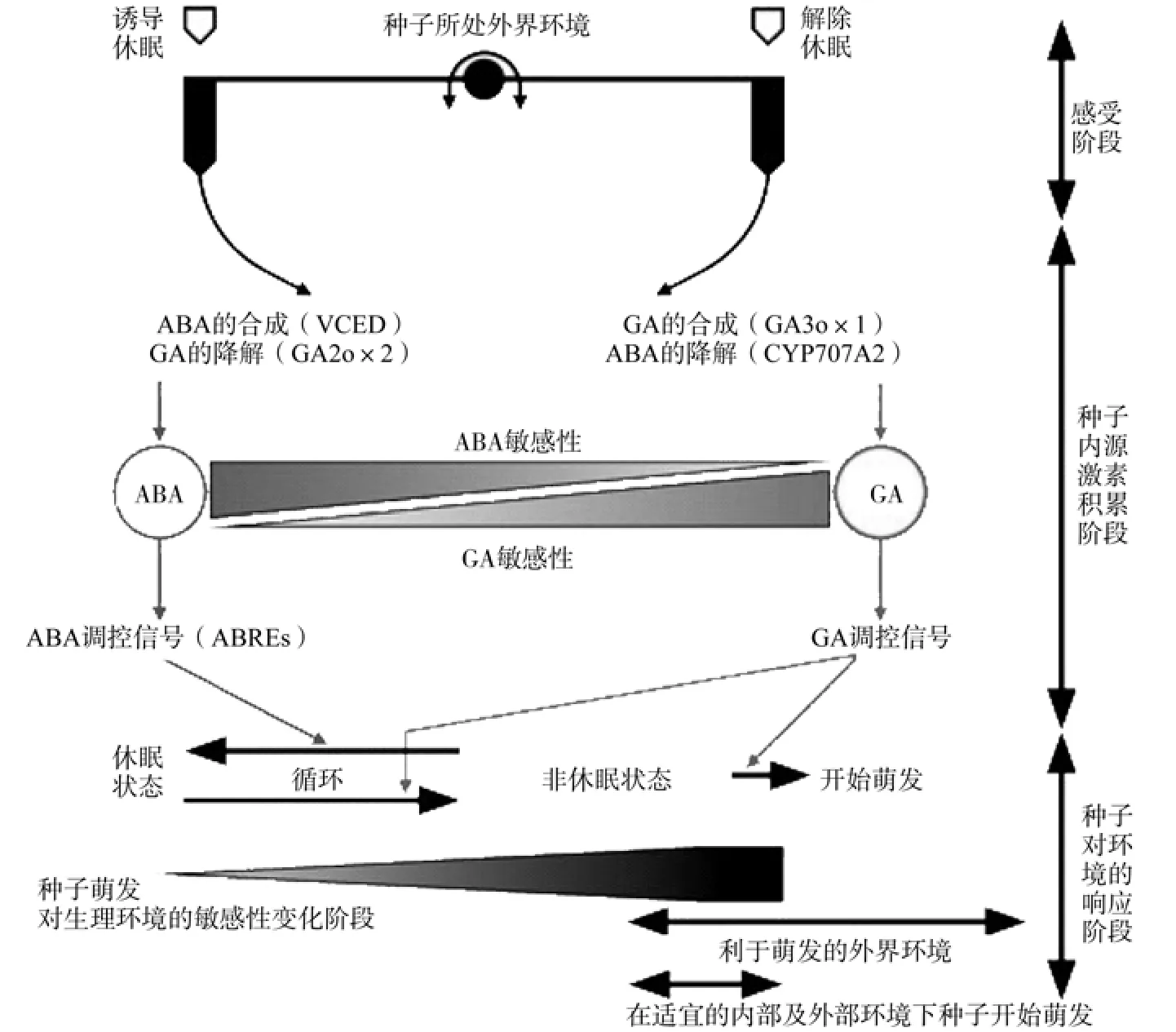
图1 种子休眠与萌发微观调控Fig.1 Schema of micro control of seeds dormancy and germination
由图1可知:因外界环境变化,种子通过调节自身GA合成信号和ABA合成信号,调节GA与ABA的合成代谢,来调节种子的休眠状态(保持休眠态或者终止休眠而萌发),当GA合成信号占主导地位(ABA合成信号减弱)时,种子将过渡到萌芽阶段,但复杂的环境可能使ABA合成信号在过渡期重新增强,这将可能导致种子重新开始休眠,称之为休眠循环。只有当GA合成信号占主导地位,环境利于种子萌发,这两个因素重叠时间长得足够种子完成萌发全部过程,种子才能成功发芽。
2.1 植物激素对种子休眠与萌发的调控
相当多的研究表明,ABA对诱导种子休眠和维持吸胀种子的休眠状态有着积极的调控作用。Kucera等[10]的研究对ABA的这种调控作用做了详细描述。一方面,在种子发育过程中如果ABA含量太低会使成熟后的种子产生初生休眠,而当种子在发育期间基因控制表达的ABA增多,则可以增强种子的次生休眠,延迟发芽[25];再者,在种子发育过程中来源于种子内部产生的ABA可以诱导种子休眠,而其母本合成的ABA却不能诱导种子休眠。另一方面,在休眠态种子吸胀时ABA将重新开始合成(在非休眠态种子中不会出现这种情况),从而使种子保持休眠态,这一点在Cvi生态型拟南芥种子中已被证明[27],这种现象被认为是维持种子休眠的机制。
2006年Leubner-Metzger等[26]发现:在拟南芥中,AtNCED基因家族编码合成的9-顺式-环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenases)是ABA生物合成的关键酶。这一结果表明,在种子胚和胚乳中合成的ABA对诱导种子休眠有重要作用。Ali-Rachedi等[27]发现在强休眠态拟南芥(Cape Verde Island, Cvi)生态型种子的胚中存在着高含量的ABA且其含量随着种子解休眠而降低。最近,Cadman等[24]的有关拟南芥基因转录分析结果更加有力地证明了种子休眠与ABA的生物合成量有关。
Cadman等[24]通 过 对拟 南 芥(Cape Verde Island, Cvi)生态型种子休眠机制进行研究,发现Cvi种子的休眠状态可能由种子内GA和ABA的合成代谢控制(见图1)。Ali-Rachedi等[27]用GA对Cvi休眠种子进行处理时发现Cvi种子内将增加ABA的合成,而Cvi种子经过后熟处理而有效终止休眠时,种子内GA含量的增加不会引起种子ABA合成的增加(见图2)。这说明休眠的种子内存在一种用于维持ABA与GA的含量处于一个较高比例的反馈调节机制。
ABA合成量的增加和GA含量的降低是维持种子休眠的最终原因。Derkx和Karssen[28]在1993年提出种子休眠终止的前提是种子内激素平衡被打破,在“种子的一生”中ABA与GA分别在不同的时间和不同的场所影响着种子的休眠,并且GA对终止种子休眠与促进发芽有着非常重要的作用,同时Steinbach和White[29]用高粱、玉米ABA脱落酸不敏感突变株开展研究,发现GA和ABA能在种子休眠和萌发中共同起作用,种子内GA的合成能抑制种子的生长发育,这和外源ABA对种子生长发育的作用是一样的。控制种子萌发的似乎是种子内源ABA与GA的比例大小,而不是GA与ABA的总量大小,由此看来,在谷物类种子休眠中GA与ABA的调控作用是完全相反的。当然这需要对其它物种开展类似研究,以确定这是否是一个普遍现象。
Cadman等[24]认为种子休眠的原因是ABA与GA维持在一个很高的比例,种子休眠的解除是由其体内的GA合成量的增加和ABA含量减少(使ABA与GA的比值减小)导致的。Fennimore和Foley[30]对野生燕麦Avena fatua萌发进行遗传学研究表明,向培养基中添加GA只能促进发芽,而不参与种子休眠的解除过程。因此,在GA促使种子萌发之前,休眠的解除是ABA的含量减少和GA合成量的增加共同作用所导致的结果(见图1)。
虽然,ABA和GA的浓度能有效地控制种子的胚休眠状态,但种皮和种胚对激素的敏感性如何尚缺少充分的实验依据。种子对GA和ABA的敏感性,GA和ABA对种子发育的调控,这些因素对种子休眠及萌发有极其重要的作用。许多种子由休眠态转变成非休眠态过程中,有一个很明显的特征,即:ABA的敏感性降低,GA的敏感性增强(见图1)。通过对拟南芥脱落酸不敏感型突变株A. thaliana ABA-insensitive abi ABI1至ABI5的表型研究证明,基因ABI1至ABI5参与种子的休眠及萌发调控,ABI1至ABI5通过复杂的转录表达来调控种子休眠的诱导及Cvi种子的解休眠[24],在这方面的研究中还有一个重要发现:处于休眠态的种子,其ABA反应元件(ABA-responsive elements ABRE)及结合在ABRE上的转录因子处于高比例表达状态[31],如Nakabayashi等[32]发现,含有ABRE的基因常大量存在于拟南芥干种子的mRNAs中,且结合于ABRE上的转录因子似乎是介导ABA合成降解及调控种子休眠的主要因子。
Yamauchi等[33]发现在拟南芥生态型哥伦比亚(Columbia Col)种子吸胀过程中种胚内存在很多GA反应元件所在的基因,但这依赖于ABRE的减少。种子萌发过程中,在光刺激下,GA在种子胚中积聚,GA的积聚分两个时期:早期,在种胚形成层中,内部柯巴基二磷酸合酶1 (ent-copalyl diphosphate synthase 1,AtCPS1)合成基因得到大量转录表达,同时,CPS催化牻牛儿基牻牛儿基焦磷酸环化反应(geranylgeranyl diphosphate cyclization reaction)的进行[34];晚期,在胚根的内皮和外皮中,大量合成GA3-氧化酶1(AtGA3ox1)和AtGA3ox2,同时在GA3-氧化酶的催化下合成GA。这表明GA的合成第一步是在种胚形成层形成中间体,然后经细胞间运输至胚根,由GA3-氧化酶催化生成GA[35]。
2.2 环境信号对植物种子休眠与萌发的调控
外界环境可通过影响植物种子内的激素合成降解调控种子的休眠与萌发。光照和低温可以促进蓝珠孔端锌指转录因子(Blue Micropylar End 3 GATA zinc fi nger transcription factor)在胚根中的转录表达,其表达产物对种子萌发及GA合成有积极作用[36]。
Penf i eld[36]提出,种子休眠是由bHLH(helixloophelix) 转 录 因 子 SPT(Spatula) 和 PIL5(Phytochrome-Interacting-Factor-Like5)的联合作用调控的。在黑暗环境下,SPT和PIL5同时抑制种子萌发,且SPT的抑制作用是依赖于PIL5的,而当种子处于光照和低温环境下时,SPT和PIL5的抑制作用会下降,如:PIL5能抑制蛋白质稳定性,在光照下PIL5的抑制作用会下降。Tsiantis[37]推测,bHLH及其等位基因突变体能确定同种不同生态型之间及不同种的植物之间种子的休眠状态(随光和温度的变化而变化)。
通过对不同休眠深度的拟南芥生态型Cvi种子进行全转录分析发现许多GA反应元件所在的基因存在差异表达[34]。这项研究还发现,在种子休眠的任何时期都会合成大量的GA前体:AtGA20ox1不断地转录表达不具生物活性的GA9和GA20,同时,AtGA2ox1一直处于高比例转录表达中,这使得具有活性的GA(如:GA1、GA4)很快降解,只有当种子处于光照条件下时,AtGA3ox2才开始转录表达,以完成GA合成的最后一步(GA9转变成GA4,GA20转变成GA1)。在种子内,有活性的ABA与GA的比值处于一个动态平衡,当ABA合成信号增强,则种子休眠;当GA合成信号增强,种子就开始萌发(见图1)。所以,种子休眠与萌发之间的转变是由这发出的这两个信号的基因控制的。
Kucera等[10]提出,GA对种子的萌发有两个积极作用:(1)GA能增强种胚的活力,促进发芽;(2)GA能使种子打破种皮及外种皮的束缚,弱化胚根周围组织,从而促进发芽。其他激素也都是通过调控基因的转录表达来影响种子休眠的诱导、维持及解除的。另外一个重要信息是:关于通过研究自然等位基因微点变异与休眠及发芽的关系来调控种子萌发,目前,在拟南芥、谷类植物中,用数量性状位点(Quantitative trait loci QTL,一个性状由多个基因决定,每个基因对此性状都是微效的 )鉴定出调控其种子休眠及发芽的相关基因[38]。虽然目前已经有很多的QTL已被鉴别出,但是对这些基因的克隆方面至今仍未见相关的研究成果。
2.3 后熟对植物种子休眠与萌发的影响
干的成熟种子在一个特定温度(种子收获时的温度)下贮存一段时间(一般为几个月)后休眠会被打破[39],这就是因为后熟作用的效果。本文综合后熟作用的相关研究成果,总结后熟处理中植物种子内激素变化(见图2)。由图2可知:后熟作用打破休眠种子内ABA与GA的平衡,使GA合成增加,ABA分解代谢,从而使休眠种子、处于非休眠态的种子在光等外界环境条件的刺激下完成发芽。
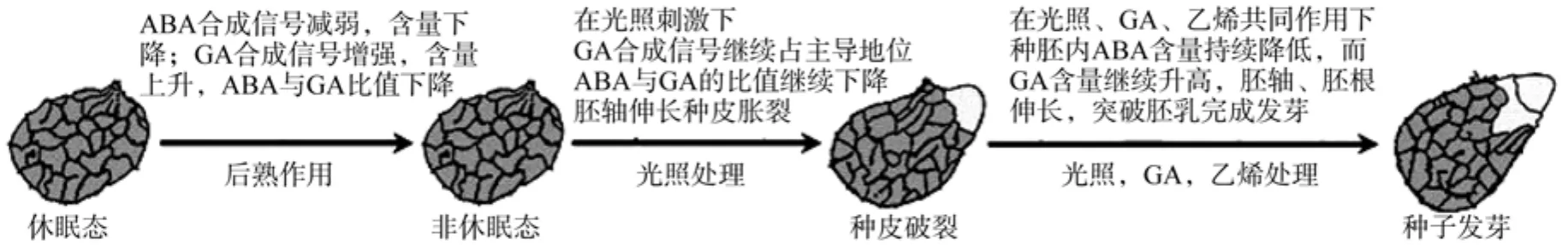
图2 休眠态种子萌发过程中内源激素变化Fig.2 Changes of endogenous hormone in whole process of dormant seed germination
种子后熟过程中会产生5个方面的作用:(1)发芽温度范围扩大;(2)ABA敏感性下降,GA敏感性增强或种子萌发对GA的浓度要求降低甚至消失;(3)对光照敏感性下降,即使在光照条件下种子也不会萌发;(4)使种子发芽不再依赖于硝酸盐;(5)使种子萌发速度提高[40](见图2)。影响种子后熟作用的因素有:种子水分含量、油分含量,种皮及外种皮的结构,后熟处理所处环境的温度、湿度[41]。所以在对种子进行后熟处理时应注意以下2点:(1)种子的结合水含量不能太低;(2)种子贮存环境的湿度不能太高,有几个品种已被证明,低湿度下进行后熟处理能有效地打破休眠。
后熟作用的分子机制目前还没研究清楚,很多学者提出了自己的观点,如:非酶反应使种子内抑制物被去除[42]、种子内细胞膜性状改变[43]、特定的蛋白质在蛋白酶催化下降解[44]等。Bove等[45]用基因扩增片段长度多态性基因表达对烟草种子后熟过程进行分析,发现烟草种子在这过程中产生了一个转录水平上的发育开关。接下来Cadman等[24]对拟南芥生态型Cvi种子进行研究也发现了同样的现象。最近,Leubner-Metzger[46]发现,风干的烟草种子经过60 d的干燥贮存后外种皮会自然破裂,这与烟草种子保护层中的β-1,3-葡聚糖酶合成基因的表达有关。Bove等[45]发现在风干的结合水含量低的烟草种子后熟过程中至少有8种mRNA在种子中积累。因此,mRNAs和蛋白质的降解是后熟过程中维持休眠的一种分子机制。我们在对种子进行后熟处理时应考虑到这些物质表达基因的重新转录表达。
3 小 结
(1)在分子水平上,生理休眠型种子根据萌发环境的变化不断调整ABA敏感性及合成量以维持种子的休眠状态。激素通过合成代谢调节使种子内的ABA与GA的比值处于一个较高值的动态平衡中,以使种子在外界环境的刺激下依旧维持自身休眠或萌发的状态。通过这种信号转导机制,协调种子内生理生化反应诱导或终止休眠。而诱导休眠的关键基因可能由于自然选择而发生等位点基因变异,这导致同种或不同种植物之间的休眠调控机制各不一样。当考虑环境因子对发芽的影响时,会发现种子对所有的环境因子(如:光照、温度、湿度、水分、氧气、化感物质等)的敏感性都不同。因此,要给休眠下一个很精确的定义显得非常困难。不同种子萌发对环境要求不同,诱导种子萌发的环境因子可能非常极端,至少在自然环境中基本不可能存在,这种要求使得种子很难自然萌发。而且,发芽要完成,必须是种子的敏感性与环境条件重叠达到一个足够种子完成发芽的时间。
(2)结合种子休眠的分子机制,本文中试图将植物种子休眠分为种胚休眠、种子覆盖物休眠、种皮休眠等3个基本类型,并根据各自不同的休眠机制提出一些打破休眠并促进种子萌发的基本方法(见表1),建议可针对不同休眠类型的植物种子,使用不同的方式解除种子的休眠,促进其萌发。

表1 终止种子休眠与促进种子萌发的基本方法Table 1 Ways to terminate dormancy and promote germination
(3)虽然近年来在激素对种子休眠萌发的影响方面的研究取得了很大进展,但这些研究很多都局限于一些模型植物,如:拟南芥、谷类植物、烟草等。大量的非模式植物,特别是一些自然萌发率低下的木本植物种子的休眠与萌发调节机制研究方面尚十分薄弱,急待开展深入研究。建议系统运用ABA 与GA 突变体平台技术、分子标记技术、转基因技术、反义 RNA阻止基因表达技术、cDNA 克隆技术、蛋白质组学分析技术及基因组学技术等开展非模式植物种子休眠与萌发机制的分子生物学研究,从内在机制上直接支撑这些木本植物种子解休眠与人工萌发、资源人工快繁等生产实践的需要,为珍稀木本植物的保护性利用提供有力的理论和技术依据。
[1] Vlees Hou Werslm, Bouw Meester H J. A simulational model for seasonal changes in dormancy and germination of weed seeds[J].Seed Science Research, 2001, 11: 77- 92.
[2] Hilhorst H W M. The regulation of secondary dormancy. The membrane hypothesis revisited[J]. Seed Science Research,1998,8: 77-90.
[3] Fenner M, Thompson K. The ecology of seeds[M]. Cambridge,UK: Cambridge University Press, 2004.
[4] Walck J L, Baskin J M, Baskin C C, et al. Defining transient and persistent seed banks in species with pronounced seasonal dormancy and germination patterns[J]. Seed Science Research,2005,15: 189-196.
[5] 杨荣超, 张海军, 王 倩, 等. 植物激素对种子休眠和萌发调控机理的研究进展[J]. 草地学报, 2012, (1): 945-946.
[6] Manz B, Müller K, Kucera B, et al. Water uptake and distribution in germinating tobacco seeds investigated in vivo by nuclear magnetic resonance imaging[J]. Plant Physiology, 2005,138:1538–1551.
[7] 金晓玲, 何 平, 张日清. 榉树茎尖的培养[ J] . 中南林学院学报, 2005, 25( 1): 38- 41.
[8] 吴丽君. 香椿组培快繁效率的影响因子[ J] . 中南林学院学报,2005, 25(2) : 25-29.
[9] Baskin J M, Baskin C C. A classification system for seed dormancy[J]. Seed Science Research, 2004, 14: 1–16.
[10] Kucera B, Cohn M A, Leubner-Metzger G. Plant hormone interactions during seed dormancy release and germination[J].Seed Science Research, 2005.15: 281– 307.
[11] Ðiki, Mirha, Gadžo, et al. Podrug, Adnana[J]. Herbologia, 2011,12(1), 149-155.
[12] Baskin C C, Baskin J M. Underdeveloped embryos in dwarf seeds and implications for assignment to dormancy class[J]. Seed Science Research, 2005, 15:357–360.
[13] Finch-Savage W E, Bergervoet J H W, Bino R J, et al. Nuclear replication activity during seed-dormancy breakage and germination in the three tree species: Norway maple (Acer platanoides L.), sycamore (Acer pseudoplatanus L.) and cherry(Prunus avium L.) [J]. Annals of Botany, 1998, 81: 519–526.
[14] Jacobsen J V, Pressman E. A structural study of germination in celery (Apium graveolens L.) seed with emphasis on endosperm breakdown[J]. Planta, 1979, 144: 241–248.
[15] Hepher A, Roberts J A. The control of seed germination in Trollius ledebouri: The breaking of dormancy[J]. Planta, 1985,166: 314–320.
[16] Baskin C C. Breaking physical dormancy in seeds–focussing on the lens[J]. New Phytologist, 2003, 158: 227–238.
[17] Baskin J M, Baskin C C. A classification system for seed dormancy[J]. Seed Science Research, 2004,14: 1–16.
[18] Bewley J D, Black M. Seeds-physiology of development and germination, 2nd edn[M]. New York: Plenum Press,1994.
[19] Batlla D, Kruk B C, Benech-Arnold R L. Modelling changes in dormancy in weed soil seed banks: Implications for the prediction of weed emergence. Handbook of seed physiology:applications to agriculture[M]. New York: Food Product Press and the Haworth Reference Press, 2004:245–270.
[20] Sanchez R A, Mella R A. The exit from dormancy and the induction of germination: Physiological and molecular aspects[C]// Benech-Arnold R L, Sanchez R A. Handbook of seed physiology: applications to agriculture. New York: Food Product Press and the Haworth Reference Press, 2004: 221–243.
[21] Leubner-Metzger G. Brassinosteroids and gibberellins promote tobacco seed germination by distinct pathways[J]. Planta, 2001,213: 758–763.
[22] Krock B, Schmidt S, Hertweck C, et al. Vegetation-derived abscisic acid and four terpenes enforce dormancy in seeds of the post-f i re annual, Nicotiana attenuata[J]. Seed Science Research,2002, 12: 239–252.
[23] Leubner-Metzger G, Meins F Jr. Antisense-transformation reveals novel roles for class I β-1,3-glucanase in tobacco seed after-ripening and photodormancy[J]. Journal of Experimental Botany, 2001, 52: 1753–1759.
[24] Cadman C S C, Toorop P E, Hilhorst H W M, et al. Gene expression profiles of Arabidopsis Cvi seed during cycling through dormant and non-dormant states indicate a common underlying dormancy control mechanism [J]. Plant Journal, 2006,46: 805–822.
[25] Kushiro T, Okamoto M, Nakabayashi K, et al. The Arabidopsis cytochrome P450 CYP707A encodes ABA 8-hydroxylases: key enzymes in ABA catabolism[J]. EMBO Journal, 2004, 23: 1647–1656.
[26] Leubner-Metzger G. Hormonal interactions during seed dormancy release and germination[C]//Handbook of seed science and technology. Binghamton: The Haworth Press, 2006: 303–342.
[27] Ali-Rachedi S, Bouinot D, Wagner M H, et al. Changes in endogenous abscisic acid levels during dormancy release and maintenance of mature seeds: studies with the Cape Verde Islands ecotype, the dormant model of Arabidopsis thaliana[J]. Planta,2004, 219: 479–488.
[28] Derkx M P M, Karssen C M. Physiologia Plantarum. 18.x.Effects of light and temperature on seed dormancy and gibberellin-stimulated germination in Arabidopsis thaliana:studies with gibberellin-deficient and -insensitive mutants[J].Physiologia Plantarum , 1993,89(2):360-368
[29] White C N, Rivin C J. Gibberellins and seed development in maize. II. Gibberellin synthesis inhibition enhances abscisic acid signaling in cultured embryos[J]. Plant Physiology,2000,122:1089–1097.
[30] Fennimore S A, Foley M E. Genetic and physiological evidence for the role of gibberellic acid in the germination of dormant Avena fatua seeds[J]. Journal of Experimental Botany, 1998, 49: 89–94.
[31] Blake C. Meyers, Genome-Wide Analysis of NBS-LRREncoding Genes in Arabidopsis[J]. Plant Cell, 2003, 15(7): 1683-1683.
[32] Nakabayashi K, Okamoto M, Koshiba T, et al. Genomewide profiling of stored mRNA in Arabidopsis thaliana seed germination: epigenetic and genetic regulation of transcription in seed[J]. Plant Journal, 2005,41: 697-709.
[33] Yamauchi Y, Ogawa M, Kuwahara A, et al. Activation of gibberellin biosynthesis and response pathways by low temperature during imbibition of Arabidopsis thaliana seeds[J].Plant Cell, 2004, 16: 367-378.
[34] Fei H, T sang E, Cutler A J. Gene expression during seed maturation in Brassica napus in relation to the induction of secondary dormancy [J] . Plant Biotechnology,2007,89:419-428.
[35] Linkies, Ada; Müller, Keratin, et al. Ethylene Interacts with Abscisic Acid to Regulate Endosperm Rupture during Germination: A Comparative Approach Using Lepidium sativum and Arabidopsis thaliana[J]. Plant Cell. 2009,21(12):3803-3822.
[36] Penf i eld S, Josse E-M, Kannangara R, Gilday A D, et al. Cold and light control seed germination through the bHLH transcription factor SPATULA[J]. Current Biology, 2006, 15: 1998.
[37] Tsiantis M. Plant development: Multiple strategies for breaking seed dormancy[J]. Current Biology, 2006,16: 25–27.
[38] Finch-Savage, William E, Footitt Steven. To germinate or not to germinate: a question of dormancy relief not germination stimulation[J]. Seed Science Research. 2012,22(4), p243-248
[39] Carrera Esther, Holman Tara, Medhurst, et al. Estradiol Acts Directly on Bone Marrow Myeloid Progenitors to Differentially Regulate GM-CSF or Flt3 Ligand-Mediated Dendritic Cell Differentiation[J]. Plant Journal, 2008, 53(2): 214-224.
[40] De Casas, Rafael Rubio, Kovach, et al. Seed after-ripening and dormancy determine adult life history independently of germination timing[J]. New Phytologist.,2012,194(3): 868-879.
[41] Holdsworth, Michael J, Bentsink, Leónie, et al. Molecular networks regulating Arabidopsis seed maturation, after-ripening, dormancy and germination[J]. New Phytologist, 2008, 179(1): 33-54
[42] Bailly C. Active oxygen species and antioxidants in seed biology[J]. Seed Science Research, 2004,14: 93-107.
[43] Hallett B P, Bewley J D. Membranes and seed dormancy: beyond the anaesthetic hypothesis[J]. Seed Science Research, 2002, 12: 69-82.
[44] Borghetti F, Noda F N, de Sa C M. Possible involvement of proteasome activity in ethylene-induced germination of dormant sunflower embryos[J]. Brazilian Journal of Plant Physiology,2002, 14: 125-131.
[45] Bove J, Lucas P, Godin B, et al. Gene expression analysis by cDNA-AFLP highlights a set of new signaling networks and translational control during seed dormancy breaking in Nicotiana plumbaginifolia[J]. Plant Molecular Biology, 2005, 57: 593-612.
[46] Leubner-Metzger G. β-1,3-Glucanase gene expression in lowhydrated seeds as a mechanism for dormancy release during tobacco after-ripening[J]. Plant Journal, 2005, 41: 133-145.
Research progresses on regulation mechanisms of plant seeds dormancy and germination
CHENG Peng, WANG Ping, SUN Ji-kang, FEI Ming-liang, YANG Hui
(School of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
The phenomenon of seeds dormancy presents throughout the higher plants, and because the plants need to adapt to the different environment changes, their way of seeds dormancy has therefore developed variously. Focusing from the perspective of physiology, biochemistry and molecular biology, the latest research results in the regulation mechanisms of seeds dormancy and germination were summarized. Thus, in the hope of providing a guidance and a theoretical basis for explicitly researching of plant seeds dormancy and germination and for the practical work of seeds dormancy break and artif i cial seeds germination.
plant seeds; dormancy; germination; regulation mechanism; review
S722.1
A
1673-923X(2013)05-0052-07
2012-12-17
国家林业公益性行业科研专项(201204606);湖南省科技计划重点项目(2012WK2014);教育部博士点学科专项基金(20094321110002)
程 鹏(1988-),男,湖南长沙人,硕士研究生,研究方向为分子生物学与生物化学;E-mail:cp8894@126.com
王 平(1964-),男,湖南常德人,教授,博士,博士生导师,主要从事应用生物技术方面的教学与研究工作;
E-mail:csfuwp@163.com
[本文编校:谢荣秀]
