人工油松林恢复过程中土壤理化性质及有机碳含量的变化特征
2013-12-19胡会峰刘国华
胡会峰,刘国华
(1.中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京100085;2.School of Agricultural,Forest,and Environmental Sciences,Clemson University,Clemson 29634,USA)
土壤是陆地生态系统中最大的碳库,全球约有1500 Pg C(0—100 cm内;1 Pg=1015g)以有机质形式存在于土壤中,其贮量大约是陆地植被碳贮量(500—600 Pg C)的3倍、大气碳贮量(750 Pg C)的2倍[1-4],因此土壤有机碳库的微小变化,都会对全球碳循环和碳平衡产生重要影响[5-7]。植被恢复,特别是造林、再造林,增加了陆地森林生态系统的碳贮存和“碳汇”功能,有效调节了陆地与大气之间的碳交换,减少了人为源CO2和其他温室气体的排放,已被公认为是一种减缓全球气候变化的有效手段[8-11]。此外,通过枯枝落叶腐质化和矿质化过程及根系与土壤的生理生化作用,森林恢复还可以有效改善土壤结构以及土壤养分,而改善后的土壤结构,一方面可以提高土壤保存肥力、固定养分、涵养水分的功能,促进植物的健康成长,从而达到改善当地环境、遏制生态退化的目的,而另一方面可以增强森林生态系统的“碳汇”功能[12-14]。本文目的就是通过研究岷江上游人工油松林恢复过程中土壤理化性质及土壤有机碳含量的变化特征,一方面为我们理解植被恢复过程中植物与土壤的相互作用机理,指导退化生态环境的恢复和重建提供理论支持,另一方面也为评估区域森林生态系统的“碳汇”功能提供数据支持。
1 材料与方法
1.1 研究区概况
野外研究位于岷江上游大沟流域——中国科学院茂县山地生态系统定位研究站(31°42'N,103°54'E,海拔1826 m)站区。该区气候类型属山地温带气候,年日照时数1378.8 h,年日照百分率31%;年均温9.3℃,极端最高气温30.9℃,极端最低气温-13.5℃,最冷月1月份平均气温-0.9℃,最热月7月份平均气温18.6℃,≥10℃年有效积温954.1℃,无霜期215 d;年降雨量825.2 mm,年蒸发量968.7 mm,年均相对湿度81.1%[15-16]。该地段土壤为淋溶褐土至棕壤性土,母岩多变质岩,母质为千枚岩残坡积物,高阶上为第四纪黄土状物质[17]。由于长期森林砍伐以及人为破坏,该流域森林资源锐减,大部分原始森林退化成次生灌丛、坡地和荒坡,加之干旱河谷生态环境极端脆弱,使环境退化程度不断加重,滑坡、泥石流等自然灾害频繁发生,是四川省水土流失最为严重的区域之一,制约了当地社会经济的发展[17-18]。为有效遏止当地生态环境退化,尽快恢复和重建退化植被,自20世纪60年代以来,该流域一直通过人工造林来加速恢复当地植被,防治环境退化,目前森林植被中有60年代至90年代等不同年代所造的油松林(Pinus tabulaeformis;PF)、云杉林(Picea asperata)以及自然恢复的油松-辽东栎(Quercus wutaishanica)针阔混交林和次生灌丛等,植被长势良好。
1.2 样地设置
采用时间序列方法,以空间代替时间,在茂县生态站附近主要人工造林区域,分别选择4个不同恢复时期的人工油松林样地(PT12(12a)、PT18(18a)、PT25(25a)、PT35(35a))作为恢复系列的研究对象。其中,人工油松林的林龄采用年轮钻钻树的方法确定:在每个样地内选择一个10 m×10 m的大样方,在其中选择10棵标准木,用年轮钻在其胸径处钻取木芯,通过数年轮的方法确定每棵树的林龄,最后取平均来确定整个样地的恢复时期;其余调查内容包括:地理位置、海拔、坡度、坡向、坡位;同时调查了每棵树的胸径、冠幅、枝下高、树高等基本特征(表1)。林下主要灌木物种有峨嵋蔷薇(Rosa omeiensis),虎榛子(Qstryopsis davidiana),美丽胡枝子(Lespedeza formosa)等;主要草本物种有丝叶苔草(Carex capilliformis),毛果堇菜(Viola collina)等。
1.3 土壤样品采集和分析
在10 m×10 m的大样方内随机选取2个取样点,采用分层多点混合取土样方法进行。在每个取样点以0—15 cm,15—30 cm,30—50 cm为土层间隔,用标准环刀(100 cm3)取样,然后将环刀内土壤在105℃ (至少24 h)的高温下烘干至恒重,称量并计算土壤含水率和土壤容重。同时相应地在各个土层取一些土壤,自然风干,用2 mm直径的筛子过筛,拣去石块、草根等杂质,同时称量大于2 mm的砂砾的质量,进一步拣去过筛土壤中的杂质(主要是草根、动物的排泄物)后,将来自同一样方同一土层的土样混均,用四分法取样,一部分用于土壤物理指标的测定,一部分用土壤粉碎机(S100,Retsch Co.,Germany)将土壤研细,备化学实验分析所用。

表1 人工油松林样地基本情况Table 1 Plot characteristics of Pinus tabulaeformis plantations
土壤理化性质按照中国土壤学会编写的土壤农业化学分析方法进行[19],土壤容重和土壤孔隙度采用标准环刀(100 cm3)取样分析法(假定土壤比重为2.65 g/cm3)测定;土壤pH值用室内用土壤pH计(Delta320)(1∶2.5的土水质量比)测定;土壤质地和土壤比表面积采用激光粒度分析仪(Mastersizer 2000,Malvern Instruments Co.,UK)测定;土壤有机质含量用重铬酸钾油浴外加热法测定[20];土壤有机碳含量(kg/m2)采用分层法计算[21],公式如下:
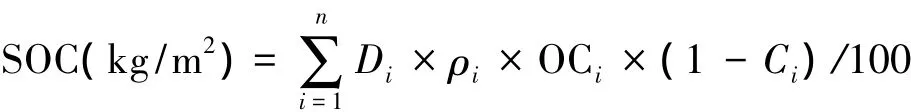
式中,SOC为土壤有机碳含量(kg/m2),n为土壤剖面的层数,Di为土壤第i层的厚度(cm),ρi为第i层的土壤容重(g/cm3),Ci为第i层土壤中直径大于2 mm的砂砾含量(%),OCi为第i层土壤有机碳浓度(g/kg)。
1.4 数据处理和统计分析
相关分析以及单因素方差分析(Analysis of variance;ANOVA)在SAS 9.1(SAS Institute Inc.,USA)中完成,显著性检验采用Fisher's LSD(P<0.05)检验。
2 结果与分析
2.1 土壤理化性质
由表2可见,对不同恢复阶段0—15 cm土壤层而言,所测定的土壤理化指标都存在显著差异,其中土壤比表面积和土壤粘粒含量沿恢复梯度逐渐增加,PT12土壤比表面积显著小于PT18,PT25和PT35,PT12和PT18土壤粘粒含量显著小于PT25和PT35。与PT12相比,PT35显著增加了土壤砂粒和有机质含量,显著降低了土壤粉粒含量和pH值;对不同恢复阶段15—30 cm土壤层而言,所测定的土壤理化指标除土壤砂粒含量外,都存在显著差异,其中土壤比表面积和土壤粘粒含量依旧沿恢复梯度逐渐增加,PT12土壤比表面积显著小于PT35,PT12和PT18土壤粘粒含量显著小于PT25和PT35,并且PT25土壤粘粒含量也显著小于PT35。与PT12相比,PT35显著增加了土壤有机质含量,显著降低了土壤粉粒含量和pH值;对不同恢复阶段30—50 cm土壤层而言,所测定的土壤理化指标除土壤容重,土壤孔隙度外,其它指标依然存在显著差异,其中土壤比表面积和土壤粘粒含量依旧沿恢复梯度逐渐增加,PT12和PT18土壤比表面积显著小于PT35,PT12和PT18土壤粘粒含量显著小于PT25和PT35,并且PT25土壤粘粒含量也显著小于PT35。与PT12相比,PT35显著增加了土壤砂粒和有机质含量,显著降低了土壤粉粒含量和pH值。
土壤理化性质的相关分析表明(表3),土壤有机质与土壤粘粒,土壤比表面积显著正相关,与土壤容重显著负相关。在所测定的土壤物理指标中,土壤比表面积与土壤粘粒显著正相关,与土壤粉粒显著负相关;土壤粘粒与土壤粉粒显著负相关,与土壤砂粒显著正相关;土壤粉粒则与土壤砂粒显著负相关。

表2 人工油松林恢复过程中土壤理化性质的变化Table 2 Dynamics of soil physic-chemical properties along the restoration chronosequence in Pinus tabulaeformis plantations

表3 人工油松林土壤理化性质的相关分析Table 3 Correlation analysis with soil physic-chemical properties in Pinus tabulaeformis plantations
2.2 土壤有机碳含量
从图1可以看出,沿恢复梯度,0—50 cm的土壤有机碳含量呈显著增加趋势,从PF12的5.59 kg/m2显著增加到 PF18 的5.91 kg/m2(6%),PF25 的8.40 kg/m2(50%),及 PF35 的12.64 kg/m2(126%),平均每年增加0.31 kg/m2。此外土壤有机碳在恢复过程中表现出加速增加的趋势,从最初的平均每年增加0.05 kg/m2(PF12—PF18),提高到中期的 0.36 kg/m2(PF18—PF25),以及后期的 0.42 kg/m2(PF25—PF35)。
3 结论与讨论
3.1 植被恢复过程中土壤理化性质的变化趋势
土壤结构的改善以及土壤肥力的提高,是植被恢复的一个重要目标[13-14]。森林群落演替与土壤演化之间存在相互影响、相互作用的关系。植被通过根系分泌物和残体向土壤提供C、N,影响土壤有机质的输入,从而显著影响土壤结构和理化性质[22-23]。通过研究植被恢复过程中土壤理化性质的变化规律,认识植被对土壤肥力、土壤质量的作用,揭示植被恢复过程中土壤肥力的演化机制,可以为森林生态系统的可持续管理和利用提供理论依据[24]。研究结果表明土壤理化性质随着植被的恢复呈现出一定的变化规律,其中土壤比表面积和土壤粘粒含量表现最为明显。沿恢复梯度,在不同的土壤层中,土壤比表面积和土壤粘粒含量都呈现显著逐渐增加的趋势,只是显著性在不同土壤层有所不同而已。此外,与恢复初期相比,恢复后期土壤粉粒含量和土壤pH值都有显著降低,而土壤有机质含量呈显著提高,表明恢复过程中土壤肥力的持续改善。土壤有机质与土壤容重呈显著负相关,这是因为土壤有机质与土壤物理性质密切相关,一般有机质含量越高,团粒结构越多,土壤单粒排列疏松,孔隙度越大,通气性能越好,土壤容重越低[25]。土壤有机质与土壤粘粒含量呈显著正相关,主要是因为土壤细颗粒的增多有助于土壤养分的积累[23,26]。土壤比表面积反映土壤固定和吸附营养元素的能力,单位质量的面积越大,土壤吸附养分的能力越强,土壤肥力也越高,所以两者之间呈现显著正相关。而土壤细颗粒的多少,也直接反映了单位质量土壤表面积的多少,相关分析也证明土壤比表面积显著正相关与土壤粘粒含量,却显著负相关与土壤粉粒含量。此外刘占锋等在同一地区的研究还发现随着植被的恢复,土壤全氮,全磷以及土壤微生物生物量C、N也都有不同程度的增加[23]。游秀花对武夷山不同林龄的马尾松天然演替林的研究同样发现:随着马尾松天然林群落的进展演替,土壤物理性状得到改善,土壤容重减小,土壤的渗透性、自动调节能力、水源涵养功能等能力得到提高,土壤有机质、全N、速效K等土壤养分指标递增[24]。其他类似的研究也表明人工林可以恢复退化土壤的性状和维持土壤肥力[27-29]。

图1 不同恢复阶段人工油松林0—50cm土壤有机碳含量Fig.1 0—50 cm Soilorganic carbon contentof Pinus tabulaeformis plantations along the restoration chronosequence*
3.2 植被恢复过程中土壤有机碳含量的变化趋势
植被恢复,除了有效减缓地区的生态恶化,改善地区环境外,另一方面利用植物的光合作用和土壤有机碳的蓄积固定了大气中的CO2,有助于缓解全球的温室效应[6,10,30-33]。在本研究中,采用时间序列方法探讨了岷江上游人工油松林恢复过程中土壤有机碳的动态变化。结果表明0—50cm土壤有机碳含量沿恢复梯度呈显著逐渐递增的趋势,平均年际固碳速率达到0.31 kg/m2。国内外类似的许多研究结果也证实了这种增长的存在[6,10,32,34-35]。例如,Zerva 等发现新英格兰 12、20、30a 硬木云杉人工林下土壤有机碳含量分别是 14.、18.1、24.9 kg/m2,平均年际固碳速率为 0.57 kg/m2[35]。
土壤固碳速率受气候、耕作历史、土壤母质、栽种树种、恢复时间、取样深度等诸多因素的影响[8,10,32,36]。目前全球次生林和人工林的土壤平均年际固碳速率是33.8 g/m2[32]和30 g/m2[8]。研究结果要明显高于全球的平均值,但与热带、亚热带某些地区次生林和人工林的土壤固碳速率相当。Lugo和Sanchez研究发现,热带波多黎各地区弃耕100—300a的次生林的土壤固碳速率高达0.08—0.40 kg/m2[37];Brown和Lugo也发现,弃耕50a的亚热带桃心木人工林50 cm内土壤的固碳速率为0.31 kg/m2[38]。如此高的土壤固碳速率,是与该区域土壤最初的肥力有关,土壤越贫瘠,植被恢复后土壤固碳速率越大[8]。岷江上游以前由于生态系统退化、水土流失严重,土壤非常贫瘠,因此一旦有植被覆盖后,土壤肥力就会迅速回升,因此固碳速率较高。许多研究表明土壤固碳速率会随着恢复时间的推移迅速下降[8,33,38-40]。例如,Silver等通过分析文献资料,发现在热带退耕农田和牧场上造林后,0—25 cm土壤100a内的平均年际固碳速率为41 g/m2,但是前20a内的平均年际固碳速率则高达130 g/m2[40]。土壤有机碳固碳速率在本研究尺度内,并没有随着恢复时间的推移迅速下降,反而表现出加速增加的趋势,从最初的平均每年增加0.05 kg/m2,提高到中期的0.36 kg/m2,以致后期的0.42 kg/m2。一方面表明土壤结构的改善,可以加速土壤有机碳的累积,另一方面也说明了岷江上游人工油松林在植被恢复35a之后土壤还具有很大的固碳潜力。
[1] Dixon R K,Solomon A M,Brown S,Houghton R A,Trexler M C,Wisniewski J.Carbon pools and flux of global forest ecosystems.Science,1994,263(5144):185-190.
[2] Batjes N H.Total carbon and nitrogen in the soils of the world.European Journal of Soil Science,1996,47(2):151-163.
[3] Jobbàgy E G,Jackson R B.The vertical distribution of soil organic carbon and its relation to climate and vegetation.Ecological Applications,2000,10(2):423-436.
[4] Fantappiè M,L'Abate G,Costantini E A C.The influence of climate change on the soil organic carbon content in Italy from 1961 to 2008.Geomorphology,2011,135(3/4):343-352.
[5] Turner J,Lambert M.Change in organic carbon in forest plantation soils in eastern Australia.Forest Ecology and Management,2000,133(3):231-247.
[6] Guo L B,Gifford R M.Soil carbon stocks and land use change:a meta analysis.Global Change Biology,2002,8(4):345-360.
[7] Poeplau C,Don A,Vesterdal L,Leifeld J,van Wesemael B,Schumacher J,Gensior A.Temporal dynamics of soil organic carbon after land-use change in the temperate zone-carbon response functions as a model approach.Global Change Biology,2011,17(7):2415-2427.
[8] Bruce J P,Frome M,Haites E,Janzen H,LaI R,Paustian K.Carbon sequestration in soils.Journal of Soil and Water Conservation,1999,54(1):382-389.
[9] IPCC.The carbon cycle and atmospheric carbon dioxide//Watson R T,Noble I R,Bolin B,Ravindranath N H,Verardo D J,Dokken D J,eds.Land Use,Land-Use Change and Forestry:A Special Report of the International Panel on Climate Change.Cambridge,UK:Cambridge University Press,2000:183-238.
[10] Paul K I,Polglase P J,Nyakuengama J P,Khanna P K.Change in soil carbon following afforestation.Forest Ecology and Management,2002,168(1/3):241-257.
[11] Laganiére J,Angers D A,Paré D.Carbon accumulation in agricultural soils after afforestation:a meta-analysis.Global Change Biology,2010,16(1):439-453.
[12] Hu H,Liu S Q,Chen Q H,Wang C Q,Pan K W,Pang X Y.Changes of soil properties during artificial recovery of subalpine coniferous forests in western Sichuan.Chinese Journal of Applied and Environmental Biology,2001,7(4):308-314.
[13] Plotnikoff M R,Bulmer C E,Schmidt M G.Soil properties and tree growth on rehabilitated forest landings in the interior cedar hemlock biogeoclimatic zone:British Columbia.Forest Ecology and Management,2002,170(1/3):199-215.
[14] Li Y Y,Shao M A.Change of soil physical properties under long-term natural vegetation restoration in the Loess Plateau of China.Journal of Arid Environments,2006,64(1):77-96.
[15] Wu N,Liu Q.Restoration and Rehabilitation of Degraded Mountain Ecosystem on Upper Minjiang River.Chengdu:Sichuan Scientific and Technology Press,2007:19-28,32-33.
[16] Jiang Y M,Pang X Y,Bao W K.Soil microbial biomass and the influencing factors under Pinus tabulaeformis and Picea asperata plantations in the upper Minjiang River.Acta Ecological Sinica,2011,31(3):801-811.
[17] Wang C M,Bao W K,Chen J Z,Sun H,Xie J S.Profile characteristics and nutrients of dry cinnamon soils in dry valley of the upper Minjiang River.Chinese Journal of Applied and Environmental Biology,2003,9(3):230-234.
[18] Guo Y M,Tang Z X.Prevention and control of soil erosion in the upper reaches of the Minjiang River.Mountain Research,1995,13(4):267-272.
[19] Lu R K.Analytical Methods of Soil Agrochemistry.Beijing:Chinese Agriculture Science and Technology Press,1999.
[20] Bao S D.Analysis of Soil Agrochemistry.3rd ed.Beijing:Chinese Agriculture Press,2000:14-38.
[21] Wu H B,Guo Z T,Peng C H.Land use induced changes of organic carbon storage in soils of China.Global Change Biology,2003,9(3):305-315.
[22] Rutigliano F A,Ascoli R D,De Santo A V.Soil microbial metabolism and nutrient status in a Mediterranean area as affected by plant cover.Soil Biology and Biochemistry,2004,36(11):1719-1729.
[23] Liu Z F,Liu G H,Fu B J,Hu H F,Zheng X X,Wu Y Q.Dynamics of soil microbial biomass C,N along restoration chronosequences in pine plantations.Acta Ecological Sinica,2007,27(3):1011-1018.
[24] You X H.Dynamics of soil physical and chemical properties in different succession stages of Pinus massoniana natural forests.Journal of Fujian College of Forestry,2005,25(2):121-124.
[25] Pang X Y,Liu S Q,Liu Q,Wu Y,Lin B,He H,Zhang Z J.Influence of plant community succession on soil physical properties during subalpine coniferous plantation rehabilitation in western Sichuan.Journal of Soil and Water Conservation,2003,17(4):42-45,50-50.
[26] Arunachalam K,Arunachalam A.Effect of soil pH on nitrogen mineralization in regrowing humid subtropical forests of Meghalaya.Journal of the Indian Society of Soil Science,2000,48(1):98-101.
[27] Shen B G.Study on soil fertility in Quercus vqriabilis plantation with thirty-five years.Journal of Fujian College of Forestry,2002,22(2):154-156.
[28] Liu S L,Fu B J,Lü Y H,Chen L D,Ma K M.Assessment of soil quality in relation to land use and landscape position on slope.Acta Ecological Sinica,2003,23(3):414-420.
[29] Zheng H,Ouyang Z Y,Wang X K,Miao H,Zhao T Q,Peng T B.Effects of forest restoration types on soil quality in red soil eroded region,Southern China.Acta Ecological Sinica,2004,24(9):1994-2002.
[30] Turner D P,Koerper G J,Harmon M E,Lee J J.Carbon sequestration by forests of the United States.current status and projections to the year 2040.Tellus B,1995,47(1/2):232-239.
[31] Fang J Y,Chen A P,Peng C H,Zhao S Q,Ci L J.Changes in Forest Biomass Carbon Storage in China between 1949 and 1998.Science,2001,292(5525):2320v2322.
[32] Post W M,Kwon K C.Soil carbon sequestration and land-use change:processes and potential.Global Change Biology,2000,6(3):317v327.
[33] Six J,Callewaert P,Lenders S,De Gryze S,Morris S J,Gregorich E G,Paul E A,Paustian K.Measuring and understanding carbon storage in afforested soils by physical fractionation.Soil Science Society of America Journal,2002,66(6):1981v1987.
[34] McLauchlan K K,Hobbie S E,Post W M.Conversion from agriculture to grassland builds soil organic matter on decadal timescales.Ecological Applications,2006,16(1):143v153.
[35] Zerva A,Ball T,Smith K A,Mencuccini M.Soil carbon dynamics in a Sitka spruce(Picea sitchensis(Bong.)Carr.)chronosequence on a peaty gley.Forest Ecology and Management,2005,205(1/3):227-240.
[36] Shi J,Liu J Y,Gao Z Q,Cui L L.A review on the influence of afforestation on soil carbon storage.Chinese Journal of Ecology,2005,24(4):410-416.
[37] Lugo A E,Sanchez,M J,Brown S.Land use and organic carbon content of some subtropical soils.Plant and Soil,1986,96(2):185-196.
[38] Brown S,Lugo A E.Effects of forest clearing and succession on the carbon and nitrogen content of soils in Puerto Rico and US Virgin Islands.Plant and Soil,1990,124(1):53-64.
[39] Schlesinger W H.Evidence from chronosequence studies for a low carbon-storage potential of soils.Nature,1990,348(6298):232-234.
[40] Silver W L,Ostertag R,Lugo A E.The potential for carbon sequestration through reforestation of abandoned tropical agricultural and pasture lands.Restoration Ecology,2000,8(4):394-407.
参考文献:
[12] 胡泓,刘世全,陈庆恒,王昌全,潘开文,庞学勇.川西亚高山针叶林人工恢复过程的土壤性质变化.应用与环境生物学报,2001,7(4):308-314.
[15] 吴宁,刘庆.山地退化生态系统的恢复与重建——理论与岷江上游的实践.成都:四川科学技术出版社,2007:19-28,32-33.
[16] 江元明,庞学勇,包维楷.岷江上游油松与云杉人工林土壤微生物生物量及其影响因素.生态学报,2011,31(3):801-811.
[17] 王春明,包维楷,陈建中,孙辉,谢嘉穗.岷江上游干旱河谷区褐土不同亚类剖面及养分特征.应用与环境生物学报,2003,9(3):230-234.
[18] 郭永明,汤宗祥.岷江上游水土流失及其防治.山地研究,1995,13(4):267-272.
[19] 鲁如坤.土壤农业化学分析方法.北京:中国农业科技出版社,1999.
[20] 鲍士旦.土壤农化分析(第三版).北京:中国农业出版社,2000:14-38.
[23] 刘占锋,刘国华,傅伯杰,胡会峰,郑晓翾,吴雅琼.人工油松林(Pinus tabulaeformis)恢复过程中土壤微生物生物量C、N的变化特征.生态学报,2007,27(3):1011-1018.
[24] 游秀花.马尾松天然林不同演替阶段土壤理化性质的变化.福建林学院学报,2005,25(2):121-124.
[25] 庞学勇,刘世全,刘庆,吴彦,林波,何海,张宗锦.川西亚高山针叶林人工重建过程中植物群落演替对土壤性质的影响.水土保持学报,2003,17(4):42-45,50-50.
[27] 沈宝贵.35年生栓皮栎人工林土壤肥力研究.福建林学院学报,2002,22(2):154-156.
[28] 刘世梁,傅伯杰,吕一河,陈利顶,马克明.坡面土地利用方式与景观位置对土壤质量的影响研究.生态学报,2003,23(3):414-420.
[29] 郑华,欧阳志云,王效科,苗鸿,赵同谦,彭廷柏.不同森林恢复类型对南方红壤侵蚀区土壤质量的影响.生态学报,2004,24(9):1994-2002.
[36] 史军,刘纪远,高志强,崔林丽.造林对土壤碳储量影响的研究.生态学杂志,2005,24(4):410-416.
