肝细胞癌中BTG2基因的表达及其对肝细胞癌细胞增殖和凋亡影响的研究
2013-12-26,,,
, ,,
(大连医科大学 附属第二医院 综合介入科,辽宁 大连 116027)
基础医学
肝细胞癌中BTG2基因的表达及其对肝细胞癌细胞增殖和凋亡影响的研究
吴杰,宋磊,赵丹懿,郭冰
(大连医科大学 附属第二医院 综合介入科,辽宁 大连 116027)
目的研究肝细胞癌中BTG2基因的表达以及BTG2基因对肝细胞癌HepG2细胞增殖和凋亡的影响。方法荧光定量PCR测定47例肝细胞癌组织中BTG2基因的表达情况。构建表达载体pcDNA-BTG2,转染HepG2细胞。转染后,蛋白质印迹法检测转染后BTG2蛋白的表达,MTT法测定细胞生长抑制率,双标流式细胞法检测细胞凋亡率。结果与癌旁组织相比,BTG2 mRNA在肝细胞癌组织中表达明显下调(P<0.01)。且BTG2的表达与肝细胞癌的分级相关,随着分化程度的升高呈逐渐增加的趋势,但与肝细胞癌的分期及淋巴结转移、远处转移无关。转染表达载体pcDNA-BTG2能够显著上调HepG2细胞中BTG2蛋白的表达,同时,细胞生长抑制率及凋亡率明显增加(P<0.01)。结论在肝细胞癌中BTG2基因表达下调,其表达上调能够抑制肝癌细胞增殖并促进凋亡。
肝细胞癌;BTG2基因;HepG2细胞;增殖;凋亡
肝癌为中国常见恶性肿瘤之一,其恶性程度高,治疗仍以手术为主,预后差,生存期短,按细胞分型可分为肝细胞癌、胆管细胞癌及混合型肝癌,其中最常见的为肝细胞癌[1]。笔者前期的芯片筛查发现,在肝细胞癌组织中B细胞转位基因(B-cell translocation gene 2,BTG2)基因表达降低明显。本研究拟应用荧光定量PCR检测BTG2基因在肝细胞癌中的表达,构建表达载体pcDNA3.3-BTG2并转染肝细胞癌HepG2细胞系,检测转染后BTG2蛋白的表达以及HepG2细胞的细胞抑制率和凋亡率,研究肝细胞癌与BTG2基因的相关性以及BTG2基因对肝细胞癌HepG2细胞增殖和凋亡的影响。
1 材料和方法
1.1 材料和试剂
本研究选取2008—2012年大连医科大学附属第二医院收治的肝恶性肿瘤患者共47例,均接受肝部分切除术治疗。其中男性31例,女性16例;年龄45~66岁,平均年龄(58.1±4.1)岁;肿瘤经病理鉴定诊断为肝细胞癌,所有患者术前均未接受放射和化学治疗。人肝细胞癌HepG2细胞系来源于中国科学院上海生命科学研究院细胞资源中心,由本科室实验室保存。荧光定量PCR检测试剂盒为TaKaRa公司产品,转染试剂TransMessenger为Invitrogen公司产品,表达载体pcDNA3.3-BTG2由Invitrogen公司合成,BTG2多克隆抗体为Abcam公司产品,MTT购自Sigma公司,AnexinV-FITC凋亡检测试剂盒为大连博瑞德公司产品。
1.2 荧光定量PCR
待检测组织标本经液氮冷冻后粉碎,加入TRIZOL,提取总RNA并逆转录成cDNA。两步法扩增BTG2基因。Primer5软件设计BTG2引物,上游为5'-GAACTGTTGCGTGCTTGA-3',下游为5'-AACCTTGCTTGCTCCCTCT-3'。以GAPDH基因为内参,根据实验所获Ct值对BTG2进行相对定量分析,分析方法选用比较Ct值法(2-ΔΔCt法)。
1.3 细胞转染
将HepG2细胞接种在6孔板中(5×104个细胞/孔),培养24 h。1 mg的pcDNA3.3-BTG2或pcDNA3.3与试剂盒中的Enhanser R试剂混合,再与4 μL TransMessenger试剂混合,获得的混合物加入900 μL无血清培养基后用于孵育待转染的A549细胞,2 h后吸去培养基,PBS清洗2次,然后用正常培养基培养。
实验分组如下:空白组(C1)为HepG2细胞;阴性对照组(C2)为转染pcDNA3.3的HepG2细胞;BTG2组(B)为转染pcDNA3.3-BTG2的HepG2细胞。
1.4 蛋白质印迹法
收集各组待测细胞,提取细胞浆蛋白,Bradford法进行定量。蛋白样品上样后,经SDS-PAGE电泳、转膜、封闭、抗体孵育、ECL发光和成像等步骤后获得图像结果。对图像进行分析,BTG2表达的相对值=BTG2条带的灰度值/内参蛋白GAPDH的灰度值。
1.5 MTT检测细胞生长抑制率
收集各组待测细胞,制成细胞悬液(1~2×105/mL),在96孔板中每孔注入200 μL细胞悬液,培养12 h。无血清培养基配制MTT试剂(5 mg/mL),于每孔内注入20 μL,培养4 h。弃去培养基,每孔内注入0.2 mL DMSO,震荡5 min后培养30 min。于490 nm波长处测定待测细胞的吸光度。
1.6 流式细胞仪检测细胞凋亡率
收集各组待测细胞,PBS制成细胞悬液,4 ℃ 1 000 r/min离心1 min(离心机半径13 cm),PBS重悬,重复两次,以PBS制成细胞悬液(5×106/mL),加入10 μL AnnexinⅤ试剂后混匀,避光常温孵育15 min,再加入5 μL的碘化丙锭(10 mg/L)。流式细胞仪进行双色荧光细胞流式计数。
1.7 统计学方法
实验数据以mean±SD表示,应用SPSS18.0统计软件对数据进行处理。应用单因素方差分析进行多样本比较,应用t检验进行组间比较,以P<0.01为差异有统计学意义。
2 结 果
2.1 荧光定量PCR检测BTG2 mRNA在肝细胞癌组织中的表达
荧光定量PCR结果经比较Ct值法分析进行相对定量,肝细胞癌组织和癌旁组织中的△Ct分别为4.235±0.238与3.161±0.266,ΔΔCt为1.074。肝细胞癌组织中BTG2 mRNA的表达明显下调,为癌旁正常组织中BTG2 mRNA表达量的47.50% (P<0.01)。而且,BTG2的表达与肝细胞癌的分级相关,随着分化程度的升高呈逐渐增加的趋势,但与肝细胞癌的分期及淋巴结转移、远处转移无关。
2.2 蛋白质印迹法检测RNA干扰后HepG2细胞中BTG2蛋白的表达
各组蛋白质印迹法结果均呈现清晰条带(图1)。BTG2蛋白在3组细胞中的相对表达量分别为0.764±0.043、0.779±0.052和1.238±0.064。空白组和阴性对照组无明显差异(P>0.05),而与空白组相比,BTG2组细胞中BTG2蛋白的表达明显上调(P<0.01)。
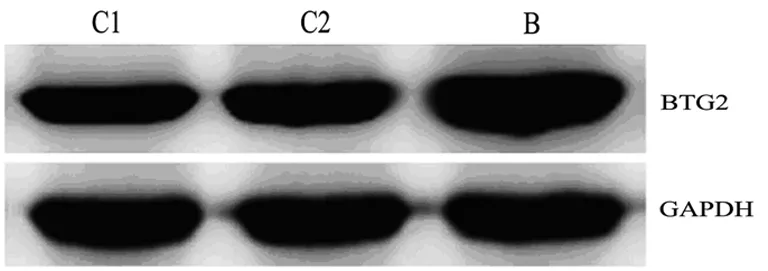
图1 pcDNA3.3-BTG2转染后HepG2细胞中BTG2蛋白的表达
Fig 1 The BTG2 protein expression of the pcDNA3.3-BTG2-transfected HEPG2 cells
2.3 MTT检测细胞抑制率
3组细胞的OD490值分别为0.768±0.037、0.735±0.042和0.564±0.032。阴性对照组和BTG2沉默组的细胞抑制率分别为4.3%和26.6%,BTG2沉默组细胞的增殖抑制更为明显(P<0.01),差异有显著性意义。
2.4 流式细胞仪分析细胞凋亡
3组细胞的凋亡率分别为(2.53±0.19)%、(2.68±0.16)%和(5.26±0.21)%(图2)。空白和阴性对照组无明显差异;与空白组相比,BTG2组的细胞凋亡率增加显著(P<0.01)。

图2 pcDNA3.3-BTG2转染后HepG2细胞中的凋亡率
3 讨 论
BTG2基因是抗增殖基因家族,即BTG/TOB家族的成员之一,是该家族中最早被发现的一个。人BTG2基因是1996年由成淋巴瘤细胞株的cDNA文库克隆的,定位于1q32,有2个编码外显子,编码的蛋白质由158个氨基酸组成[2]。BTG2基因在正常组织中广泛表达。BTG2蛋白能够作为瞬时早期反应蛋白,参与了细胞的分化、增殖、凋亡、DNA损伤修复以及对肿瘤细胞的抑制等多种生理和病理过程[3-4]。BTG2基因可被多种因素、多条途径所激活和调节,且与p53和CREB等肿瘤相关基因具有密切的联系,可能是一种新的抑癌基因[5-6]。
前期的芯片筛查提示BTG2基因在肝细胞癌组织中表达降低明显,本研究通过荧光定量PCR检测47例肝细胞癌及相应癌旁组织中BTG2 mRNA的表达,以期明确BTG2基因是否在肝细胞癌中表达异常。表达结果分析显示,相对于癌旁组织,肝细胞癌组织中BTG2 mRNA表达降低显著,这证实了BTG2基因表达异常与肝细胞癌相关,BTG2基因可能在肝细胞癌的发生进展中作为负性调节因素存在。有研究报道,BTG2基因在肺癌、胃癌和乳腺癌等恶性肿瘤表达亦显著下调,提示BTG2基因在多种肿瘤中的作用机制相似,均作为肿瘤抑制基因发挥作用[7-9]。
为了明确BTG2基因在肝细胞癌中是否亦具有抑制肿瘤细胞过度增殖的作用,本研究将构建好的表达载体pcDNA3.3-BTG2转染HepG2细胞,上调了BTG2蛋白的表达,随后的细胞抑制率检测证实了,BTG2基因高表达的HepG2细胞抑制率上调明显。有研究表明,BTG2主要是通过作用于细胞周期基因来调控细胞周期,进而发挥抑制细胞增殖的作用[10]。此外,BTG2基因高表达的HepG2细胞还显示了较高的凋亡率,这与Zhang等[9]的研究结果一致,BTG2在乳腺癌MDA-MB-231细胞中亦能够诱导细胞凋亡,并抑制细胞增殖。这表明BTG2基因能够参与细胞凋亡的调控过程,具有潜在的诱导凋亡的作用。但其中的具体作用机制尚不清楚,尚需进一步更加精细的实验研究来证实。
[1] Shiraha H,Yamamoto K,Namba M. Human hepatocyte carcinogenesis (review)[J]. Int J Oncol,2013,42(4): 1133-1138.
[2] Rouault JP,Falette N,Guéhenneux F,et al. Identification of BTG2,an antiproliferative p53-dependent component of the DNA damage cellular response pathway[J]. Nat Genet,1996, 14(4): 482-486.
[3] Mauxion F,Faux C,Séraphin B. The BTG2 protein is a general activator of mRNA deadenylation[J]. EMBO J,2008,27(7): 1039-1048.
[4] Wagener N,Bulkescher J,Macher-Goeppinger S,et al. Endogenous BTG2 expression stimulates migration of bladder cancer cells and correlates with poor clinical prognosis for bladder cancer patients[J]. Br J Cancer,2013,108(4): 973-982.
[5] Hwang SL,Kwon O,Lee SJ,et al. B-cell translocation gene-2 increases hepatic gluconeogenesis via induction of CREB[J]. Biochem Biophys Res Commun,2012,427(4): 801-805.
[6] Sasajima H,Nakagawa K,Kashiwayanagi M,et al. Polyubiquitination of the B-cell translocation gene 1 and 2 proteins is promoted by the SCF ubiquitin ligase complex containing βTrCP[J]. Biol Pharm Bull,2012,35(9):1539-1545.
[7] Wei S,Hao C,Li X,et al. Effects of BTG2 on proliferation inhibition and anti-invasion in human lung cancer cells[J]. Tumour Biol,2012,33(4): 1223-1230.
[8] Zhang L,Huang H,Wu K,et al. Impact of BTG2 expression on proliferation and invasion of gastric cancer cells in vitro[J]. Mol Biol Rep,2010,37(6): 2579-2586.
[9] Zhang YJ,Wei L,Liu M,et al. BTG2 inhibits the proliferation,invasion,and apoptosis of MDA-MB-231 triple-negative breast cancer cells[J]. Tumour Biol,2013,34(3): 1605-1613.
[10] Liu M,Wu H,Liu T,et al. Regulation of the cell cycle gene,BTG2,by miR-21 in human laryngeal carcinoma[J]. Cell Res,2009,19(7): 828-837.
ExpressionofBTG2geneinhepatocellularcarcinomaandtheinfluencetoproliferationandapoptosisinHepG2cell
WUJie,SONGLei,ZHAODan-yi,GUOBing
(DepartmentofInterventionalRadiology,theSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China)
ObjectiveTo study the expression of BTG2 gene in hepatocellular carcinoma and the influence of BTG2 gene to proliferation and apoptosis in HepG2 cells.MethodsThe expression of BTG2 gene in 47 cases of hepatocellular carcinoma was detected with real-time PCR. The expression vector pcDNA3.3-BTG2 was constructed and transfected to HepG2 cells. Then,the expression of BTG2 protein was detected by western blot,and the growth inhibitory rate and apoptosis rate of the transfected cells was detected by MTT experiment and flow cytometry.ResultsThe expression of BTG2 gene presented an obvious decreasing in hepatocellular carcinoma. And the expression of BTG2 was related with the classification of hepatocellular carcinoma,with increasing of differentiation there was a gradually increasing trend. But it was not related with the staging,lymph node metastasis and distant metastasis of hepatocellular carcinoma. After transfecting with pcDNA3.3-BTG2,the expression of BTG2 protein of the transfected HEPG2 cells up-regulated significantly. Comparing to the control cells,the apoptosis of experimental group cells increased significantly(P<0.01).ConclusionThere is the expression decreasing of BTG2 gene in hepatocellular carcinoma. The over-expression of BTG2 gene can inhibit proliferation and increase apoptosis of HepG2 cells.
human hepatocellular carcinoma; BTG2 gene; HepG2 cell; proliferation; apoptosis
10.11724/jdmu.2013.06.05
R735.7
A
1671-7295(2013)06-0530-03
吴杰,宋磊,赵丹懿,等.肝细胞癌中BTG2基因的表达及其对肝细胞癌细胞增殖和凋亡影响的研究[J].大连医科大学学报,2013,35(6):530-532,546.
辽宁省科技发展计划项目基金项目(2010225034)
吴 杰(1987-),男,湖北黄石人,硕士研究生。E-mail:wjeastlife@163.com
宋 磊,副教授。E-mail:songlei_1975@126.com
2013-10-22;
2013-11-26)
