hsa-miR-21的生物信息学特征分析
2013-12-25黄海进徐广峰焦峰
黄海进,徐广峰,焦峰
(中国人民解放军第82医院,江苏 淮安 223001)
MicroRNAs(miRNAs)是一类具有在转录后水平调控基因表达功能的非编码小分子 RNAs。据推测[1],miRNA调节着人类三分之一的基因,参与机体诸多生理病理过程。Hsa-miR-21作为一个致癌miRNA,在多种肿瘤的发生和发展中起着重要的作用。近年来,hsa-miR-21在消化道肿瘤发病过程中的作用也受到关注[2-4],但其具体调控机制和生物学功能还不完全清楚。作者对hsa-miR-21已有文献做了分析总结,并通过生物信息学方法对其潜在靶标进行了功能富集分析(GO analysis)和信号转导通路富集分析(pathway analysis),旨在为对其进一步进行功能研究提供理论依据和实验基础。
1 方 法
1.1 实时荧光定量聚合酶链反应(real time quantitative polymerase chain reaction,qPCR)检测
AGS、QBC939、ECA109和 Het-1A细胞购自美国ATCC公司,细胞总RNA抽提试剂 Trizol购自美国Invitrogen公司,miRNA分离试剂盒、逆转录试剂盒及hsa-miR-21和U6探针购自美国Ambion公司。realtime qPCR在ABI 7500 PCR仪上进行。采用2-△△CT法计算hsa-miR-21相对表达量,结果以±s表示。采用SPSS16.0软件,多组均数间的比较采用方差分析F检验,组间两两比较采用q检验,P<0.05为差异具有统计学意义。
1.2 数据来源网站
通过pubmed综述文献支持的hsa-miR-21已有功能;选择miRbase和NCBI数据库分析hsa-miR-21序列保守性和所在基因组特征;选择TargetScan、PicTar、miRanda 3种方法预测hsa-miR-21的靶基因,取3者预测结果的交集,并结合已证实的靶标基因作为进一步分析的基因集合。
1.3 数据分析
将hsa-miR-21的靶基因集合用GeneOntology进行功能富集分类,功能富集分析用到fisher精确检验和χ2检验,分别得到P值和P(k)值,通过多重比较检验,确定功能富集的误判率(false discovery rate,FDR),结果用q值(用来判断P值的准确性)表示,最后得出显著性功能富集,完成功能富集分析。信号转导通路富集分析是对基因参与的所有信号通路进行显著性信号转导通路的分析,用到的分析方法同功能富集分析。
2 结 果
2.1 AGS、QBC939、ECA109及其 Het-1A 细胞株中hsa-miR-21表达水平
实时qPCR检测的结果提示:AGS、QBC939细胞株中hsa-miR-21表达水平显著上调,明显高于Het-1A细胞(图1)。
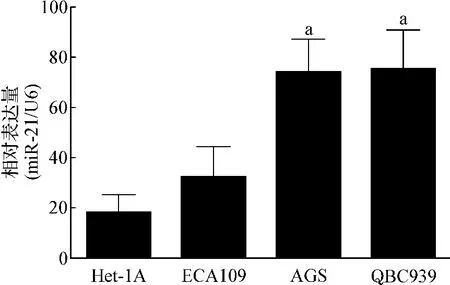
图1 hsa-miR-21在 AGS、QBC939、Het-1A 和 ECA109细胞中相对表达量Fig 1 Relative expression level of hsa-miR-21 in AGS,QBC939,Het-1A and ECA109 cell line
2.2 hsa-miR-21已有功能分析
通过pubmed检索的文献可见,hsa-miR-21参与多种肿瘤、肥胖以及动脉粥样硬化的发病机制(表1)[5-14]。
2.3 miR-21的同源性鉴定
hsa-miR-21定位于人17q23.1,由miRbase数据库获取的miR-21序列信息可见,在包括人、小鼠、褐鼠、恒河猴、黑猩猩、大猩猩、婆罗州猩猩、豚尾猕猴、蜘蛛猴、侏儒黑猩猩、欧洲牛、鸡、短尾负鼠、中国仓鼠、鸭嘴兽、狗、普氏野马、珍珠鸟、安乐蜥以及野猪在内的20个物种间miR-21的“UAGCUUAUCAGACUGA UGUUGA”22个碱基序列具有高度的保守性。

表1 文献支持的hsa-miR-21直接相关靶标Tab 1 Direct related target of hsa-miR-21 supported by literature
2.4 hsa-miR-21的候选靶基因
Targetscan、PicTar及MiRanda预测的 hsa-miR-21靶基因数量分别为210、175、5 203个,3种预测方法结果的交集并结合已证实的10个靶标共获得32个候选靶基因(表2)。
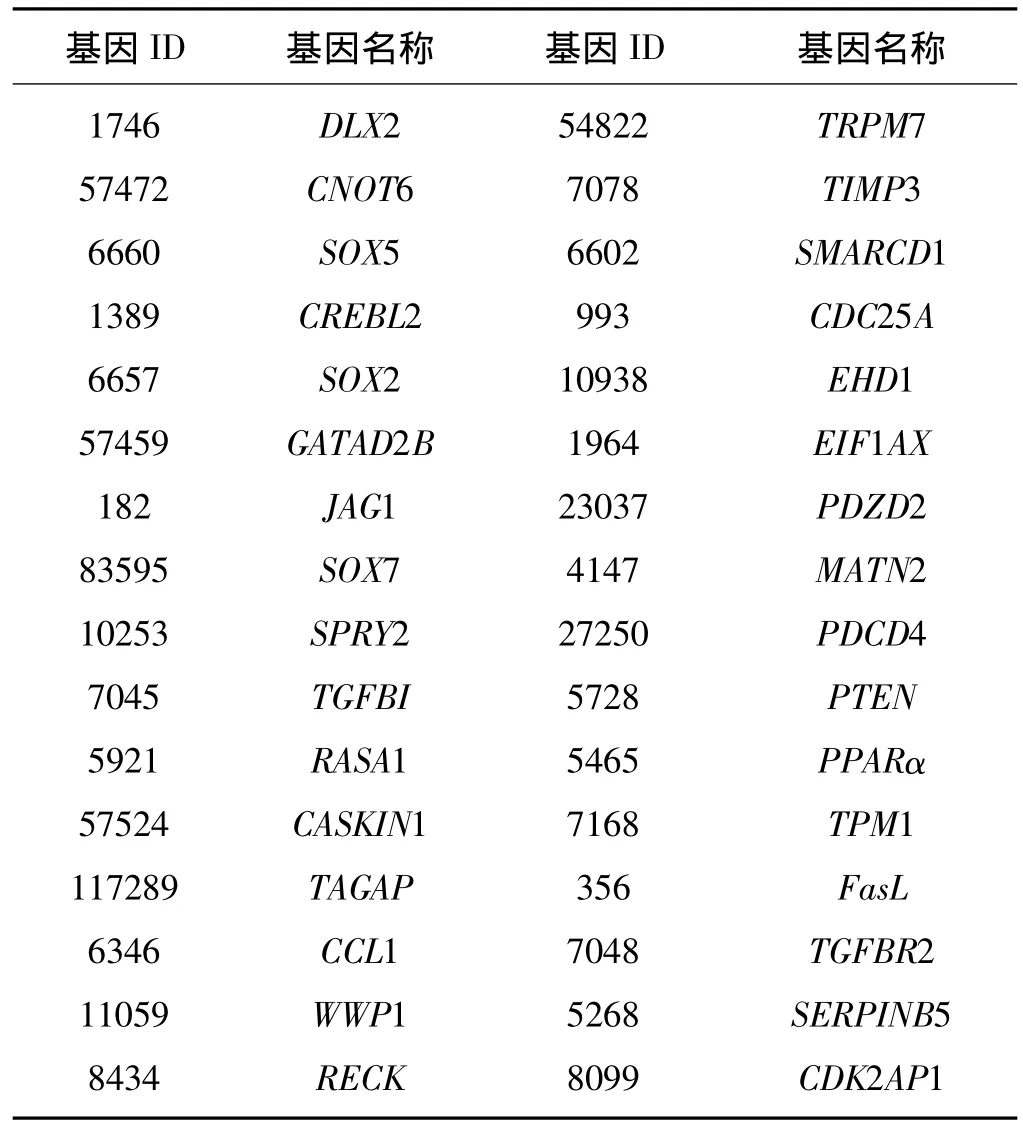
表2 hsa-miR-21候选靶基因Tab 2 Candidate target genes of hsa-miR-21
2.5 hsa-miR-21候选靶基因集合的功能富集分析结果
功能富集分析预测的结果显示,hsa-miR-21调控的靶基因功能分别富集于转录调控、信号转导和Notch信号通路的正向调控等生物学过程(图2)。
2.6 hsa-miR-21候选靶基因集合的信号转导通路富集分析结果
信号转导通路富集分析的结果显示,hsa-miR-21靶基因显著富集于Notch信号通路、细胞周期和轴突导向等信号转导通路(图3)。
3 讨 论
近年来,miRNA的功能引人关注。已证实miRNA是真核生物体内一类对基因进行转录后水平调控的非编码单链小分子RNA,调控着人类近三分之一基因的功能,几乎参与一切重要生命活动和大多数疾病的发病过程[1]。国内有多篇优秀文章对miRNA与肿瘤的关系做了总结[15-16]。最近,hsa-miR-21在肿瘤发病过程中的生物学作用也受到关注[17],本实验结果表明hsamiR-21在胃癌细胞株以及胆管癌细胞株中呈显著高表达,提示该miRNA可能参与消化道肿瘤的发病机制。
miRNA通过与靶基因的3'非编码区结合,从而起到降解或抑制靶mRNA翻译的作用。目前,一些hsamiR-21的直接靶基因及部分功能已经得到了鉴定,从表1中我们可以看到hsa-miR-21通过调控相应的靶基因参与肿瘤的形成、发展及转归。我们对多个物种间的成熟miR-21序列进行了比对,发现其在多个物种间保持高度保守,提示miR-21在进化过程中稳定性和重要性十分显著,进一步探讨其生物学功能对于肿瘤等疾病的防治可能具有重要意义。
目前,生物信息学已成为研究miRNA最重要的工具之一。miRNA与靶基因的作用具有精密的时空调控特异性,一条miRNA通常具有调控多个基因的功能,而同一基因也可能接受多个miRNA调控,生物信息学可以对这些海量和复杂信息进行分析和处理。hsa-miR-21作为一条致癌miRNA近来受到较多的关注[2-5,15],我们综合 Targetscan、PicTar及 MiRanda 等在线工具预测的hsa-miR-21靶基因以及研究证实的靶基因,进行靶基因功能富集分析和信号转导通路富集分析,得到hsa-miR-21靶基因主要参与转录调控、信号转导和Notch信号通路的正向调控等生物学过程,涉及Notch、细胞周期等信号转导通路的结果。我们将以此为理论依据,同时结合实验结果,进一步探讨hsamiR-21参与消化道肿瘤的发病机制。
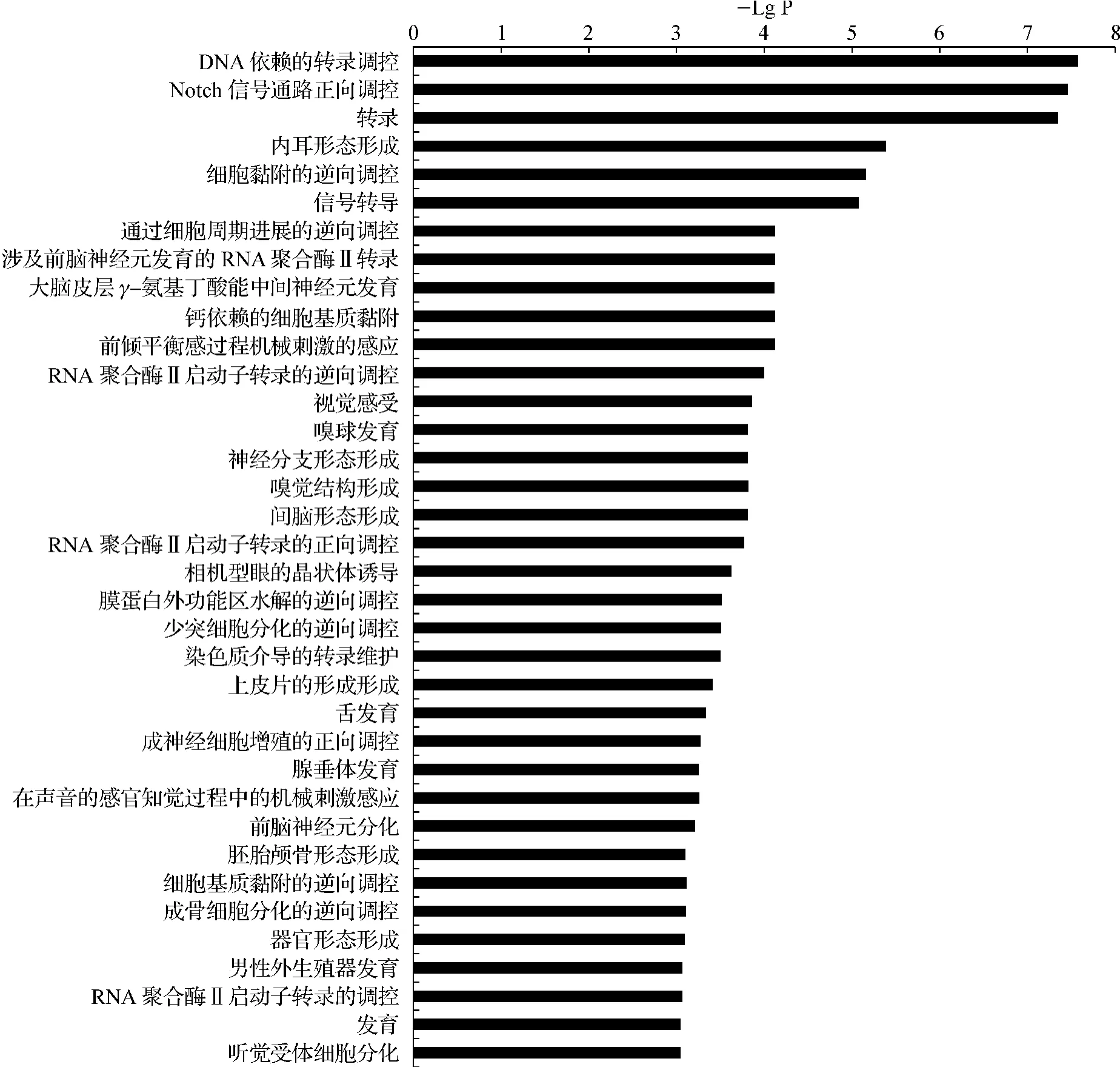
图2 hsa-miR-21候选靶基因集合的功能富集分析结果Fig 2 GO analysis of candidate target genes of hsa-miR-21
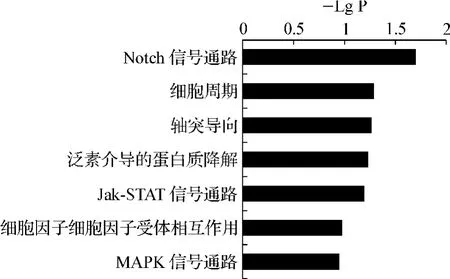
图3 hsa-miR-21候选靶基因集合的信号转导通路富集分析结果Fig 3 Pathway analysis of candidate target genes of hsa-miR-21
[1]HOBERT O.Gene regulation by transcription factors and microRNAs[J].Science,2008,319(5871):1785-1786.
[2]MA W J,LV G D,TUERSUN A,et al.Role of microRNA-21 and effect on PTEN in Kazakh's esophageal squamous cell carcinoma[J].Mol Biol Rep,2011,38(5):3253-3260.
[3]ZHANG B G,LI J F,YU B Q,et al.microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J].Oncol Rep,2012,27(4):1019-1026.
[4]SELARU F M,OLARU A V,KAN T,et al.MicroRNA-21 is overexpressed in human cholangiocarcinoma and regulates programmed cell death 4 and tissue inhibitor of metalloproteinase 3[J].Hepatology,2009,49(5):1595-1601.
[5]ASANGANI I A,RASHEED S A,NIKOLOVA D A,et al.MicroRNA-21(miR-21)post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer[J].Oncogene,2008,27(15):2128-2136.
[6]ZHOU X,REN Y,MOORE L,et al.Downregulation of miR-21 inhibits EGFR pathway and suppresses the growth of human glioblastoma cells independent of PTEN status[J].Lab Invest,2010,90(2):144-155.
[7]ZHANG Z,LI Z,GAO C,et al.miR-21 plays a pivotal role in gastric cancer pathogenesis and progression[J].Lab Invest,2008,88(12):1358-1366.
[8]ZHOU J,WANG K C,WU W,et al.MicroRNA-21 targets peroxisome proliferators-activated receptor-alpha in an autoregulatory loop to modulate flow-induced endothelial inflammation[J].Proc Natl Acad Sci U S A,2011,108(25):10355-10360.
[9]GABRIELY G,WURDINGER T,KESARI S,et al.MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators[J].Mol Cell Biol,2008,28(17):5369-5380.
[10]ZHU S,SI M L,WU H,et al.MicroRNA-21 targets the tumor suppressor gene tropomyosin 1(TPM1)[J].J Biol Chem,2007,282(19):14328-14336.
[11]WANG K,LI P F.Foxo3a regulates apoptosis by negatively targeting miR-21[J].J Biol Chem,2010,285(22):16958-16966.
[12]KIM Y J,HWANGSJ,BAE Y C,et al.MiR-21 regulates adipogenic differentiation through the modulation of TGF-beta signaling in mesenchymal stem cells derived from human adipose tissue[J].Stem Cells,2009,27(12):3093-3102.
[13]ZHU S,WU H,WU F,et al.MicroRNA-21 targets tumor suppressor genes in invasion and metastasis[J].Cell Res,2008,18(3):350-359.
[14]ZHENGJ,XUE H,WANGT,et al.miR-21 downregulates the tumor suppressor P12 CDK2AP1 and stimulates cell proliferation and invasion[J].J Cell Biochem,2011,112(3):872-880.
[15]王旭辉,陈明.miRNA和前列腺癌发生发展的关系[J].东南大学学报:医学版,2012,31(4):512-515.
[16]石明,仇学梅,樊红.血浆miRNA检测在肿瘤临床应用的研究进展[J].东南大学学报:医学版,2012,31(1):122-125.
[17]FU X,HAN Y,WU Y,et al.Prognostic role of microRNA-21 in various carcinomas:a systematic review and meta-analysis[J].Eur J Clin Invest,2011,41(11):1245-1253.
