咽炎饮对咽炎大鼠血液流变学和炎症因子的影响
2013-12-23段美秀王志义辽宁医学院研究生学院辽宁锦州00锦州石化医院辽宁锦州00
段美秀,王志义 (.辽宁医学院研究生学院,辽宁 锦州00;.锦州石化医院,辽宁 锦州00)
咽炎是常见的上呼吸道疾病,由于气候变化、生活条件和工作环境等的影响,发病率正逐年上升,尤其在季节变换的时候,又以吸烟者居多。有单一采用中药汤剂或中成药的动物实验研究,也有联合抗菌药或地塞米松的治疗研究。而抗菌药的长期或反复应用,容易引起咽部菌群失调,造成咽炎易发,不利于根治。同时,针对上感等易引发咽炎的疾病和咽炎易感人群,用于预防的药物研究甚少。中医认为“咽喉为肺之关,胃之门”,因而研究咽炎的发生发展、有效防治咽炎在临床上显得尤为重要。咽炎饮是锦州石化医院院内处方,由金银花20 g、连翘20 g、板蓝根30 g、薄荷10 g、麦冬15 g等组成,开水泡服,简便易行,加入薄荷、金银花等改善口感,气味芳香,诸药合用清热利咽、滋阴、消肿,清中有补,适于广大咽炎患者的治疗和预防。本实验对大鼠急性咽炎模型予以咽炎饮灌胃,考察咽炎饮的效用和作用机制,以丰富临床治疗。
1 材料与方法
1.1 仪器与试剂 双黄连口服液(哈药集团三精制药,批号100902);大 鼠 TNF-α(批 号20110429)、IL-1β(批 号20110424)试剂盒,购自上海酶联生物科技有限公司;兔抗大鼠MMP-2(批号BA1173)、MMP-9(批号BA1178)抗体均购自北京博奥森公司。
1.2 咽炎饮药物配备 咽炎饮组方为金银花、连翘、板蓝根、大青叶、麦冬、蒲公英、薄荷等(锦州石化医院中药房提供,经辽宁中医药大学严锋教授鉴定为正品)。将1剂咽炎饮中的板蓝根、连翘、麦冬研末,与金银花、薄荷等一起置于500 mL的广口瓶中,加入沸水350 mL,密封浸泡20 min(每5 min摇匀1次)后,封闭过滤取滤液,向滤渣中再加沸水350 mL,浸泡摇匀20 min同前,过滤后合并滤液,用旋转蒸发仪浓缩成136 mL(相当于生药1.8 g·mL-1)药液,4 ℃存放,备用。
1.3 实验动物、模型制备及分组 清洁级SD 雄性大鼠50只,体质量200~250 g,辽宁医学院实验动物中心提供,合格证号:SCXK(辽)2003-0007。
从实验动物中心领取大鼠,适应性喂养1周后,随机分为5 组:空白组、模型组、双黄连组、治疗给药组和预防给药组,每组10 只。除空白组外,其余4组给予15%浓氨水喷咽,bid,每次3掀,连续3 d[1]。预防组每次造模前10 min给予咽炎饮2 mL灌胃,bid,余组正常喂养。造模成功后,给予双黄连2 mL(双黄连组)、咽炎饮2 mL(治疗组)灌胃,预防组继续灌胃如前,连续1周,每日记录大鼠一般状态。
1.4 血液流变学检测 上述处理后,全部大鼠禁食水12 h,次日晨起称重,腹腔20% 乌拉坦(5 mL·kg-1·d-1))麻醉。开胸,于心尖处取血4 mL后进行检测。
1.5 ELISA 检测TNF-α、IL-1β含量 100 mg组织制成匀浆,提取上清液→稀释标准品→标准品孔加入标准品50μL和链霉亲和素-HRP50μL,样品孔加入组织上清液40μL、链霉亲和素-HRP50μL 和生物素标记二抗10μl,混匀,37℃反应60 min→30倍浓缩洗涤液用30倍纯化水稀释,重复洗板5 次,拍干→每孔先后加入50μL显色液A、B,混匀,37℃避光显色10 min→每孔加入50μL 终止液→10 min之内,以空白孔调零,于450 nm 波长处测各组吸光度(OD 值)并记录。
1.6 Western-Blot测定MMP-2 和MMP-9 表达 100 mg组织加入裂解液剪碎,移入EP管中,超声粉碎,4 ℃、12 000 r·min-1离心25 min,取上清液测蛋白含量。各取等量的样本进行SDS-PAGE电泳,浓缩胶电压80 V,分离胶电压120 V,半干法将蛋白质转移到PVDF 膜上,TBS 冲洗,封闭,TBS冲洗,将膜放入一抗(1∶500稀释)中,4 ℃过夜。TTBS冲洗后,将膜放入二抗(1∶500稀释)中,室温孵育1~2 h,然后TTBS洗膜3次,每次10 min,NBT/BCIP 显色液中避光显色,直至出现,终止反应。扫描蛋白印迹显影图,利用凝胶自动分析成像软件Chem Image 5500 对蛋白带进行分析。以各组MMP-2、MMP-9表达与内参表达比值表示MMP-2、MMP-9的相对表达水平。
2 结果
2.1 一般状态 模型组大鼠食量减少,饮水增多,呼吸加快,声音嘶哑,严重者可闻及痰鸣音。肉眼可见咽部红肿,有黄白溃疡点,附着透明黏稠分泌物。
2.2 血液流变学检测结果 模型组各指标较空白组均有升高(P<0.05),差异有统计学意义。其他组与模型组相比(P<0.05),说明咽炎饮和双黄连都是有效的。而与双黄连组比较,治疗组和预防组多数指标略有下降,只有全血还原黏度比较有统计学意义(P<0.05),说明咽炎饮改善咽炎大鼠微循环的效果显著,比双黄连疗效略好。见表1、表2。
表1 咽炎饮对大鼠咽炎血液流变学的影响±s,n=10)Tab 1 Effects of pharyngitis drink on blood rheology in pharyngitis rats±s,n=10)

表1 咽炎饮对大鼠咽炎血液流变学的影响±s,n=10)Tab 1 Effects of pharyngitis drink on blood rheology in pharyngitis rats±s,n=10)
注:与空白组比较,aP<0.05;与模型组比较,b P<0.05;与双黄连组比 较,c P<0.05
组别 全血黏度/m Pa·s 全血还原黏度/m Pa·s高切(150 s-1)低切(1 s-1)高切(150 s-1) 低切(1 s-1)空白组 4.8±0.5bc 11.6±0.4b 7.6±0.4bc 25.90±0.32 bc模 型 组 7.6±0.9ac 12.7±0.7ac 8.6±0.5a 6.7±0.5ac双黄连组6.0±0.8ab 11.7±0.4b 8.3±0.4a 26.6±0.4ab治疗组 5.9±0.7ab 11.7±0.4b 8.09±0.32bc 26.5±0.4ab预防组 6.0±1.9ab 11.7±0.4b 8.1±0.4bc 26.48±0.34 bc
表2 咽炎饮对大鼠咽炎血液流变学各指标的影响±s,n=10)Tab 2 Effects of pharyngitis drink on the parameters of blood rheology in pharyngitis rats±s,n=10)

表2 咽炎饮对大鼠咽炎血液流变学各指标的影响±s,n=10)Tab 2 Effects of pharyngitis drink on the parameters of blood rheology in pharyngitis rats±s,n=10)
注:与空白组比较,aP<0.05;与模型组比较,b P<0.05;与双黄连组比 较,c P<0.05
组别 血浆黏度/mPa·s红细胞压积/%红细胞聚集指数红细胞刚性指数空白组 1.39±0.26b 44.3±0.7bc 2.77±0.32b 6.6±0.8 bc模型组 1.86±0.33ac 48.0±0.6a 3.1±0.4ac 7.6±1.1a双黄连组1.5±0.4b 47.6±0.7a 2.64±0.25b 7.1±0.6a治疗组 1.6±0.4b 47.1±0.6ab 2.6±0.4b 6.8±0.8b预防组 1.6±0.25ab 47.4±0.8ab 2.6±0.4b 7.3±0.8 ab
2.3 ELISA 检测TNF-α、IL-1β结果 与空白组比较,模型组TNF-α、IL-1β显著增多(P<0.05),差异有统计学意义;经咽炎饮预防和治疗给药后TNF-α、IL-1β减少(P<0.05),说明咽炎饮抑制炎症因子释放,对抗大鼠咽炎的效果显著;与双黄连组比较(P<0.05),疗效较双黄连更好。见表3。
2.4 Western-Blot测定MMP-2、MMP-9表达的结果 模型组MMP-2、MMP-9表达较空白组增强(P<0.05),差异有统计学意义;经咽炎饮预防和治疗给药后均有MMP-2、MMP-9表达减弱(P<0.05);与双黄连组疗效比较差异有统计学意义(P<0.05),说明咽炎饮抑制蛋白表达比双黄连效果更好,对抗大鼠咽炎有统计学意义。见图1和表4。
表3 咽炎饮对咽炎大鼠TNF-α和IL-1β的影响±s,n=10)Tab 3 Effects of pharyngitis drink on TNF-αand IL-1βin pharyngitis rats±s,n=10)

表3 咽炎饮对咽炎大鼠TNF-α和IL-1β的影响±s,n=10)Tab 3 Effects of pharyngitis drink on TNF-αand IL-1βin pharyngitis rats±s,n=10)
注:与空白组比较,aP<0.05;与模型组比较,b P<0.05;与双黄连组比 较,c P<0.05
组别 TNF-α/ng·L-1 IL-1β/ng·L-1空白组 40.6±7.6bc 56.5±11.2 bc模型组 88.3±9.4ac 94.3±10.5ac双黄连组 50.9±9.8ab 67.9±9.8ab治疗组 48.5±7.6b 60.3±7.6b预防组 75.6±8.2bc 78.9±8.7 bc
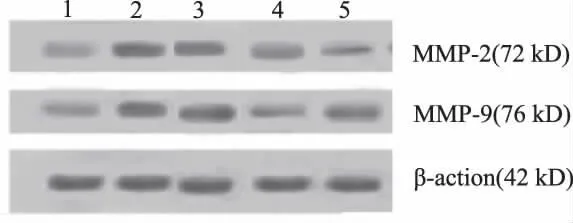
图1 各组大鼠MMP-2和MMP-9的表达1-空白组;2-模型组;3-双黄连组;4-治疗组;5-预防组Feg 1 The expression of MMP-2 and MMP-9 of Rats in each group 1-blank group;2-model group;3-shuanghuanglian-group;4-treatment group;5-prevention group
表4 咽炎饮对咽炎大鼠MMP-2和MMP-9表达的影响±s,n=10)Tab 4 Effects of pharyngitis drink on the expression of MMP-2 and MMP-9 in pharyngitis rats±s,n=10)

表4 咽炎饮对咽炎大鼠MMP-2和MMP-9表达的影响±s,n=10)Tab 4 Effects of pharyngitis drink on the expression of MMP-2 and MMP-9 in pharyngitis rats±s,n=10)
注:与空白组比较,aP<0.05;与模型组比较,b P<0.05;与双黄连组比 较,c P<0.05
组别 AMMP-2/Aβ-actin AMMP-9/Aβ-actin空白组 0.42±0.25bc 0.35±0.08 bc模型组 1.02±0.14ac 0.96±0.35ac双黄连组 0.77±0.05ab 0.78±0.12ab治疗组 0.65±0.10abc 0.55±0.06bc预防组 0.54±0.04bc 0.57±0.03 bc
3 讨论
咽下接食道,与胃相通,司饮食吞咽;下接气道,与肺相通,共同行呼吸和发音。模型组大鼠咽部红肿,有溃疡,附着透明黏稠分泌物,属热毒蕴结证[2],故食量减少,呼吸加快,声音改变。咽炎蔓延,红细胞因表面电荷失衡而聚集,且咽部长时间异物刺激产生代谢性毒物使红细胞功能受损、变形性降低,使血液呈“高黏状态”[3]。血液黏度愈高,流变性愈小,流速愈慢,流量愈少[4]。如表1、2 所示,与模型组比较,经过咽炎饮灌胃,血液的黏、凝、聚改变明显减轻(P<0.05),表明咽炎饮能有效改善咽炎。
炎症反应早期,单核一巨噬细胞即释放TNF-α,随炎症蔓延,TNF-α 亦增多,在炎症反应过程中起着重要作用。TNF-α既可作用于其他免疫细胞和免疫辅助细胞,也可诱生其自身及IL-1 等细胞因子,促进炎症反应清除病原[5]。咽炎发病时,作为炎症反应主要介质的的IL-1β增多,通过刺激造血细胞和淋巴细胞增殖分化,抑制金属蛋白酶组织抑制因子,调节宿主对微生物感染的免疫反应及参与细胞外基质的分解代谢,在咽炎发生发展过程中起重要作用。同时,IL-1β诱导单核—巨噬细胞产生更多的TNF-α和IL,促进黏附因子和趋化性细胞因子的产生,进而引起单核细胞和T 淋巴细胞的聚集与浸润[6]。如表3 所示:与空白组比较,模型组TNF-α、IL-1β分泌明显增多,而经咽炎饮灌胃者TNF-α、IL-1β分泌显著减少(P<0.05),且较双黄连更能减少TNF-α、IL-1β分泌,抑制炎症蔓延。
正常组织只有少量的MMP,炎性细胞侵入后便成为MMP的生产来源。同时,TNF-α、IL-1β的释放可诱导MMP合成[7]。炎性细胞浸润,与炎性因子相互诱导影响MMP的表达。MMP-2、MMP-9是水解变性胶原及基膜的主要成分,可影响酶与细胞外基质的相互作用。有文献报道,抑制MMP-2可有效减轻组织破坏及炎症过程[8]。综上所述,咽炎饮对大鼠咽炎既有治疗作用,又有预防作用,且疗效较双黄连为好。其作用机制可能与改善微循环和抑制炎症因子分泌有关,具体机制有待进一步研究。
[1] 高瑞宁,陈燕,陈兆全.清咽喷雾剂对急性咽炎治疗作用的实验研究[J].中医研究,2009,22(1):19-21.
[2] 王付,怎样分型辨治慢性咽炎[J],中医杂志,2011,(1):65.
[3] 彭顺林,邓谦,邓晓筑,慢性咽炎血液流变学实验观察[J].中国血液流变学杂志,2003,(13)2.
[4] 彭顺林,邓谦,利咽口服液对实验性慢性咽炎模型动物的血液流变学的影响[J].中西医结合耳鼻喉科杂志2004,12(2):57-59.
[5] 袁伟锋,黄文杰,TNF-α基因单核核酸多态性与肺炎的相关性研究[D].南方医科大学硕士学位论文,2008.
[6] 常春荣,潘亚萍.冠心病伴牙周炎患者在牙周基础治疗前后血清及龈沟液中丁TNF-α、IL-1β及IL-6水平的变化[D].中国医科大学硕士学位论文,2009.
[7] 张莉,杨持.MMP-2和CRP 在咽炎动物模型中的表达与意义[J].中华实验与临床感染病杂志,2009,3(3):259-264.
[8] 陈锡美,刘文滨,陈文骏,等.溃疡性结肠炎患者基质金属蛋白酶2、9和抑制因子1、2 的表达及意义[J].中国内科杂志,2003,20:384-386.
