水中氧含量对脂肪乳氧化稳定性的影响
2013-12-23李瑞强祖元刚王化王硕于欣洋杨磊赵修华东北林业大学生物资源生态利用国家地方联合工程实验室黑龙江哈尔滨150040
李瑞强,祖元刚,王化,王硕,于欣洋,杨磊,赵修华 (东北林业大学生物资源生态利用国家地方联合工程实验室,黑龙江 哈尔滨150040)
脂肪乳注射液被作为肠外营养的能量来源已经有50多年的历史。它安全性好,对静脉无刺激,不仅可以为患者快速提供高能量,而且与氨基酸、维生素、电解质等治疗性输液还有很好的兼容性,可以配合使用,已经成为提高药物疗效的重要制剂研究方向[1]。目前,医用脂肪乳通常使用中/长链三酰甘油为油相的微乳制剂[2-3]。这些脂肪酸为机体提供能量和必需脂肪酸,但从另一方面来看,多不饱和脂肪酸易氧化产生脂质过氧化,分解出醛、酮、酸等小分子复杂化合物,影响乳剂体系的极性平衡和质量,出现破乳、漂油等现象,进而损害脂质、蛋白质和DNA,从而造成组织损伤。从理论上讲,脂肪乳剂中多不饱和脂肪酸含量越高,其引发的脂质过氧化程度越重[4]。
虽然目前对于脂肪乳的研究很多,为防止脂肪乳剂的过氧化,通常在配方中适量添加具有抗氧化作用的维生素E[5-7],包装都是以封闭性好的玻璃瓶为主。玻璃瓶虽可降低脂肪乳剂在贮存过程中的过氧化问题,但仍未能在提高其稳定性方面有较大的突破。
本试验研究了水中含氧量对脂肪乳体系氧化稳定性的影响,对加速氧化条件下,脂肪乳粒径大小和形貌变化、离心稳定性、过氧化值及氧化产物的动态变化进行检测,对提高脂肪乳稳定性的有效途径进行了探讨。
1 材料及仪器
长链三酰甘油(LCT),中链三酰甘油(MCT),铁岭北亚药用油有限公司;卵磷脂S100,上海利宝德生物科技有限公司;维生素E,西安德天药业股份有限公司。注射用水1:纯化水,制备后储存3 h以上使用;注射用水2:去离子水,蒸馏后储存3 h以上使用;注射用水3:去离子水,蒸馏后直接使用。Brookhaven Zeta激光粒度仪(美国);JEM-1200透射电子显微镜(日本电子公司);3K-30超速离心机(美国Sigma公司);UV-2550紫外-可见分光光度计(日本岛津公司)。
2 方法
2.1 试验分组 试验共分为5组,(1)注射用水1组:脂肪乳水相采用注射用水1;(2)注射用水2组:脂肪乳水相采用注射用水2;(3)注射用水2 +维生素E组:脂肪乳水相采用注射用水2,添加0.01%维生素E为抗氧化剂;(4)注射用水3组:脂肪乳水相采用注射用水3;(5)注射用水3+维生素E组:脂肪乳水相采用注射用水3,添加0.01%维生素E 为抗氧化剂。样品放入(60±2)℃烘箱中加速氧化60 d,于第0,12,30,60天取样测定各项指标。
2.2 脂肪乳制备方法 预热,将卵磷脂、油酸及维生素E加入LCT/MCT(1∶1)混合油中溶解,作为油相;将甘油和泊洛沙姆以加入水中溶解,作为水相。在70 ℃进行乳化,调节pH 至7.5~8.5,初乳化10 min,800 bar的压力下匀质6循环,121 ℃灭菌12 min。
2.3 水中氧含量的测定方法 根据马树艳[8]的方法略有改动,Na2S2O3滴定法,淀粉溶液为指示液,滴定至蓝色消失,计算水中氧含量:O2(mol)=M×V×(1/4)。其中:M—Na2S2O3的浓度;V—消耗Na2S2O3的体积。
2.4 粒径大小及分布的检测方法 将100μL脂肪乳用双纯净水稀释30倍后加入3 mL 专用树脂比色皿中,放入激光粒度仪中,在25 ℃测试角90°中测定3次,计算乳剂的平均粒径。
2.5 脂肪乳形态观察 根据何海冰等[9]的方法,取脂肪乳加纯化水稀释50倍,取适量滴至铜筛网上,用2%锇酸熏蒸染色,室温放置至形成薄膜后用透射电子显微镜观察其形态,同时拍摄照片。
2.6 离心稳定性检测[1]取试样0.1 mL,稀释1 000倍,检测500 nm 波长下的吸光度,记为A0。取试样1 mL,转移到1.5 mL离心管,4 000 r·min-1离心15 min,20 ℃,取底部液体0.1 mL,检测500 nm 波长下的吸光度,记为A。离心稳定性常数Ke=(A0-A)/A0
2.7 脂肪乳过氧化值(PV)测定方法 称取脂肪乳冻干样品2.0g,精确至0.001 g,按照中国药典2010年版二部附录ⅦH 方法测定。根据公式PV(meq/kg)=1 000×C(V1-V0)/m 计算。
2.8 脂肪乳甲氧基苯胺值(AV)测定方法 称取脂肪乳冻干样品2.0g,精确至0.001 g,按照中国药典2010年版二部附录ⅣA 分光光度计法测定。
2.9 全氧化值的计算方法 全氧化值=AV+2×PV。
2.10 统计学处理 采用SPSS 17.0 统计学软件进行数据分析,数据用±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
3 结果
3.1 几种注射用水中氧的含量 3种注射用水中氧溶解量如图1所示。注射用水3中溶解的氧气量仅为(2.24±0.28)μmol/100 mL,为注射用水1和2的十分之一。可以看出:虽然3种注射用水中的氧气溶解量都是微量的,但新制备的注射用水中氧含量小于经过储存的水中氧含量,且达到了差异显著。注射用水1 和2 中氧溶解量没有显著差异,2种制备方法对水中氧含量没有明显影响。

图1 3种注射用水中的氧气溶解量Fig 1 Oxygen content in injection water
3.2 脂肪乳全氧化值的变化 全氧化值是国际上常采用的评价油脂氧化劣变程度的指标[10],即2 倍的过氧化值与p-茴香胺值之和。油脂或磷脂氧化后能够生成过氧化物和氢过氧化物等产物,这些产物不仅具有一定的毒性,且磷脂氧化后会影响其乳化性能,进而影响脂肪乳的稳定性,因此对其过氧化值行检测是保证油脂等安全性和脂肪乳稳定性的重要举措[11]。过氧化物除对动物细胞中的线粒体及多种酶有强大杀伤作用外,还能继续分解成多种有害物质,如醛、酮、酸、环氧化物类[12],能够破坏人体细胞膜的正常生理功能,促使疾病的发生和发展,故分解产物的多少,也是衡量注射用油质量的重要指标,它以测定注射用油的甲氧基苯胺值表示。全氧化值是结合以上2个指标对油脂的氧化程度进行评价。各组脂肪乳在加速氧化条件下全氧化值的变化如图2所示。
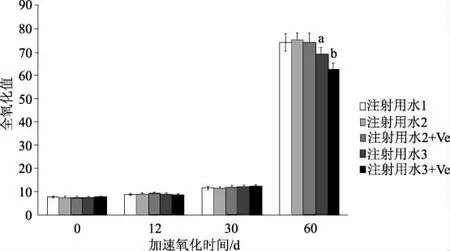
图2 脂肪乳全氧化值随时间变化结果t检验,与注射用水1比较,aP<0.05;b P<0.01Fig 2 Full oxidation value changes with storage days t test,compared with injection water 1,aP<0.05;b P<0.01
5 个样品组的平均初始全氧化值为(7.49±0.31),60 ℃下加速氧化30 d,各试验组的全氧化值缓慢升高,组间均未达到差异显著,表明在短时间内不同注射用水对脂肪乳的氧化稳定性没有明显影响,抗氧化剂的添加对脂肪乳的氧化稳定性也没有明显影响,30 d内乳剂的氧化稳定性良好。加速氧化30~60 d,各组脂肪乳的全氧化值迅速升高,最高为注射用水2组,全氧化值(75.2±3.1),注射用水1组为(74.3±3.6),注射用水3组为(69.2±2.9),与注射用水1 和2 组相比,均达到差异显著(P<0.05),表明水中氧气含量的减少显著降低了脂肪2乳氧化的程度。添加维生素E 的2 组全氧化值均小于相应的未添加抗氧化剂组,表明抗氧化剂的添加抑制了脂肪乳剂的氧化;但2组也存在一定的不同,注射用水2+维生素E 组的全氧化值仅略小于注射用水2组,两者未达到差异显著;而注射用水3+维生素E 组的全氧化值为62.53±2.64,小于注射用水3组,两者差异显著。结果表明,在水中氧含量减少的情况下,抗氧化剂的添加显著提高了脂肪乳抗氧化能力,有效抑制了脂肪乳的氧化率,抑制率为9.63%。
3.3 脂肪乳粒径的变化 脂肪乳剂属于热力学不稳定体系,因而均匀的分散体系是保证制剂物理稳定性的基本要求。脂肪乳的物理稳定性主要取决于乳滴的粒径及粒度分布,并且粒径的大小还影响到药物在体内的分布和代谢[13]。因此,对于其粒径以及粒度分布的考察,有利于对脂肪乳的氧化稳定性进行研究。以不同氧含量注射用水制备的脂肪乳粒径大小及分布变化如图3所示。

图3 脂肪乳粒径大小及强度分布变化图A.注射用水1第0天;B.注射用水1第60天;C.注射用水2第60天;D.注射用水2+维生素E第60天;E.注射用水3第60天;F.注射用水3+维生素E 第60 天;t检验,与注射用水1 比较,aP<0.05,b P<0.01Fig 3 Particle size and intensity distribution changes with storage daysA.injection water 1,0d;B.injection water 1,60 d;C.injection water 2,60 d;D.injection water 2+Ve,60 d;E.injection water 3,60 d;F.injection water 3,60 d;t test,compared with injection water 1,aP<0.05;b P<0.01
各试验组的平均粒径随加速氧化时间的增加而增大,从最初的200 nm 左右增大到第60 天的750.8 nm(注射用水1组),且粒径的分布由最初的集中均一状态转变为不等大小的2个粒径主群。第12天时,注射用水1、2、3组间平均粒径大小差异不显著,2个添加抗氧化剂组与未添加组达到了显著差异。第30天时,注射用水1组与注射用水2、3组间差异显著,而注射用水2、3组间未见明显差异,表明在储存初期水中氧含量的多少未对脂肪乳产生明显影响,显著性差异主要来自于水相本身的其他因素。第60天时,注射用水2、3组间达到差异极显著(P<0.01),表明水中氧含量影响了脂肪乳粒径的变化,氧气含量的减少降低了脂肪乳粒径的增大,结果与全氧化值试验结果相符合。
试验制备的五组脂肪乳初始平均粒径在204.4~226.5之间,且乳滴大小均匀,分布集中,证明3种注射用水制备的脂肪乳均有良好的初始状态,较稳定且易于吸收[14]。各组脂肪乳粒径随加速氧化时间的增加而增大。第60天,注射用水3+维生素E组的平均粒径变为245.0nm,小于第30天的294.5 nm,这并不是由于脂肪乳的乳滴变小造成的,而是因为乳剂的状态由均一集中逐渐转变为破乳,一部分粒径小的液滴降低了乳剂粒径的平均值,这些小的液滴将逐渐汇聚,不断增大,不同组脂肪乳形貌观察如图4所示。
从电镜对脂肪乳氧化后的形貌观察结果可以看出:第60天时注射用水1组和2组(图B、C)的脂肪乳已呈现大面积破乳现象,乳滴分散不均匀,边缘呈不规则化;注射用水3组(E)乳滴粒径明显发生变化,不再是均匀分布,由于热加速氧化的作用,乳剂的稳定性已经被破坏,发生了团聚,粒径变大,但乳滴的边缘仍比较规则;添加抗氧化剂的2 组乳剂(D、F)在相貌上也发生了一定的变化,注射用水2+维生素E 组除粒径发生变化外呈现出一定的边缘不规则状态,注射用水3+维生素E 组仅出现了一定的粒径变大状态,是5组样品中稳定性最好的。形貌研究结果与粒径分布检测结果说明:注射用水3+维生素E组在加速氧化结束时保持了较好的乳剂状态,除氧超纯水添加抗氧化剂能有效防止乳剂因氧化而导致的稳定性降低。
3.4 脂肪乳离心稳定性的变化 脂肪乳离心稳定性检测结果如图5所示,随着氧化时间增加,乳剂的离心稳定性常数Ke呈现变大趋势,表明各组脂肪乳的稳定性随时间的增加而降低。在5 个试验组中,注射用水3+维生素E组保持了最好的稳定性,30 d时的Ke值为0.60±0.019,与其他各组达到差异显著,而其余4组之间未达到差异显著。结果表明:30 d内,水中氧含量对脂肪乳的稳定性没有显著影响,但减少氧含量同时添加抗氧化剂可以有助于提高脂肪乳的稳定性。由于60 d时注射用水1组和注射用水2组已发现明显的破乳现象,所以未对样品进行离心稳定性测定。

图5 脂肪乳离心稳定性随时间变化结果Fig 5 Centrifugal stability changes with storage days
通常为防止脂肪乳注射液的氧化,采用充氮保护、在配方中适量添加抗氧化剂、以玻璃瓶包装及低温储存等方法。这些方法有效的提高了脂肪乳注射液的氧化稳定性,而良好的氧化稳定性标志着优质的脂肪酸成分和为患者提供能量的安全性。在氮气保护下,脂肪乳能够保持长时间的稳定状态,从试验的结果可以看出,注射用水中氧含量毕竟较少,为2~25μmol/100 mL-1,短时间内对脂肪乳氧化稳定性的影响较小。但脂肪乳注射液的保质期为2年,这是一个长期的过程,这个影响会随着储存时间的延长而越来越显著。在0~30 d过程中,水中氧含量的降低对脂肪乳的氧化稳定性,乳滴粒径和离心稳定性的变化并没有产生显著性影响,但在30~60 d过程中,乳剂的全氧化值发生了剧烈变化,由12左右最高增长到75.2,增加了5倍多;同时乳滴的平均粒径和强度分布结果也表明脂肪乳的稳定性发生了巨大的变化,此时注射用水3和注射用水3+维生素E组表现出了与注射用水1组显著性的差异。试验结果表明在长期氧化条件下,去除水中氧能起到增加脂肪乳稳定性的作用,而且在减少水中氧含量和添加抗氧化剂的共同作用下,脂肪乳注射液的稳定性更好。
4 讨论
目前,纯油相体系的氧化理论研究较多,抗氧化剂对于纯油脂的氧化抑制机制也研究得较为成熟,但将这些理论用于含油脂的乳状液体系中时发现,能有效控制纯油脂氧化的各种手段特别是抗氧化剂的抗氧化效果并不理想。本研究的结果显示:控制脂肪乳液体系中水相氧含量有助于提高乳剂的氧化稳定性,减小脂肪乳粒径和离心稳定性的变化;而且水相体系中氧含量的减少有利于提高抗氧化剂的抗氧化效果,进一步降低注射用油脂和磷脂的氧化对脂肪乳带来的质量问题及危害。
[1] 董广金.10%静注脂肪乳的制备与性质考察[D].青岛科技大学,硕士学位论文,2010:3,39-41.
[2] 江华,蒋朱明,蔡威,等.脂肪乳[J].中国临床营养杂志,2007,15(1):17-20.
[3] 陈洁.脂肪乳的特点及临床应用[J].中国医学创新,2012,9(4):158-161.
[4] Shiota M,Konishi H,Tatsumi K.Oxidative stability of fishoil blended with butter[J].J Dairy Sci,1999,82:1877-1881.
[5] Katz DP,Manner T,Furst P,et al.The use of an intravenous fish oil emulsion enriched with omega3 fatty acids in patients with cystic fibrosis[J].Nutrition,1996,12(5):334-339.
[6] 须星,郝艳茹.中/长链脂肪乳注射液国内临床应用进展[J].数理医药学杂,2012,25(2):218-222.
[7] 吴国豪,吴肇汉,吴肇光.含α-维生素E 的脂肪乳剂对外科患者抗氧化状态及脂质过氧化的影响[J].中华胃肠外科杂志,2003,6(3):174-177.
[8] 马树艳.锅炉水中溶解氧的测定[J].化学工程师,2008,11(1):30-31.
[9] 何海冰,唐星.莪术油纳米乳剂的制备及制备工艺影响因素考察[J].沈阳药科大学学报,2005,22(3):164-167.
[10]ISO/DIS6885,2004:Animal and vegetable fats and oils determination of anisidine value[S].
[11]赵明明,苏敏,唐星.载药脂肪乳注射液的研究进展[J].沈阳药科大学学报,2010,27(12):1014-1022.
[12]梅丹,李大魁,赵彬,等.两厂家市售脂肪乳注射液的质量评价[J].中国临床营养杂志,2005,13(2):103-108.
[13]Kurihara A,Shibayama Y,Mizota A,et al.Phamacokinetics of highly lipophilic antitumor agent palmitoyl rhizox in incorporated in lipid emulsions in rats[J].Biol Pharm Bull,1996,19:252-258.
[14]Takino T,Nagaham AE,Sakaeda T,et al.Pharmacokinetic disposition analysis of lipophilic drugs injected with various lipid carriers in the single-pass rat liver perfusion system[J].Int J Pharm,1995,114(1):43-54.
